Разделы: Химия
Цель: изучить химические свойства кислот в свете теории электролитической диссоциации.
Задачи:
Оборудование: таблица растворимости, электрохимический ряд напряжений металлов, наборы посуды и реактивов для проведения химического эксперимента, компьютер, проектор
Планируемый результат:
Ход учебного занятия
1. Организационный момент
2. Проверка домашнего задания
Учащимся задаются частные вопросы
Какие кислоты вам известны? Запишите формулы известных вам кислот на доске (2-3 ученика записывают формулы кислот на доске, дают им названия, остальные работают в тетради)
Что мы называем кислотой?
На какие группы делятся электролиты по степени диссоциации?
Какие вещества относят к электролитам? К неэлектролитам?
Что такое степень диссоциации?
Ваше домашнее заданием было следующим, пользуясь различными источниками информации приготовить ответ на следующие вопросы: Распространенность кислот в природе?
Какие кислоты используются в качестве пищевых добавок?
(задание выдается учащимся за неделю до проведения занятия)
Компетентностно-ориентированные задания (КОЗ)
Компетентность — коммуникативная/ публичное выступление. Уровень 1.
Представь себя в роли учителя, подготовь выступление на 5 мин. и выступи перед учащимися своего класса. Для подготовки используй Интернет-ресурс.
Подготовь план своего выступления и будь готов ответить на вопросы слушателей.
| Наличие плана | Соот. выст. целям | Наличие наглядного |
матер.
3. Объяснение нового материала
Рассмотрим в свете ТЭД свойства веществ, растворы которых обладают электропроводностью
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка (примеры учащиеся записывают в тетради)
По признаку основности кислоты подразделяют на 3 группы:
- одноосновные
- двухосновные
- многоосновные
Ребята, приведите примеры данных кислот.
Мы уже знаем, что диссоциация многоосновных кислот протекает ступенчато. Рассмотрим несколько примеров реакции электролитической диссоциации.
Выйти к доске и записать диссоциацию азотной, серной и фосфорной кислот.
4. Важнейшие общие химические свойства кислот
Учитель объясняет материал (объяснение сопровождается демонстрационными опытами). Все реакции проецируются на экране, учащиеся их записывают в тетради.
HCl + NaOH = NaCl + H 2O
H + + Cl — +Na + + OH — = Na + + Cl — + H 2O
Реакция между кислотой и оксидами металлов
СаO + 2H + + SO4 2- = Са 2+ + SO4 2- + H 2O
СаO + 2H + = Са 2+ + H2O
Реакция между кислотой и солью
Кислоты взаимодействуют с металлами. При этом образуются соли, и выделяется водород. Однако металлы, стоящие в электрохимическом ряду напряжений металлов правее водорода, не вытесняют его из кислот:
Zn 0 + 2H + + 2Cl — = Zn 2+ + 2Cl — + H2 0
Zn 0 + 2H + = Zn 2+ + H2 0
Cu + HCl = реакция невозможна
Концентрированные азотная и серная кислоты реагируют с металлами иначе.
5. Работа по проблемным вопросам
Где в повседневной жизни мы применяем знания о свойствах кислот?
Как, используя лишь индикатор определить растворы следующих веществ: серная кислота, вода, гидроксид натрия?
Как надо провести реакцию, чтобы увидеть ее признаки?
Следующий этап работы — работа в парах.
Учащимся выдается КОЗа.
Перед проведением лабораторного опыта учащимся напоминают правила по технике безопасности.
Компетентностно-ориентированные задания (КОЗ)
1. Компетентность разрешения проблем (идентификация (определение) проблемы, действия по решению проблемы — 1 уровень)
У известного писателя Герберта Уэллса есть замечательный научно-фантастический роман о том, что один изобретатель создал удивительную машину, которая могла переносить человека в любую эпоху прошлого или будущего. Представим себе на минутку, что мы владеем подобной машиной. Перенесемся с ее помощью на несколько веков назад.
В те далекие времена люди считали, что всемогущие, сверхъестественные силы могут сделать все. Священнослужители, для убеждения верующих в чудесах, проделывали следующее: медленно, торжественно, с молитвами чистая вода наливается в сосуд, где она немедленно краснеет, приобретая цвет вина. Это «вино» выливают в другой прозрачный сосуд, где происходит его обесцвечивание. «Вино» не дается для пробы на вкус, а любопытство верующих удовлетворяется только изменением цвета жидкости.
И сегодня нам предстоит выяснить: это чудо или же знание химии?
Для ответа на этот вопрос выполните задание, следуя инструкции.
1. В пробирку налейте 2 мл раствора гидроксида натрия и добавьте 2-3 капли фенолфталеина. Какую окраску приобрел раствор?
2. С помощью пипетки к полученному раствору постепенно прибавьте 2мл раствора соляной кислоты. Что вы наблюдаете?
Отчет о выполненной работе занесите в таблицу
| Реактивы (формула и название вещества) | Уравнения химической реакции (в молекулярной и ионной форме) | Наблюдения | Вывод |
| Реактивы (формула и название вещества) | Уравнения химической реакции (в молекулярной и ионной форме) | Наблюдения | Вывод |
| NaOH-гидроксид натрия | Раствор приобрел красную окраску | В щелочной среде фенолфталеин приобретает красную окраску | |
| NaOH-гидроксид натрия |
HCl — соляная (хлороводородная) кислота
Na + + OH — + H + + Cl — = Na + + Cl — +H2 O
OH — + H + = H2 O
2. Компетентность разрешения проблем (идентификация (определение) проблемы, действия по решению проблемы — 2 уровень). Информационная (обработка информации- 2 уровень)
Современная теория электролитической диссоциации говорит о том, что при растворении в воде электролиты распадаются на ионы. Пользуясь этой теорией, и знаниями о свойствах и классификации кислот ответьте на следующие вопросы:
1. С какими из перечисленных веществ взаимодействует разбавленная серная кислота.
- гидроксид калия
- ртуть
- оксид магния
- оксид фосфора
- алюминий
Запишите возможные реакции в ионном виде
2. Даны сокращенные ионные уравнения:
Cоставить полные ионные и молекулярные уравнения
3. Из перечня кислот
серная кислота, азотная кислота, сернистая кислота,
хлороводородная кислота, кремниевая кислота, угольная кислота выберите:
- кислородсодержащие
- нестабильные
- нерастворимые в воде
- двухосновные
6. Модульный ответ
2K + +2OH — + 2H + + SO 2- 4 = 2K + + SO 2- 4 + 2H2O
MgO + 2H + + SO4 2- = Mg 2+ + SO 2- 4+ H 2O
MgO + 2H + = Mg 2+ + H2 O
Ba 2+ + 2Cl — + 2H + + SO4 2- = BaSO4 + 2H + + 2Cl —
2K + + CO 2- 3 + 2H + + 2Cl — = 2K + +2Cl — + CO2 + H2 O
3) нерастворимые в воде:
8. Домашнее задание
Как различить растворы серной кислоты, хлорида бария, сульфата меди (II), гидроксида натрия, не имея других реактивов? Дать объяснение, записать уравнения химических реакций в молекулярной, полной и сокращенной ионной форме.
Даны сокращенные ионные уравнения реакций:
1) 2OH — + 2H + = 2H2O
2) СаO + 2H + = Са 2+ + H2 O
4) Fe 3+ + 3OH — = Fe(OH)3
Составить полные ионные и молекулярные уравнения реакций.
Записать уравнения химических реакций в молекулярной, полной и сокращенной ионной форме.
Видео:Химия - 8 класс - Кислоты в свете теории ЭД - 16.04.2020Скачать

Уравнения реакций кислот в свете тэд
Как объяснить тот факт, что кислоты, соли и основания вступают в реакции не со всеми веществами, а со строго определенными? Чем определяются свойства кислот, оснований и солей?
На эти вопросы вы найдете ответы на данном уроке.
I. Химические свойства щелочей
1. Взаимодействие щелочей с кислотами: Me(OH)x + HxR
NaOH +HCl 
Na + + OH — + H + + Cl — 
H + +OH — 
2. Взаимодействие щелочей с кислотными оксидами: Me(OH)x + неMexOy
2NaOH +CO2 
2Na + + 2OH — + CO2
2OH — + CO2
Если через пробирку с известковой водой (Ca(OH)2) пропустить углекислый газ (CO2) , то известковая вода мутнеет, следствие образования соли – карбоната кальция (CaCO3).
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но для этого нужно, чтобы образовался осадок или слабый электролит. Если в одну пробирку с гидроксида натрия добавить хлорида аммония (NH4Cl), во вторую – с гидроксидом калия (КОН) добавить сульфат железа (III) (Fe2(SO4)3), а в третью – с гидроксидом натрия добавить хлорид бария (BaCl2) и содержимое первой пробирки нагреем, то в результате появляется резкий запах аммиака (NH3). Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло.
2NaOH +MgCl2

2Na + +2OH — + Mg 2+ +2Cl — 

2OH — + Mg 2+ 
II. Химические свойства солей
1. Взаимодействие солей с металлами: MexOy + Me*
Но нужно быть внимательным и обязательно пользоваться рядом активности металлов. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в этом ряду.
При этом должны соблюдаться условия:
- обе соли (и реагирующая, и образующаяся) должны быть растворимыми
- металлы не должны реагировать с водой (т.е. щелочные и щелочноземельные металлы, которые реагируют с водой с образованием щелочей).
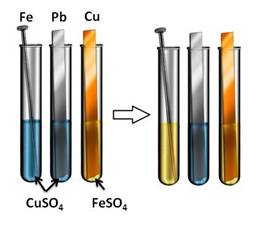
Посмотрим, как это происходит: в первую пробирку поместим железный гвоздь, во вторую – свинцовую пластину, а в третью – медную пластину. В первые две пробирки нальём раствора сульфата меди (II) (CuSO4), а в третью – раствор сульфата железа (II) (FeSO4). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а во второй и третьей пробирке нет никаких изменений. Следовательно, в первой пробирке находился более активный металл, который вытеснил медь из раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат свинца (II)) является нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить его из раствора соли.
Fe0 + Cu 2+ = Fe 2+ + Cu0↓
2. Взаимодействие солей с щелочами:
3. Взаимодействие солей с кислотами:
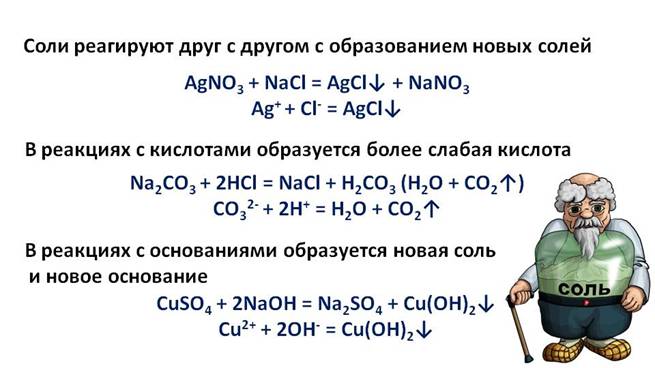
В реакциях солей с солями образуются новые соли, в реакциях с кислотой – образуется новая кислота, в реакциях с основаниями образуется новая соль и новое основание.
III. Химические свойства кислот
Кислоты всегда начинается с водорода, окрашивают лакмус и метиловый оранжевый в красный цвет, ведь в их составе есть ион водорода (H+), который всегда образуется при диссоциации.
Так, при диссоциации соляной кислоты (HCl), образуется ион водорода и хлорид-ион (Cl — ), при диссоциации азотной кислоты (HNO3), тоже ион водорода и нитрат-ион (NO3 — ), при диссоциации азотистой кислоты (HNO2) – ион водорода и нитрит-ион (NO2 — ).
HCl = H + + Cl —
HNO3 = H + + NO3 —
HNO2 ⇆ H + + NO2 —
Именно поэтому, кислоты окрашивают лакмус и метиловый оранжевый в красный цвет.
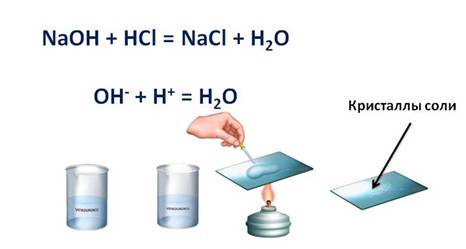
1. Кислоты реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия (NaOH) добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты (HCl), то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
2. Кислоты также вступают в реакции обмена с оксидами металлов. В результате реакции образуется соль и вода. Эта реакция вам уже знакома, наверняка оксиды, вам уже всё рассказали об этом.
Кислота + оксид металла = соль + вода
3. Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для протекания данных реакций необходимо выполнение ряда условий:
- металл находиться в ряду напряжений до водорода
- должна получиться растворимая соль
- если кислота нерастворимая, то она не может вступить в реакцию с металлами.
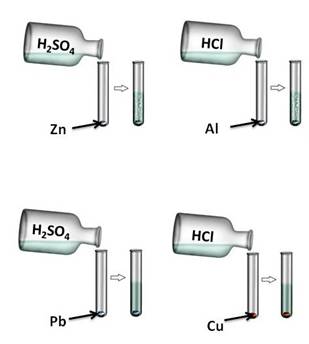
Давайте, попробуем проверить. Поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую –алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты (H2SO4), во вторую и четвёртую – раствора соляной кислоты (HCl). Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
Zn 0 + 2H + = Zn 2+ + H2 0 ↑
2Al 0 + 6H + = 2Al 3+ + 3H2 0 ↑
Кислоты вступаем в реакции обмена с солями, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.
Кислота + соль = новая кислота + новая соль
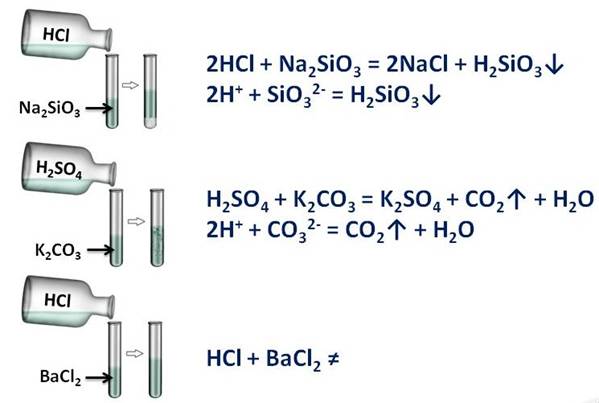
Соляна (HCl) и серная кислоты (H2SO4), вам покажут это: в первой пробирке будет соляная кислота и силикат натрия (Na2SiO3), во второй – серная кислота и карбоната калия (K2CO3), в третьей – опять соляной кислоты и хлорида бария (BaCl2). Посмотрим за изменениями. В первой пробирке мы наблюдаем образование студенистого осадка (H2SiO3), во второй – выделение газа (CO2), а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
IV. Выполнение упражнений
Задание: составьте уравнения цепочки реакций (на “4”)
Еесли реакция является обменом, разберите ее как РИО, если реакция является ОВР, разберите ее с помощью электронного баланса (на “5”)
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Кислоты в свете ТЭД, их классификация и свойства
Урок химии по теме «Кислоты в свете ТЭД, их классификация и свойства» проводился в 8 классе, изучающие данный предмет по авторской программе О.С.Габриеляна.
Урок начинается с повторения реакций ионного обмена, их написания. далее учитель вместе с учащимися дает определение «Кислоты», заполняют таблицу «Классификация кислот по различным признакам»; рассматриваются химические свойства кислот с точки зрения ТЭД, составляются ионные уравнения.
В конце урока проводится работа по закреплению написанию ионных уравненийи хзимических свойств кислот.
Данный урок будет полезен учителям химии для проведения урока и учащимся 8 класса для закрепления знаний.
🌟 Видео
ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Кислоты в свете ТЭДСкачать

Реакции ионного обмена. 9 класс.Скачать

Кислоты в свете ТЭД. 2 частьСкачать

Свойства оснований с точки зрения теории электролитической диссоциации. 9 класс.Скачать

кислоты как электролиты/химия 9 классСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Соли в свете ТЭД.Скачать

Основания в свете ТЭД.Скачать

8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Основания в свете ТЭДСкачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химия, 10-й класс, Свойства кислот, оснований и солей в свете Теории Электролитической ДиссоциацииСкачать

Химия ОГЭ Выпуск 7 2 Свойства кислот, оснований, солей в свете ТЭД Ионные уравненияСкачать

Вся школьная четверть за 15 секунд #shorts #youtubeshorts #химияСкачать