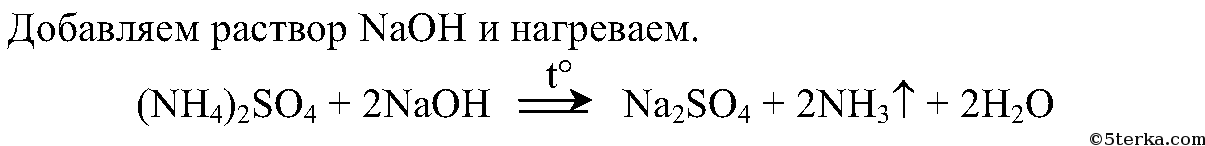Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Видео:Термическое разложение хлорида аммония NH4ClСкачать

С чем реагирует аммоний Хлорид аммония и гидроксид натрия
Хлорид аммония
реагирует с щелочами:
NH4Cl + NaOH —> NaCl + H2O + NH3
реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
NH4Cl + NaNO2 —-> NaCl + N2 + 2H2O
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твёрдых веществ:
c кислотами — с образованием солей и воды:
NaOH + HCl → NaCl + H2O
(1) H2S + 2NaOH = Na2S + 2H2O (при избытке NaOH)
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
(в целом такую реакцию можно представить простым ионным уравнением, реакция протекает с выделением тепла (экзотермическая реакция): OH− + H3O+ → 2H2O.)
с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O
так и с растворами:
ZnO + 2NaOH(раствор) + H2O → Na2[Zn(OH)4](раствор)
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
С амфотерными гидроксидами:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
2. Обмена с солями в растворе:
2NaOH +CuSO4 → Cu (OH)2↓ + Na2SO4,
2Na+ + 2OH− + Cu2+ + SO42− → Cu(OH)2↓+ Na2SO4
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4.
6Na+ + 6OH− + 2Al3+ + SO42− → 2Al(OH)3↓ + 3Na2SO4.
3. С неметаллами:
например, с фосфором — с образованием гипофосфита натрия:
4Р + 3NaOH + 3Н2О → РН3 + 3NaH2РО2.
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
с галогенами:
2NaOH + Cl2 → NaClO + NaCl + H2O(дисмутация хлора)
2Na+ + 2OH− + 2Cl− → 2Na+ + 2O2− + 2H+ + 2Cl− → NaClO + NaCl + H2O
6NaOH + 3I2 → NaIO3 + 5NaI + 3H2O
Видео:хлорид аммония с гидроксидомСкачать

Опыт № 6. Взаимодействие солей аммония со щелочами
Задания. 1. Изучите взаимодействие солей аммония с раствором щелочи.
2. Проведите качественную реакцию на соли аммония.
Оборудование. Штатив с пробирками, нагревательный прибор, держатель для пробирок.
Оборудование. Растворы гидроксида натрия (20% -й), хлорида бария (10% -й), хлорида аммония (20% -й), азотной кислоты (10%-й), фиолетовая лакмусовая бумажка; кристаллический сульфат аммония, вода (в стакане).
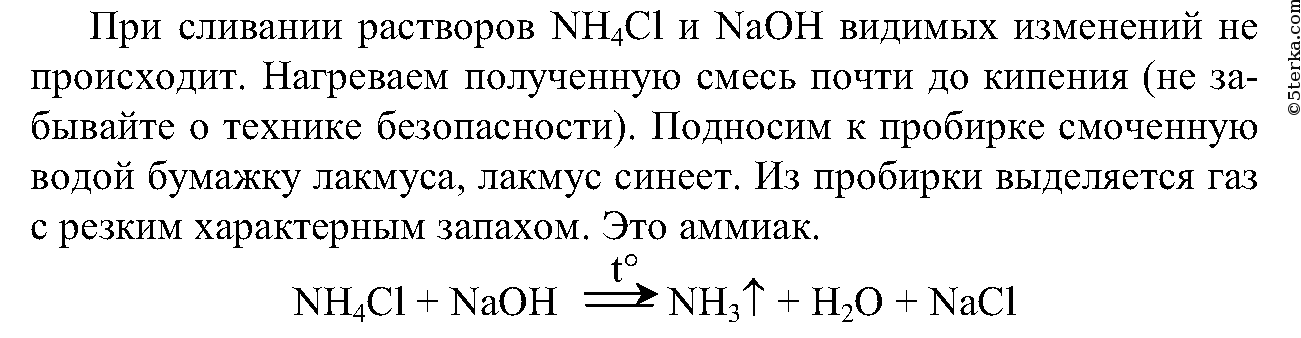
1. Налейте в пробирку 2 мл раствора хлорида аммония и столько же раствора гидроксида натрия. Что вы наблюдаете? Нагрейте эту смесь до начала кипения, соблюдая правила техники безопасности. Поднесите смоченную водой фиолетовую лакмусовую бумажку к отверстию пробирки. Почему изменился цвет индикатора? Определите по запаху выделяющийся газ. Составьте уравнение реакции.
2. Опытным путем докажите, что выданное вам вещество является сульфатом аммония. Составьте соответствующие уравнения реакций.
Сделайте вывод, для каких целей в лабораторной практике могут быть использованы реакции солей аммония со щелочами.
Выпадает белый осадок.
Ион аммония определяется аналогично предыдущему опыту.
Выделяющийся газ имеет резкий характерный запах, а также изменяет окраску лакмуса.
Вывод: реакции солей аммония со щелочами могут быть использованы в лаборатории для получения аммиака.

задача №6
к главе «Лабораторные работы и опыты».
📸 Видео
NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Получение хлорида аммонияСкачать

Получение АММИАКА NH3. Реакция ХЛОРИДА АММОНИЯ и ГИДРОКСИДА НАТРИЯ. Опыты по химии дома.ЭкспериментыСкачать

разложение хлорида аммония при нагреванииСкачать

Образование хлорида аммонияСкачать

Хлорид Аммония. Аммиак. МНОГО ДЫМА БЕЗ ОГНЯ!Скачать

Реакция хлорида аммония с реактивом НесслераСкачать

нитрат серебра с хлоридом аммонияСкачать

9 класс. ОГЭ. Химия. Задания 23 и 24. ХЛОРИД АММОНИЯ. часть 1.Скачать

Получение хлорида аммонияСкачать

хлорид аммонияСкачать

Получаю хлорид аммония из концентрированной соляной кислоты и аммиака. #химия #химияснуля #учительСкачать

Хлорид аммония из удобренийСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Получение аммиака и сульфата аммонияСкачать

Получение хлорида аммонияСкачать

Эксперимент по получению хлорида аммония из 10 раствора аммиакаСкачать

7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ!Скачать