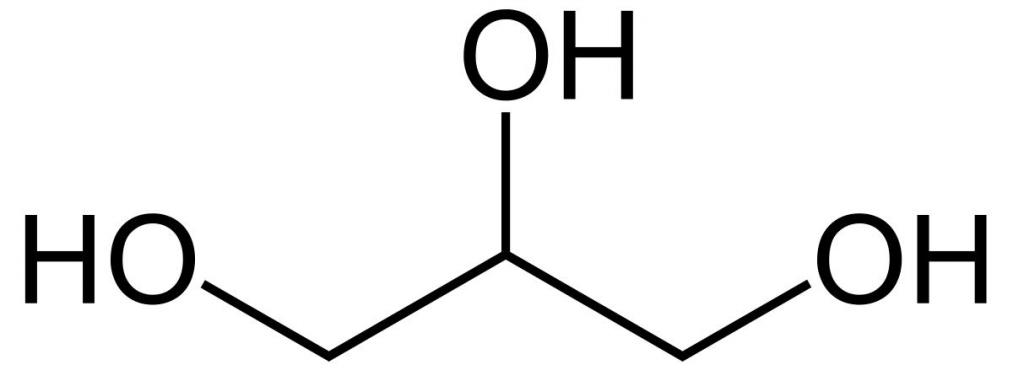
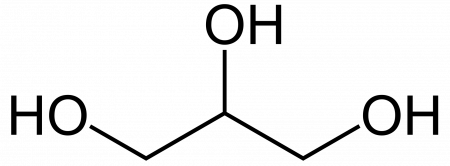
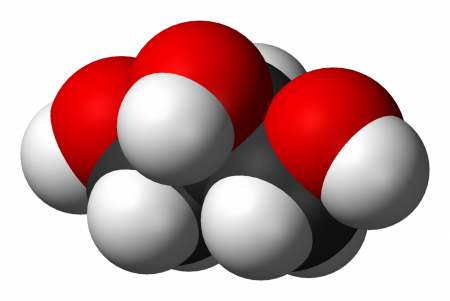
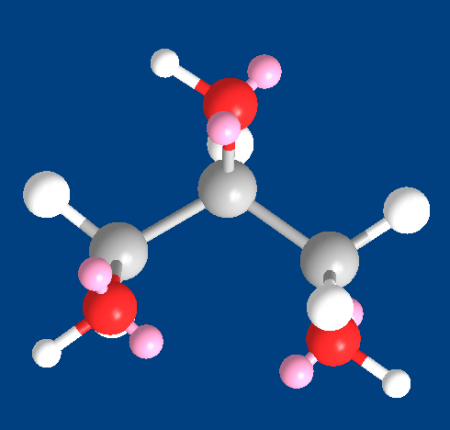
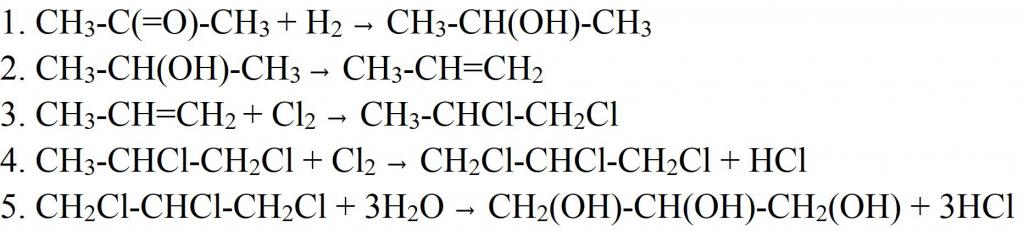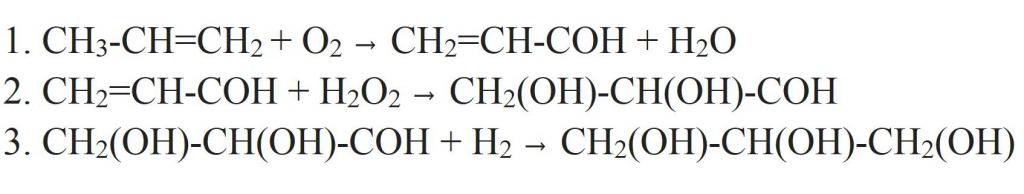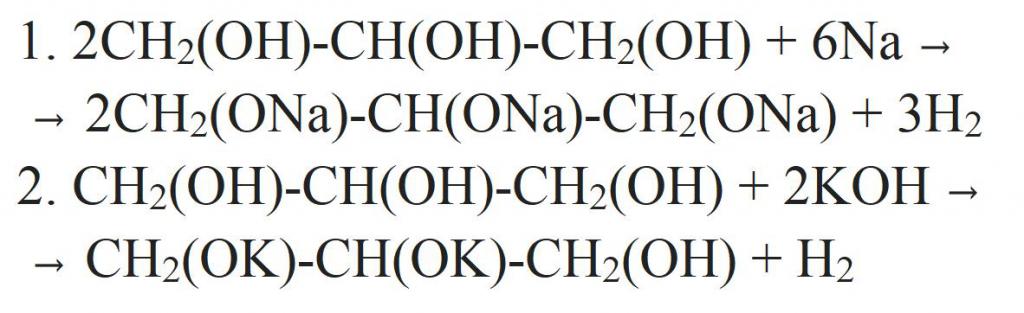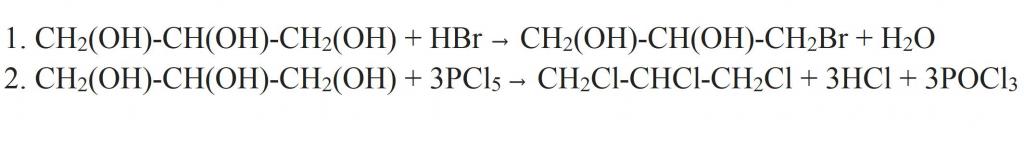Это простейший трехатомный спирт. Химическая формула глицерина — C3H5(OH)3. Представляет собой прозрачную вязкую жидкость. Не имеет запаха, сладкий на вкус. Он не ядовит, поэтому находит широкое применение в быту, пищевой промышленности, косметике и медицине. Структурная формула глицерина представлена на рисунке. Но как добывают его?
- Способы получения глицерина
- Физические свойства
- Химические свойства
- Окисление
- Применение в промышленности
- Применение в пищевой отрасли
- Применение в медицине
- Применение в косметологии
- Влияние на организм человека
- Глицерин
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Производные глицерина и их место в обмене веществ живых организмов
- Глицериды
- Применение
- Acetyl
- 📽️ Видео
Видео:8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

Способы получения глицерина
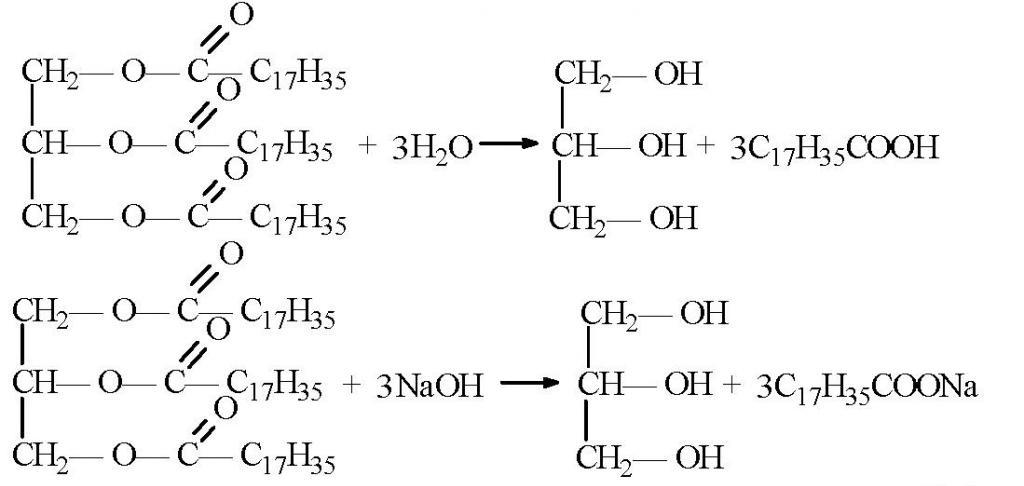
Почти весь глицерин в промышленности получают из жиров. Они с химической точки зрения как раз и представляют собой сложные эфиры глицерина. При омылении этих жиров (получении мыла) глицерин образуется как побочный продукт. Затем он очень просто выделяется из реакционной смеси.
Синтезировать глицерин можно и другими способами. Например, из ацетона. В этом случае его восстанавливают водородом, чтобы получить изопропиловый спирт. На следующей стадии дегидратацией отщепляют молекулу воды, получая пропилен, который затем хлорируют. Полученный дихлорпропан хлорируют еще раз, для получения трихлорпропана. Последняя стадия получения глицерина — гидратация при нагревании. На этой стадии все три молекулы хлора заменяются на гидроксильные группы. Похожим способом сейчас в промышленности получают синтетическое вещество. Только в качестве сырья используют пропилен, который выделяется из побочных газов при перегонке нефти.
Но из пропилена получать глицерин можно и другим способом. Для этого пропилен окисляют в акролеин. Окисление ведется кислородом воздуха в присутствии катализатора (меди) и повышенной температуре. Далее к нему присоединяют перекись водорода, получая двухатомный спирт-альдегид. В качестве катализатора такой реакции используется оксид осмия (VIII). Альдегидную группу в полученном соединении гидрируют, превращая ее в третью гидроксильную. Так и получается глицерин.
Другой вариант синтеза в свое время предложил Е. Е. Вагнер. Окисляя аллиловый спирт перманганатом калия в щелочной среде, можно в одну стадию получить глицерин.
Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать

Физические свойства
Глицерин — бесцветная жидкость без запаха со сладковатым вкусом. Обладает гигроскопичностью, то есть стремится поглощать воду. При температуре 20 °C плавится, а при температуре 290 °C кипит с частичным разложением. Смешивается с водой и спиртами в любых соотношениях. Это обусловлено химической формулой. Гидроксильные группы позволяют глицерину образовывать множество водородных связей с молекулами воды. Это и обеспечивает растворение.
Растворим глицерин также в ацетоне и некоторых других органических веществах. Нерастворим в бензоле и эфирах. Он и сам может является таковым для многих органических и неорганических соединений. Плотность его в жидком состоянии составляет 1,26 г/см 3 . Также стоит отметить, что глицерин — очень вязкая жидкость. Свойство это в 1474 раза больше, чем у воды.
Видео:Вулкан из марганцовки и глицерина #shortsСкачать

Химические свойства
Исходя из структурной формулы, глицерин содержит в себе три гидроксильные группы. Поэтому для него будут характерны и химические реакции одноатомных спиртов. Причем кислотные свойства глицерина выражены гораздо сильнее, чем у любого другого одноатомного спирта. Так, он может взаимодействовать с металлами, их оксидами или щелочами. Уравнения химических реакций глицерина представлены ниже.
Также он может вступать в реакции дегидратации, образуя множество разных продуктов. Таким образом получают акролеин.
Отдельно стоит сказать про замещение гидроксильной группы на галоген. Это может происходить при взаимодействии глицерина с галогеноводородами. Как видно из структурной формулы глицерина, в результате реакции могут образовываться моно-, ди- и трипроизводные. Более полного замещения можно добиться, если взаимодействие проводить с галогенидами фосфора.
Но глицерин имеет и специфичные свойства, присущие только многоатомным спиртам. Например, он взаимодействует с гидроксидом меди (II), образуя комплексное соединение синего цвета — глицерат меди. Это реакция является качественной для всех многоатомных спиртов.
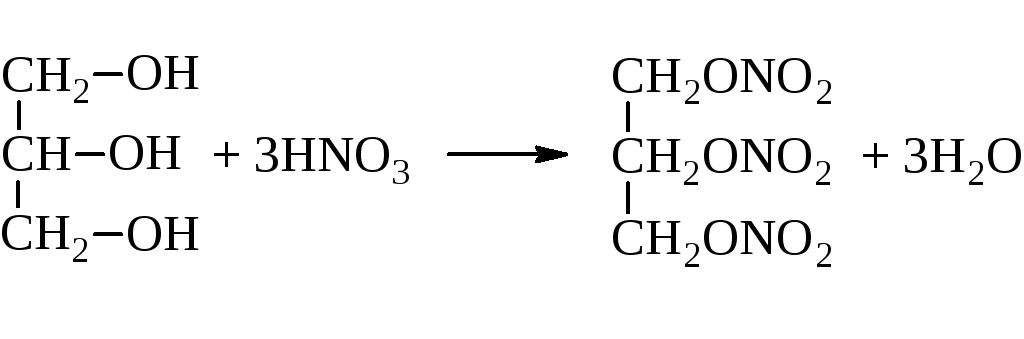
Характеры для него и реакции этерификации. Это реакция взаимодействия с кислотами, в результате которой получается сложный эфир. Причем этерифицируется глицерин как органическими кислотами, так и минеральными. Например, азотной. Данную реакцию также называют нитрование. В результате нее получается очень полезный, но крайне взрывоопасный продукт — нитроглицерин. Опять же из структурной формулы глицерина видно, что этирифицироваться могут не все гидроксильные группы. Здесь все зависит от условий проведения реакции.
При взаимодействии с водородом при высоком давлении и в присутствии катализторов одна из гидроксильных групп восстанавливается. В результате реакции получается двухатомный спирт — пропиленгликоль.
Глицерин может вступать и в реакции поликонденсации, образуя смесь полиглицеринов. Для этого его очень долго нагревают почти до 300 °C в слабощелочной среде. Химическую формулу глицерина рассмотрели.
Видео:Взаим-вие многоатомных спиртов с гидроксидом медиСкачать

Окисление
Очень много у глицерина вариантов окисления. Конечный продукт зависит от природы окислителя, катализаторов и других условий реакции. Так, глицерин можно окислить сильными окислителями, например, дихроматом калия в кислой среде. В результате этой реакции весь глицерин разложится на углекислый газ и воду.
Окисление может происходить и более мягко. Например, при взаимодействии с перекисью водорода получается альдегид или кетон. В качестве катализатора используются соли железа (II).
Окисление можно вести и до получения глицериновой кислоты. В этом случае взаимодействие проводят с концентрированной азотной кислотой. Одна из гидроксильных групп просто окисляется до карбоксильной группы. Из глицерина получают и более экзотические кислоты. При взаимодействии с раствором перманганата калия образуются тартроновая и мезоксалевая кислоты. А при окислении кислородом воздуха с нагреванием в присутствии гидроксида бария получается смесь щавелевой и муравьиной кислоты. Йодной кислотой глицерин можно окислить до муравьиной и формальдегида.
Видео:10 класс - Химия - Многоатомные спирты. Глицерин. Качественная реакция. ПрименениеСкачать

Применение в промышленности
Благодаря своему составу и свойствам, находит глицерин применение в промышленности.
- В текстильной промышленности его используют для придания тканям мягкости и эластичности, а также для синтеза красителей и синтетических волокон.
- Используют его и в производстве некоторых видов бумаги.
- В кожевенной промышленности его растворы применяются для дубления и жировки кожи.
- В сельском хозяйстве с помощью глицерина обрабатывают семена для того, чтобы обеспечить им более стабильное прорастание.
- В лакокрасочной промышленности глицерин применяется для синтеза полировочных составов и лаков.
- При производстве упаковочных материалов, например, целлофана, он используется как пластификатор.
- Полимеры на основе глицерина применяются для производства упаковки. Бумага, пропитанная глицерином, приобретает огнестойкие качества.
Видео:8.2. Многоатомные спирты (этиленгликоль, глицерин): Способы получения. ЕГЭ по химииСкачать

Применение в пищевой отрасли
Глицерин — это пищевая добавка Е422. Он используется в качестве стабилизатора для сохранения и увеличения вязкости продуктов. Его применяют в производстве хлебобулочных и кондитерских изделий (особенно шоколада) как загуститель и влагоудерживающий агент. Он помогает придавать объем готовым продуктам. Благодаря этой добавке хлеб может дольше оставаться свежим.
Экстракты на основе глицерина зачастую добавляют в напитки. Они позволяют сделать их вкус менее резким. Также его применяют в производстве алкоголя. Добавляют и в табак, чтобы регулировать влажность, устранять раздражающий привкус.
Видео:ХИМИЧЕСКИЙ ОПЫТ - Глицерин и МарганцовкаСкачать

Применение в медицине
Глицерин входит в состав некоторых препаратов, которые используют при лечении кожных болезней. Он имеет антисептические свойства, препятствует заражению ран. Он также способствует понижению внутричерепного и внутриглазного давления, поэтому его применяют при лечении отека мозга.
Из-за того, что глицерин — хороший растворитель, его активно используют в фармакологической промышленности. С помощью этого вещества можно достигнуть очень высокой концентрации действующего компонента. Также он может придавать нужную консистенцию лекарствам. Его часто добавляют в мази и кремы, ведь тот препятствует выпариванию влаги и высыханию.
Видео:Глицерин и марганцовкаСкачать

Применение в косметологии
Глицерин входит в состав многих косметических средств: мыл, шампуней, кремов, увлажняющих масок. При попадании на кожу в небольших количествах он удерживает влагу в верхних слоях кожи. Однако некоторые утверждают, что частое применение средств с глицериновой основой лишает кожу естественной влаги и лишь усугубляет сухость. Также глицерин часто используют как добавку в мыло. Так увеличивается его моющая способность.
Видео:Изучение физических свойств глицеринаСкачать

Влияние на организм человека
Глицерин хорошо усваивается организмом, так как легко преобразуется в жиры пищеварительной системой. По этой причине он не считается токсичным. Суточное потребление этого вещества никак не ограничено. Но не стоит забывать, что глицерин гигроскопичен, поэтому в организме он приводит к большому выделению волы, то есть имеется риск наступления обезвоживания. По этой причине применение его в пищевых продуктах строго регламентируется. При попадании на кожу он также оказывает осушающий эффект. До сих пор ведутся споры о необходимости применении вещества в косметических средствах.
Итак, в статье рассмотрели состав и свойства глицерина, его применение.
Видео:Химия ЕГЭ - Для чего применяют глицерин?Скачать

Глицерин
| Глицерин | |||
|---|---|---|---|
| |||
 | |||
| Традиционные названия | глицерин | ||
| Хим. формула | C3H8O3 | ||
| Рац. формула | HOCH2-CH(OH)-CH2OH | ||
| Молярная масса | 92,09 г/моль | ||
| Плотность | 1,261 г/см³ | ||
| Температура | |||
| • плавления | 17,9 °C | ||
| • кипения | 290 °C | ||
| • разложения | 554 ± 1 °F | ||
| • вспышки | 320 ± 1 °F и 160 °C | ||
| Давление пара | 0,003 ± 0,001 мм рт.ст. | ||
| Показатель преломления | 1,4740 | ||
| ГОСТ | ГОСТ 6824-96 ГОСТ 6823-2017 ГОСТ 6259-75 | ||
| Рег. номер CAS | 56-81-5 | ||
| PubChem | 753 | ||
| Рег. номер EINECS | 200-289-5 | ||
| SMILES | |||
| Кодекс Алиментариус | E422 | ||
| RTECS | MA8050000 | ||
| ChEBI | 17754 | ||
| ChemSpider | 733 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Глицерин (от греч. γλυκερός — сладкий) — органическое соединение, простейший представитель трёхатомных спиртов с формулой C3H5(OH)3 . Представляет собой вязкую прозрачную жидкость со сладким вкусом.
Синонимы: глицерóл, пропантриол-1,2,3.
Видео:Опыты по химии. Растворение глицерина в водеСкачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Производные глицерина и их место в обмене веществ живых организмов
- 4.1 Глицериды
- 5 Применение
Видео:МАРГАНЦОВКА И ГЛИЦЕРИН - химические опытыСкачать

Физические свойства
Бесцветная вязкая жидкость без запаха. Сладкий на вкус, отчего и получил своё название (греч. γλυκερός — сладкий). Имеет молярную массу 92,09 г/моль, относительную плотность d4 20 = 1,260, коэффициент преломления nD 20 = 1,4740. Температура плавления составляет 17,9 °C, кипит при 290 °C, частично при этом разлагаясь. Гигроскопичен, поглощает воду из атмосферы в количестве до 40 % от собственной массы. С водой, метанолом, этанолом, ацетоном смешивается в любых пропорциях, но не растворим в эфире и хлороформе, хотя и способен растворяться в их смесях с этанолом.
При растворении глицерина в воде происходит выделение тепла и происходит контракция — уменьшение объёма раствора. Смеси глицерина с водой обладают температурой плавления значительно более низкой, чем каждое из веществ по отдельности, например, при массовом содержании глицерина в 66,7 % его смесь с водой будет замерзать при −46,5 °C.
Образует азеотропы с нафталином, его производными и рядом других веществ.
Видео:Удивительные свойства глицеринаСкачать

Химические свойства
Химические свойства глицерина типичны для многоатомных спиртов.
Взаимодействие глицерина с галогеноводородами или галогенидами фосфора ведёт к образованию моно- и дигалогенгидринов.
Глицерин этерифицируется карбоновыми и минеральными кислородосодержащими кислотами с образованием соответствующих сложных эфиров. Так, с азотной кислотой глицерин образует тринитрат — нитроглицерин (получен в 1847 г. Асканио Собреро), использующийся в настоящее время в производстве бездымных порохов.
При дегидратации он образует токсичный акролеин:
и окисляется до глицеринового альдегида CH2OHCHOHCHO , дигидроксиацетона CH2OHCOCH2OH или глицериновой кислоты CH2OHCHOHCOOH .
Сложные эфиры глицерина и высших карбоновых кислот — жиры являются важными метаболитами, важное биологическое значение играют также фосфолипиды — смешанные глицериды фосфорной и карбоновых кислот.
Видео:Химия, 11-й класс, Этиленгликоль, глицеринСкачать

Получение
Глицерин впервые был получен в 1779 году Карлом Вильгельмом Шееле при омылении жиров в присутствии оксидов свинца. Основную массу глицерина получают как побочный продукт при омылении жиров.
Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта. Хлорированием пропилена при 450—500 °С получают аллилхлорид, при присоединении к последнему хлорноватистой кислоты образуются хлоргидрины, например, CH2ClCHOHCH2Cl , которые при омылении щёлочью превращаются в глицерин.
На превращениях аллилхлорида в глицерин через дихлоргидрин или аллиловый спирт основаны другие методы. Известен также метод получения глицерина окислением пропилена в акролеин; при пропускании смеси паров акролеина и изопропилового спирта через смешанный ZnO — MgO катализатор образуется аллиловый спирт. Он при 190—270 °C в водном растворе перекиси водорода превращается в глицерин.
Глицерин можно получить также из продуктов гидролиза крахмала, древесной муки, гидрированием образовавшихся моносахаридов или гликолевым брожением сахаров. Также глицерин получается в качестве побочного продукта при производстве биотоплива.
Видео:Горение глицерина.Скачать

Производные глицерина и их место в обмене веществ живых организмов
Глицериды
Триглицериды являются производными глицерина и образуются при присоединении к нему высших жирных кислот. Триглицериды являются важными компонентами в процессе обмена веществ в живых организмах.
Жиры и масла гидрофобны и нерастворимы в воде, так как гидроксильные группы глицерина заменены малополярными остатками жирных кислот.
Видео:Реакция глицерина с перманганатом калияСкачать

Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, электронные сигареты, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке).
Глицерин относится к группе стабилизаторов, обладающих свойствами сохранять и увеличивать степень вязкости и консистенции пищевых продуктов. Зарегистрирован как пищевая добавка E422, и используется в качестве эмульгатора, при помощи которого смешиваются различные несмешиваемые смеси.
Поскольку глицерин хорошо поддается желированию и горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей и основы для жидкости, используемой в дым-машинах.
Также глицерин используется при изготовлении динамита.
В последние годы глицерин используется, наряду с пропиленгликолем, в качестве основного компонента для приготовления жидкости и картриджей для электронных сигарет.
Используется в криобиологии и крионике как основной компонент популярных проникающих криопротекторов для криоконсервирования анатомических препаратов, биологических тканей и организмов.
Видео:№ 70. Органическая химия. Тема 15. Спирты, алканолы. Часть 13. Химические свойства глицеринаСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📽️ ВидеоНевероятные свойства глицерина #красота #здоровье #народноелечение #отморщин #elenamatveeva #видеоСкачать  Химический эксперимент марганцовка и глицеринСкачать  Определяем СВОЙСТВА ГЛИЦЕРИНА. ОБРАЗОВАНИЕ АНТИФРИЗОВ. Опыт#4Скачать  |