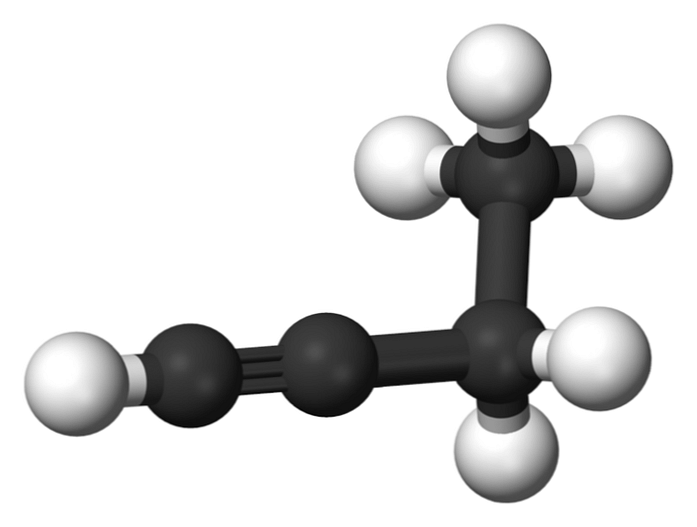
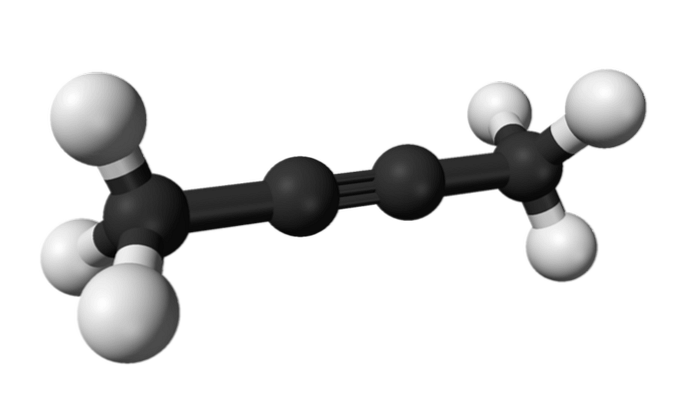
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Бутино структура, свойства и использованиебутин представляет собой химическое соединение, принадлежащее к группе алкинов, характеризующееся, главным образом, наличием в его структуре по меньшей мере тройной связи между двумя атомами углерода. Когда дело доходит до установления правил деноминации алкинов, IUPAC (аббревиатура на английском языке для Международного союза теоретической и прикладной химии) установила, что они используются так же, как и для алкенов.. Принципиальное различие между номенклатурой веществ обоих типов заключается в том, что суффикс «один» заменяется на «или», когда речь идет о соединениях, имеющих в своей структуре тройные связи.. С другой стороны, бутино состоит только из углерода и водорода и имеет две формы: 1-бутин, который находится в газовой фазе при стандартных условиях давления и температуры (1 атм, 25 ° C); и 2-бутино, который является жидкой фазой, получаемой химическим синтезом..
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Химическая структураВ молекуле, известной как бутино, представлено явление структурной изомеризации положения, которое заключается в наличии одинаковых функциональных групп в обоих соединениях, но каждое из них находится в другом месте цепи.. В этом случае обе формы бутино имеют одинаковую молекулярную формулу; однако в 1-бутине тройная связь находится в углероде номер один, а в 2-бутине — в номер два. Это превращает их в положение изомеров. Из-за расположения тройной связи в одном из терминалов 1-бутиновой структуры он рассматривается как терминальный алкин, а промежуточное положение тройной связи в 2-бутиновой структуре дает ему классификацию внутреннего алкина.. Таким образом, связь может быть только между первым и вторым углеродом (1-бутином) или между вторым и третьим углеродом (2-бутином). Это связано с применяемой номенклатурой, где наименьшая возможная нумерация всегда будет дана позиции тройной связи. 1-бутинСоединение, называемое 1-бутином, также известно как этилацетат, из-за его структуры и способа, которым его четыре атома углерода расположены и связаны. Тем не менее, когда речь идет о бутин ссылка делается только на этот химический вид. В этой молекуле тройная связь обнаружена в концевом углероде, что обеспечивает доступность атомов водорода, которые придают ей большую реакционную способность.. Эта жесткая и прочная связь, чем простая или двойная связь между атомами углерода, обеспечивает стабильную конфигурацию 1-бутина линейной геометрии. С другой стороны, это газообразное вещество довольно легко воспламеняется, поэтому при наличии тепла оно может легко вызвать пожары или взрывы и обладает высокой реакционной способностью в присутствии воздуха или воды.. 2-бутинПоскольку внутренние алкины проявляют большую стабильность, чем концевые алкины, они позволяют превращать 1-бутин в 2-бутин. Эта изомеризация может происходить при нагревании 1-бутина в присутствии основания (такого как NaOH, KOH, NaOCH3 . ) или при перегруппировке 1-бутина в растворе гидроксида калия (KOH) в этаноле (C2H6O). Таким же образом, химическое вещество, известное как 2-бутин, также называют диметилацетиленом (или кротониленом), представляющим собой жидкое и летучее вещество, которое происходит искусственно. В 2-бутине тройная связь находится в середине молекулы, что придает ей большую стабильность, чем ее изомер.. Кроме того, это бесцветное соединение имеет меньшую плотность, чем вода, хотя оно считается нерастворимым в нем и обладает высокой воспламеняемостью.. Видео:8 класс. Составление уравнений химических реакций.Скачать  свойства-Структурная формула бутино (независимо от того, какой изомер упоминается) является C4H6, которая имеет линейную структуру. -Одной из химических реакций, испытываемых молекулой бутина, является изомеризация, при которой внутри молекулы происходит перегруппировка и миграция тройной связи.. -1-бутин находится в газовой фазе, имеет очень высокую воспламеняемость и более высокую плотность, чем воздух. -Это вещество также довольно реактивно, и в присутствии тепла может вызвать сильные взрывы. -Кроме того, когда этот бесцветный газ испытывает неполную реакцию горения, это может вызвать угарный газ (СО) -Когда оба изомера подвергаются воздействию высоких температур, они могут испытывать реакции полимеризации взрывного типа.. -2-бутин находится в жидкой фазе, хотя он также считается довольно легковоспламеняющимся при стандартных условиях давления и температуры. -Эти вещества могут испытывать бурные реакции, когда они находятся в присутствии сильных окисляющих веществ.. -Точно так же экзотермические реакции с последующим выделением газообразного водорода происходят в присутствии восстанавливающих частиц.. -При контакте с определенными катализаторами (такими как некоторые кислотные вещества) или стартовыми веществами могут происходить реакции полимеризации экзотермического типа.. Видео:248. Химические свойства алкинов на примере бутина.Скачать  приложенийПоскольку они имеют некоторые разные свойства, оба изомера могут иметь различное использование и применение, как показано ниже: Во-первых, очень часто одним из применений 1-бутино является его использование в качестве промежуточной стадии в процессе производства других веществ органической природы синтетического происхождения.. С другой стороны, этот химический вид используется в промышленности по производству каучука и производных соединений; как например, когда вы хотите получить бензол. Точно так же он используется в процессе производства самых разнообразных пластмассовых изделий, а также в производстве многих полиэтиленовых веществ, считающихся высокоплотными.. Кроме того, 1-бутин часто используется в качестве компонента для процессов резки и сварки некоторых металлических сплавов, включая сталь (железный сплав и углерод).. В другом смысле 2-бутиновый изомер используется в комбинации с другим алкином, называемым пропином, в синтезе некоторых веществ, известных как алкилированные гидрохиноны, когда выполняется процесс полного синтеза α-токоферола (витамина Е).. Видео:Составление уравнений реакций. 1 часть. 9 класс.Скачать  Химические свойства алкиновАлкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С. Остановимся на свойствах, способах получения и особенностях строения алкинов. Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Химические свойства алкиновАлкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле. Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение). Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать  1. Реакции присоединенияТройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С ≡ С и связи С–Н:
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам. Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей. 1.1. ГидрированиеГидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
1.2. Галогенирование алкиновПрисоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная) Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму. 1.3. Гидрогалогенирование алкиновАлкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С. При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
1.4. Гидратация алкиновГидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II). Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
Гидратация алкинов протекает по ионному (электрофильному) механизму. Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
1.5. Димеризация, тримеризация и полимеризацияПрисоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен: Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского): Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера). nM → Mn (M – это молекула мономера)
… –CH=CH–CH=CH–CH=CH–… Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать  2. Окисление алкиновРеакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода). 2.1. Горение алкиновАлкины, как и прочие углеводороды, горят с образованием углекислого газа и воды. Уравнение сгорания алкинов в общем виде:
2.2. Окисление алкинов сильными окислителямиАлкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом. При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно. Таблица соответствия окисляемого фрагмента молекулы и продукта:
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота: При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ: При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами. Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота: В нейтральной среде образуется соль щавелевой кислоты – оксалат калия: Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь. Видео:7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать  3. Кислотные свойства алкиновСвязь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н + , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I). При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I). 🎦 ВидеоОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать  Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать  6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать  Характерные химические свойства | ХИМИЯ ЕГЭ | Лия МенделееваСкачать  Классификация химических реакций в неорганической химии + 1 балл | ХИМИЯ ЕГЭ | Лия МенделееваСкачать  Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  |