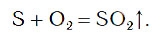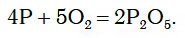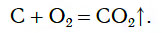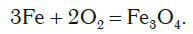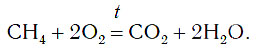В уроке 18 «Физические и химические свойства кислорода» из курса «Химия для чайников» выясним, какие физические и химические свойства имеет кислород и узнаем о реакциях горения.
Как у любого химического вещества, у кислорода есть свой набор физических и химических свойств, по которым его можно отличить от других веществ.
- Физические свойства
- Химические свойства
- Реакции горения
- Горение веществ на воздухе и в кислороде
- Химические свойства кислорода
- Взаимодействие кислорода с простыми веществами
- Взаимодействие кислорода со сложными веществами
- Окисление – горение и медленное окисление
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 🎥 Видео
Видео:Реакции горенияСкачать

Физические свойства
По своим физическим свойствам простое вещество кислород относится к неметаллам. При нормальных условиях он находится в газообразном агрегатном состоянии. Кислород не имеет цвета, запаха и вкуса. Масса кислорода объемом 1 дм 3 при н. у. равна примерно 1,43 г.
При температуре ниже −183 °С кислород превращается в голубую жидкость, а при −219 °С эта жидкость переходит в твердое вещество. Это означает, что температура кипения кислорода равна: t кип.= −183 °С, а температура плавления составляет: t пл.= −219 °С. Кислород плохо растворяется в воде.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).
Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).
При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).
Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).
При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Видео:Уравнивание реакций горения углеводородовСкачать

Реакции горения
Общим для рассмотренных нами реакций является то, что при их протекании выделяется много света и теплоты. Очень многие вещества именно так взаимодействуют между собой.
Рассмотренные выше реакции простых веществ серы, фосфора, углерода и железа с кислородом являются реакциями горения.
Реакциями горения называются химические реакции, протекающие с выделением большого количества теплоты и света.
Кроме простых веществ, в кислороде горят и многие сложные вещества, например метан CH4. При горении метана образуются углекислый газ и вода:
В результате этой реакции выделяется очень много теплоты. Вот почему ко многим домам подведен природный газ, основным компонентом которого является метан. Теплота, выделяющаяся при горении метана, используется для приготовления пищи и других целей.
На заметку: Некоторые химические реакции протекают очень быстро. Такие реакции называют взрывными или просто взрывами. Например, взаимодействие кислорода с водородом может протекать в форме взрыва.
Горение может протекать не только в кислороде, но и в других газах. Об этих процессах вы узнаете при дальнейшем изучении химии.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
На заметку : При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства кислорода
Видео:Горение. 7 класс.Скачать

Взаимодействие кислорода с простыми веществами
Кислороду присуща высокая химическая активность. Многие вещества реагируют с кислородом при комнатной температуре. Так, например, свежий срез яблока довольно быстро приобретает бурую окраску, это происходит вследствие химических реакций между органическими веществами, содержащимися в яблоке, и кислородом, содержащимся в воздухе. С простыми веществами кислород, как правило, реагирует при нагревании. В металлическую ложечку для сжигания веществ поместим уголек, нагреем его в пламени спиртовки докрасна и опустим в сосуд с кислородом. Наблюдаем яркое горение уголька в кислороде. Уголь – простое вещество, образованное элементом углеродом. В реакции кислорода с углеродом образуется углекислый газ:
Стоит отметить, что многие химические вещества имеют тривиальные названия. Углекислый газ – это тривиальное название вещества. Тривиальные названия веществ используются в повседневной жизни, многие из них имеют давнее происхождение. Например, пищевая сода, бертолетова соль. Однако у каждого химического вещества есть и систематическое химическое название, составление которого регламентируется международными правилами – систематической химической номенклатурой.
Так, углекислый газ имеет систематическое название оксид углерода (IV).
Углекислый газ является сложным веществом, бинарным соединением, в состав которого входит кислород. Поместим в ложечку для сжигания веществ серу и нагреем. Сера плавится, затем загорается. На воздухе сера горит бледным, почти незаметным, синим пламенем. Внесем серу в сосуд с кислородом – сера горит ярким синим пламенем. В реакции серы с кислородом образуется сернистый газ:
Сернистый газ, как и углекислый газ, относится к группе оксидов. Это оксид серы (IV) – бесцветный газ с резким едким запахом. Теперь внесем в сосуд с кислородом подожженный красный фосфор. Фосфор горит ярким, ослепительным пламенем. Сосуд заполняется белым дымом. Белый дым – это продукт реакции, мелкие твердые частицы оксида фосфора (V):
В кислороде способны гореть не только неметаллы. Металлы также энергично взаимодействуют с кислородом. Например, магний горит в кислороде и на воздухе ослепительным белым пламенем. Продукт реакции – оксид магния:
Попробуем сжечь в кислороде железо. Раскалим в пламени спиртовки стальную проволоку и быстро опустим в сосуд с кислородом. Железо горит в кислороде с образованием множества искр. Вещество, полученное в результате реакции, называют железной окалиной:
Снопы искр, образующихся при горении бенгальского огня, объясняются сгоранием порошка железа, входящего в состав этих пиротехнических изделий. После рассмотренных реакций можно сделать важные выводы: кислород реагирует как с металлами, так и неметаллами; часто эти реакции сопровождаются горением веществ. Продуктами реакций кислорода с простыми веществами являются оксиды. Обратите внимание, что при взаимодействии кислорода с простыми веществами – металлами и неметаллами образуются сложные вещества – оксиды. Такой тип химических реакций называют реакциями соединения.
Реакция соединения – реакция, в результате которой из двух или нескольких менее сложных по строению веществ, образуются более сложные по строению вещества
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Взаимодействие кислорода со сложными веществами
Кислород способен вступать в реакции и со сложными веществами. В качестве примера рассмотрим реакцию, которая протекает при горении бытового газа, который состоит из метана CH4. По горению метана в конфорке печи можно сделать выводы, что реакция протекает с выделением энергии в виде тепла и света. Каковы продукты этой реакции?
СН4 + 2О2 = СО2 + 2Н2О.
Продукты реакции оксиды: углекислый газ (оксид углерода (IV)) и вода (оксид водорода). В реакции кислорода с минералом пиритом FeS2 (важный минерал железа и серы) получают оксиды серы и железа. Реакция происходит при нагревании:
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Окисление – горение и медленное окисление
Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем.
С химической точки зрения горение – это химическая реакция, сопровождающаяся выделением потока раскаленных газов и энергии в виде тепла и света. Можно сказать, что кислород, вступая в реакцию с простыми веществами, окисляет их:
Простое вещество + Кислород окисление → Продукты окисления (оксиды) + Энергия.
Окисление веществ может и не сопровождаться горением, то есть выделением пламени. Такие процессы называют медленным окислением. Медленное окисление – процесс постепенного взаимодействия веществ с кислородом, с медленным выделением теплоты, не сопровождающийся горением. Так, например, углекислый газ образуется не только при горении углерода в кислороде, но и при медленном окислении органических веществ кислородом воздуха (гниении, разложении).
Итог статьи:
- В реакции простых веществ с кислородом, образуются оксиды
- Реакции простых веществ с кислородом протекают, как правило, при нагревании
- Реакции простых веществ с кислородом – это реакции соединения
- Тривиальные названия химических веществ не отражают химического состава веществ, используются в повседневной практике, многие из них сложились исторически
- Систематические названия химических веществ отражают химический состав вещества, соответствуют международной систематической номенклатуре
- Реакция соединения – реакция, в результате которой, из двух или нескольких менее сложных по строению веществ, образуются более сложные по строению вещества
- Кислород способен реагировать со сложными веществами
- Горение – химическая реакция, сопровождающаяся выделением энергии в виде тепла и света
- Медленное окисление – процесс постепенного взаимодействия веществ с кислородом, с медленным выделением теплоты, не сопровождающийся горением
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Please wait.
Видео:8 класс. Составление уравнений химических реакций.Скачать

We are checking your browser. gomolog.ru
Видео:Опыты по химии. Горение серы в кислородеСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1a30f459bdfa80 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
🎥 Видео
Решаем жгучий ПРОБНИК ЕГЭ ПО ХИМИИ 2024Скачать

горение железа в кислородеСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Горение различных веществ в кислородеСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Кислород. 8 класс.Скачать

Химия 8 класс (Урок№12 - Озон. Аллотропия кислорода. Состав воздуха. Горение.)Скачать