Al2(SO4)3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Третья стадия (ступень) гидролиза
- Среда и pH раствора сульфата алюминия
- Соли алюминия: получение и свойства
- Соли алюминия
- Нитрат и сульфат алюминия
- Комплексные соли алюминия
- Гидролиз солей алюминия
- Алюминаты
- Правильное составление ионно-молекулярных и молекулярных уравнений гидролиза солей
- Решение задач по химии на гидролиз солей
- 💡 Видео
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Al 3+ + 3SO4 2- + 2HOH ⇄ 2AlOH 2+ + 2SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Al 3+ + HOH ⇄ AlOH 2+ + H +
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2AlOH 2+ + 2SO4 2- + 2HOH ⇄ 2Al(OH)2 + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
AlOH 2+ + HOH ⇄ Al(OH)2 + + H +
Видео:Гидролиз солей. 9 класс.Скачать

Третья стадия (ступень) гидролиза
Полное ионное уравнение
2Al(OH)2 + + SO4 2- + 2HOH ⇄ 2Al(OH)3 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Al(OH)2 + + HOH ⇄ Al(OH)3 + H +
Видео:Электролиз. 10 класс.Скачать

Среда и pH раствора сульфата алюминия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Соли алюминия: получение и свойства
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например , тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al 3+ + H2O = AlOH 2+ + H +
II ступень: AlOH 2+ + H2O = Al(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия :
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Правильное составление ионно-молекулярных и молекулярных уравнений гидролиза солей
Видео:11 класс. Гидролиз солей.Скачать

Решение задач по химии на гидролиз солей
Задание 211.
Какие из солей RbCl, Сr2(SО4)3, Ni(NО3)2, Na2SO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН ( > 7
а) PbСl2 — соль слабого многокислотного основания Pb(OH)2 и сильной одноосновной кислоты. В этом случае катионы Pb 2+ связывают ионы ОН — воды, образуя катионы основной соли PbOH + . Образование Pb(OH)2 не происходит, потому что ионы PbOH + диссоциируют гораздо труднее, чем молекулы Pb(OH)2. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
PbCl2 ⇔ Pb 2+ + 2C l- ;
Pb 2+ + H2O ⇔ PbOH + + H +
или в молекулярной форме:
В растворе появляется избыток ионов водорода, которые придают раствору PbCl2 кислую среду, рН
в) Сr2(SO4)3 — соль слабого многокислотного основания Сr(OH) 3 и сильной многоосновной кислоты H2SO4. В этом случае катионы Cr 3+ связывают ионы ОН — воды, образуя катионы основной соли CrOH 2+ . Образование Cr(OH) 2+ и Cr(OH)3 не происходит, потому что ионы CrOH 2+ диссоциируют гораздо труднее, чем ионы Cr(OH) 2+ и молекулы Cr(OH)3. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
Молекулярная форма процесса:
В растворе появляется избыток ионов водорода, которые придают раствору Cr2(SO4)3 кислую среду, рН
в) Ni(NO3)2 — соль слабого многокислотного основания Ni(OH)2 и сильной одноосновной кислоты HNO3. В этом случае катионы Ni 2+ связывают ионы ОН — воды, образуя катионы основной соли NiOH+. Образование Ni(OH)2 не происходит, потому что ионы NiOH + диссоциируют гораздо труднее, чем молекулы Ni(OH)2. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток ионов водорода, которые придают раствору Ni(NO3)2 кислую среду, рН
г) Na2SO3 — соль сильного однокислотного основания NaOH и слабой многоосновной кислоты H2SO3. В этом случае анионы SO3 2- связывают ионы водорода Н + воды, образуя анионы кислой соли HSO3 — . Образование H2SO3 не происходит, так как ионы HSO3 — диссоциируют гораздо труднее, чем молекулы H2SO3. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток гидроксид-ионов, которые придают раствору Na2SO3 щелочную среду, рН > 7.
Задание 212.
К раствору Al2(SO4)3 добавили следующие вещества: а) Н2SО4; б) КОН; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
Решение:
Гидролиз соли Al2(SO4)3
а) Соль Al2(SO4)3 гидролизуется по катиону, а H2SO4 диссоциирует в водном растворе:
Если растворы этих веществ находятся в одном сосуде, то идёт угнетение гидролиза соли Al2(SO4)3, ибо образуется избыток ионов водорода Н + и равновесие гидролиза сдвигается влево.
б) KOH диссоциирует в водном растворе:
Если растворы этих веществ находятся в одном сосуде, то идёт гидролиза соли Al2(SO4)3 и диссоциации КОН, ибо ионы Н + и ОН — , связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н+ + ОН — = Н2О). При этом гидролитическое равновесие соли Al2(SO4)3 и диссоциация КОН сдвигаются вправо и гидролиз соли и диссоциация основания идут до конца с образованием осадка Al(OH)3. По сути, при смешивании Al2(SO4)3 и КОН протекает реакция обмена. Ионно-молекулярное уравнение процесса:
Молекулярное уравнение процесса:
в) Соль Al2(SO4)3 гидролизуется по катиону, а соль Na2SO3 – по аниону:
Если растворы этих солей находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН — , связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н + + ОН — ⇔ Н2О). При образовании дополнительного количества воды гидролитическое равновесие обеих солей сдвигается вправо, и гидролиз каждой соли идёт до конца с образованием осадка Al(OH)3 и слабого электролита H2SO3:
г) Соль Al 2 (SO 4 ) 3 и соль ZnSO4 гидролизуется по катиону:
Al 3+ + H2O ⇔ AlOH 2+ + H + ;
Zn 2+ + H2O ⇔ ZnOH + + H +
Если растворы этих солей находятся в одном сосуде, то идёт взаимное угнетение гидролиза каждой из них, ибо избыточное количество ионов Н + вызывает смещение гидролитического равновесие влево, в сторону уменьшения концентрации ионов водорода Н + .
Задание 213.
Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2СО3 или Na2SO3; FеСl3 или FeCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Решение:
Гидролиз солей
а) Na2CO3 и Na2SO3 – соли сильного основания и слабой кислоты гидролизуются по аниону:
При равных условиях гидролизу в большей степени будет подвергаться соль, у которой константа диссоциации кислоты, образующая соль, будет меньшей, т. е. гидролизу в большей степени подвергается соль, образованная относительно менее сильной кислотой. Так как КD(H2CO3) . 10 -7 ; КD(H2SO3) = 1,4 . 10 -2 ], следовательно, гидролизу в большей степени будет подвергаться Na2CO3.
б) FеСl3 или FeCl2 — соли слабого основания и сильной кислоты гидролизуются по катиону:
Fe 3+ + H2O ⇔ FeOH 2+ + H + ;
Fe 2+ + H2O ⇔ FeOH + + H +
При равных условиях гидролизу в большей степени будет подвергаться соль, у которой константа диссоциации основания, образующая соль, будет меньшей, т. е. гидролизу в большей степени подвергается соль, образованная относительно менее сильным основанием.
Так как КD[(Fe(OH)3] . 10 -11 ; КD[(Fe(OH)2]=1,3 . 10 -4 ], следовательно, гидролизу в большей степени будет подвергаться FeCl3.
Задание 214.
При смешивании растворов Al2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнение происходящего совместного гидролиза.
Решение:
Гидролиз соли Al2(SO4)3
Соль Al2(SO4)3 гидролизуется по катиону, а соль Na2SO3 – по аниону:
Если растворы этих солей находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН — , связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н + + ОН — ⇔ Н2О). При образовании дополнительного количества воды гидролитическое равновесие обеих солей сдвигается вправо, и гидролиз каждой соли идёт до конца с образованием осадка Al(OH)3, газа СО2 и слабого электролита H2О:
Задание 215.
Какие из солей NaBr, Na2S, K2CO3, CoCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 + и OH — . Ионы Na + , Br — , H + и OH — останутся в растворе. Таким образом, обратная гидролизу реакция нейтрализации протекает практически до конца. Так как в растворе соли присутствуют равные количества ионов H + и OH — , то раствор имеет нейтральную среду, рН = 0.
б) Na2S – соль сильного однокислотного основания NaOH и слабой многоосновной кислоты H2S. В этом случае анионы S 2- связывают ионы водорода Н + воды, образуя анионы кислой соли НS — . Образование H2S не происходит, так как ионы НS — диссоциируют гораздо труднее, чем молекулы H2S. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
Na2S ⇔ 2К + + S 2- ;
S 2- + H2O ⇔ НS — + ОH —
или в молекулярной форме:
В растворе появляется избыток гидроксид-ионов, которые придают раствору Na2S щелочную среду, рН > 7.
в) К2CO3 — соль сильного однокислотного основания КOH и слабой двухосновной кислоты Н2СО3. В этом случае анионы CO3 2- связывают ионы водорода Н + воды, образуя анионы кислой соли HCO3 — . Образование H2CO3 не происходит, так как ионы HCO3 — диссоциируют гораздо труднее, чем молекулы H2CO3. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток гидроксид-ионов, которые придают раствору К2CO3 щелочную среду, рН > 7.
г) СоСl2 — соль слабого многокислотного основания Со(OH)2 и сильной одноосновной кислоты. В этом случае катионы Со 2+ связывают ионы ОН — воды, образуя катионы основной соли СоOH + . Образование Со(OH)2 не происходит, потому что ионы СоOH + диссоциируют гораздо труднее, чем молекулы Со(OH)2. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
СоCl2 ⇔ Со 2+ + 2Cl — ;
Со 2+ + H2O ⇔ СоOH + + H +
или в молекулярной форме:
В растворе появляется избыток ионов водорода, которые придают раствору СоCl2 кислую среду, рН
💡 Видео
Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Необратимый гидролиз карбоната алюминия Al2(CO3)3 и карбоната железа (III) Fe2(CO3)3Скачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Взаимный гидролизСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

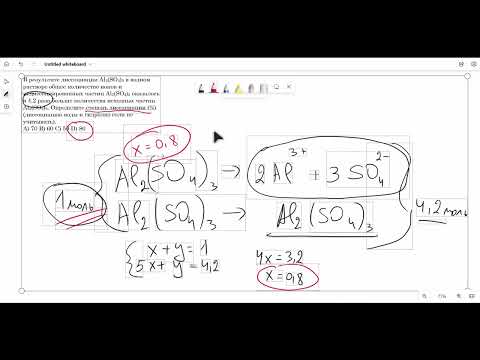
В результате диссоциации Al2(SO4)3 в водном растворе общее количество ионов и недиссоциированныхСкачать
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Отримання Сульфату алюмінію Al2(SO4)3Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать
