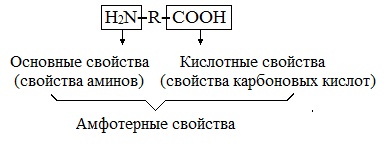
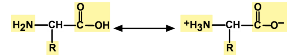
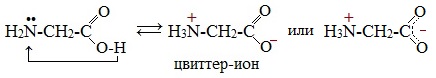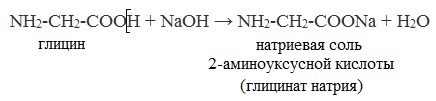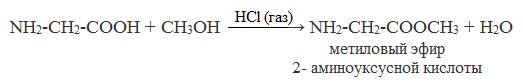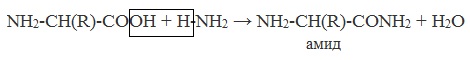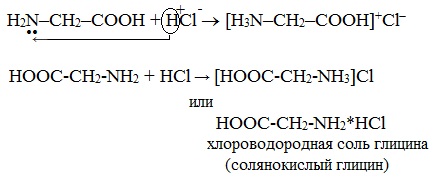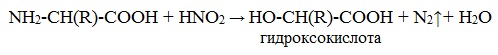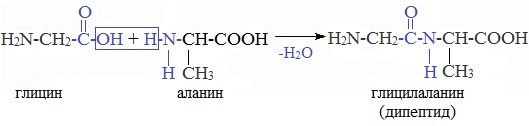Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
- Кислотно-основное равновесие в водных растворах
- 1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
- 2. Взаимодействие с основаниями и кислотами
- 3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
- 4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
- 5. Качественные реакции!
- Пояснить на конкретном примере.
- Для аминокислот характерна амфотерность
- 🌟 Видео
Кислотно-основное равновесие в водных растворах
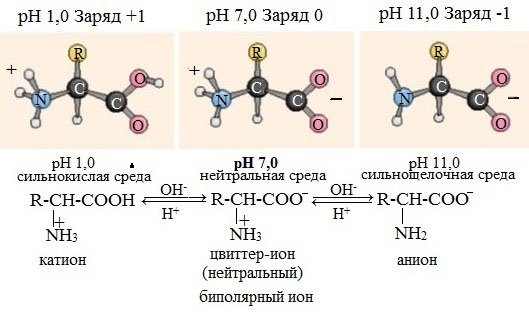
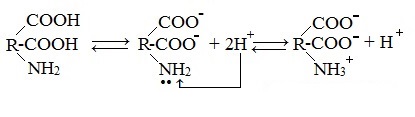
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
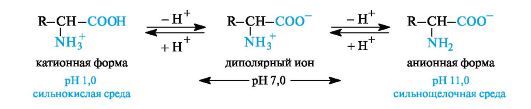
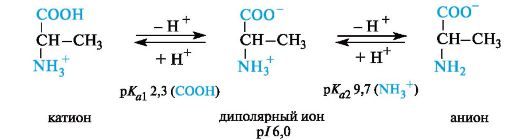
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
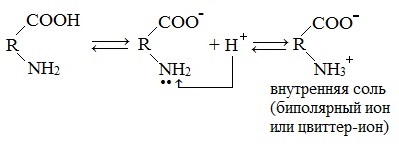
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
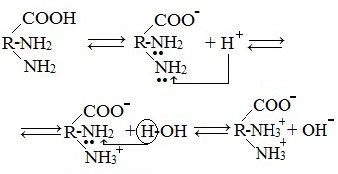
2. Взаимодействие с основаниями и кислотами
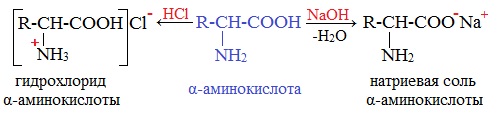
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
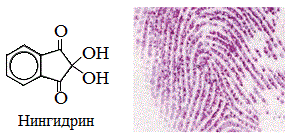
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
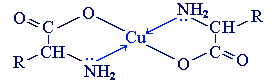
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Видео:Реакции на аминогруппуСкачать

Пояснить на конкретном примере.
Амфотерность аминокислот обусловлена кислотными (СООН) и основными (NH2) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.
В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы H3N+ — CHR-COO- (обычно используемая запись
строения аминокислоты в неионизированной форме служит лишь для удобства).
В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.
Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН 1-2) и анион- ные — в сильнощелочных (рН >11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200 ?С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т. п.
Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
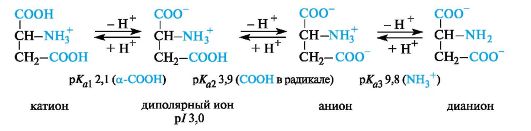
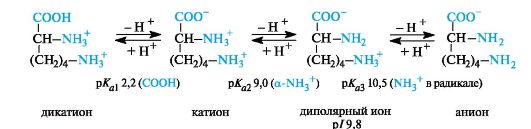
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой (p/).
Нейтральные α-аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -/-эффекта группы NH2. Например, у аланина изоэлектрическая точка находится при рН 6,0.
Кислые α-аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рКа, как это видно на примере аспарагиновой кислоты (р/ 3,0).
У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 12.1). В организме при физиологических значениях рН (например, рН крови 7,3-7,5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основные α-аминокислоты. В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7. В сильно- кислой среде эти соединения также представляют собой трехосновные кислоты, этапы ионизации которых показаны на примере лизина (р/ 9,8).
В организме основные аминокислоты находятся в виде катионов, т. е. у них протонированы обе аминогруппы.
В целом ни одна α-аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
Биологически важные реакции α-Аминокислот: а) трансаминирование; б) декарбоксилирование; в) дезаминирование: окислительное, восстановительное, внутримолекулярное, гидролитическое; г) образование пептидов.
В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким пре- вращениям относятся трансаминирование, декарбоксилирование, элиминирование, альдольное расщепление, окислительное дезаминирование, окисление тиольных групп.
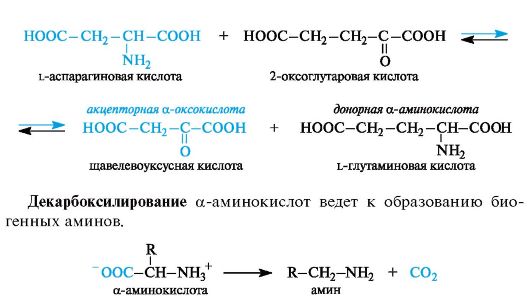
Трансаминирование является основным путем биосинтеза α-ами- нокислот из α-оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором — α-оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота — в аминокислоту с соответствующим строением радикалов. В итоге трансаминирование представляет обратимый процесс взаимообмена амино- и оксо- групп. Пример такой реакции — получение l-глутаминовой кислоты из 2-оксоглутаровой кислоты. Донорной аминокислотой может служить, например, l-аспарагиновая кислота.
α-Аминокислоты содержат в α-положении к карбоксильной группе электроноакцепторную аминогруппу (точнее, протонированную аминогруппу NH3+), в связи с чем способны к декарбоксилированию.
Окислительное дезаминирование может осуществляться с участием ферментов и кофермента НАД+ или НАДФ+. α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из l-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегид- рирование (окисление) глутаминовой кислоты до α-иминоглутаровой
кислоты. На второй стадии происходит гидролиз, в результате которого получаются α-оксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента.
В обратном направлении протекает реакция восстановительного аминирования α-оксокислот. Всегда содержащаяся в клетках α-оксоглутаровая кислота (как продукт метаболизма углеводов) превращается этим путем в L-глутаминовую кислоту.
Видео:Аминокислоты. Получение. Все 6 реакций ЕГЭ.Скачать

Для аминокислот характерна амфотерность
Амфотерность является основным физико-химическим свойством аминокислот.
Понятие амфотерность означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов. Данное свойство аминокислот напрямую связано со амфотерными свойствами белков, благодаря которому они участвуют в регуляции кислотно-основного состояния крови.
Амфотерность аминокислот
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим.
Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты:
- ИЭТ большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин),
- ИЭТ кислых аминокислот — для глутамата 3,2, для аспартата 2,8,
- ИЭТ основных аминокислот — для гистидина 7,6, для аргинина 10,8, для лизина 9,7.
Изоэлектрическая точка гистидина позволяет ему использоваться в буферной системе гемоглобина. Гемоглобин легко принимает и легко отдает ионы водорода при малейших сдвигах физиологической рН крови (в норме 7,35-7,45).
Заряд аминокислот зависит от величины рН среды и от строения их радикала.
При снижении концентрации ионов водорода в растворе (защелачивание среды) повышается их отрыв от аминогруппы и карбоксигруппы аминокислот. Иными словами, от аминокислоты уходит положительный заряд и она становится отрицательно заряженной. Когда рН снижается (закисление среды), то имеющиеся в растворе ионы Н + присоединяются к амино- и карбоксигруппам – заряд аминокислоты становится положительным.
Отправным пунктом для понимания причин появления заряда у конкретной аминокислоты является величина изоэлектрической точки. К уже сказанному необходимо добавить одну очень существенную вещь – изменение рН рассматривается относительно изоэлектрической точки (ИЭТ, pI) . Если рН ниже pI – заряд аминокислоты становится положительным, если рН выше – отрицательным.
🌟 Видео
Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Лекция: Химия - АминокислотыСкачать

Лекция 12. 1. Дезаминирование АК. Пути обезвреживания аммиака.Скачать

Биоорганическая химия. Классификации Аминокислот.Скачать

АМИНОКИСЛОТЫ, миникурсСкачать

Разделение аминокислот на фракции электрофорезом при разных рН. Биохимия.Скачать

Изоэлектрическая точка (ИЭТ или pI) для аминокислот. Учимся вычислять. Биохимия.Скачать

Лекция 11 Часть 3 Трансаминирование АКСкачать

Как запомнить формулы аминокислот? | БиохимияСкачать

АМИНОКИСЛОТЫ 1: введение, классификация, изоэлектрическая точкаСкачать

разбор 35 задачи из ЕГЭ по химии на сложный эфир аминокислотыСкачать

26. Типы реакцийСкачать

Химия. ЕГЭ. Задачи по органической химии- 2Скачать

Переваривание белков. Трансаминирование АСТ АЛТ. Дезаминирование. Коэффициент де РитисаСкачать

Информативность и значимость анализа на органические и аминокислоты при РАССкачать

Определение pI (изоэлектрической точки) пептидов. Биохимия.Скачать

100 секретов внекорневых подкормок аминокислотами и микроэлементами.Скачать

Подготовка к январскому ЕНТ 2024 | ХимияСкачать