Большинство химических реакций протекают одновременно в двух направлениях: в сторону образования продуктов реакции (прямая реакция) и в сторону разложения последних (обратная реакция). Вследствие химической обратимости реакции не доходят до конца. Скорость прямой реакции уменьшается, а скорость обратной, напротив, возрастает. Когда эти скорости выравниваются наступает состояние химического равновесия.
Так как химически обратимые реакции до перехода в равновесное состояние протекают с конечными скоростями, то с точки зрения термодинамики они не обратимы. Однако можно мысленно представить, что эти реакции идут бесконечно медленно через смежные равновесные состояния. Тогда к ним можно применить общие условия термодинамического равновесия.
Для гомогенных обратимых реакций экспериментально Гульбергом и Ваге был установлен закон действующих масс. При постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению равновесных концентраций (или парциальных равновесий) исходных веществ есть величина постоянная.
Этот экспериментально установленный закон может быть получен методом термодинамических потенциалов. Рассмотрим реакцию в газовой фазе:
аА(г) + b В ↔ сС + dD
Когда система достигает термодинамического равновесия, то термодинамический потенциал при фиксированных естественных переменных достигает минимума. Равновесие, таким образом, можно охарактеризовать выражением химических потенциалов, когда потенциалы продуктов реакции сравняются с потенциалами исходных веществ:
с μ ( с ) + d μ (D) – a μ (a) — b μ (b) = 0 (6 – 1)
Если естественными переменными являются p и T , то 


Отсюда для систем, подчиняющихся закону идеальных газов, можно получить выражения для μ i
μ i = μ i ° + RTlnCi (6 – 2) 
где μ i ° — стандартный химический потенциал.
Подставляется (6 – 2) в (6 – 1) и перенося постоянные величины в левую часть, получаем
сμ C ° + d μ D ° — a μ A ° — b μ B ° = — RTln 

Поскольку в левой части выражение не зависит от концентраций, то выражение под логарифмом является постоянной величиной при постоянной температуре:

Для идеального газа парциальные давления пропорциональны концентрациям, поэтому константа равновесия может быть всегда выражена через равновесные парциальные давления:
Аналогично может быть записано выражение через мольные доли:
Для идеальных газов эти константы связаны между собой соотношением:
где
Следует обратить внимание, что в полученных соотношениях только KN зависит от общего давления. Она позволяет нам оценивать сдвиг равновесия в газовых реакциях при изменении общего давления. Следует иметь в виду, что давление в этих выражениях складывается из парциальных давлений компонентов системы и не учитывает влияние инертных газов, если они присутствуют в реакционной смеси. Естественно инертный газ «разбавляет» компоненты реакционной смеси и поэтому влияет на KN .
Из уравнения (6 – 3) вытекает связь константы равновесия с ∆ rG °:

Это уравнение было впервые получено Вант – Гофором методом циклов и получило название уравнения изотермической химической реакции. Очевидно, в этом уравнении ∆ rGT ° относится к этой температуре, при которой определена Кр. Уравнение изотермической химической реакции позволяет определить константу равновесия при заданных условиях не прибегая к исследованию равновесия. Величина ∆ rGT ° может быть рассчитана на основе термических констант для индивидуальных веществ.
Если заданы концентрации (парциальные давления) отличные от равновесных, то можно записать более общий вид уравнения изотермической химической реакции:
Это выражение позволяет определить направление самопроизвольного процесса.
Уравнение изотермы химической реакции позволяет получить выражение для температурной зависимости константы равновесия.
Запишем уравнение Гиббса – Гельмгольца:
Подставим выражение для 

Дифференцируем уравнение (6 – 5)


Из уравнения (6 — 5´) получаем уравнение изобары химической реакции:

Если проинтегрировать уравнение (6 – 6) в предположении, что ∆ rHT ° не зависит от температуры, то получим уравнение:
где С – константа интегрирования.
Уравнение (6 – 7) хорошо выполняется в узких интервалах температур и позволяет определить ∆ rGT °.
Для широких интервалов температур ln K р представляют в виде степенных рядов или других аналитических формах:
Такие выражения позволяют рассчитать все термодинамические функции для процессов, для которых данные зависимости получены.
Выражения для термодинамических потенциалов, полученные для идеального газа. Для реальных газов, а особенно для газовых растворов возникают затруднения. Это связано с тем, что расчет концентраций и давлений должен быть проведен исходя из уравнения состояния. Однако для реальных систем единое достаточно простое уравнение состояния получить не удалось.
В связи с этим в термодинамике реальных систем применяется эмпирический метод, предложенный Льюисом. Льюис предложил в уравнениях термодинамики, полученных для идеальных систем заменить давления p на величину летучести f , а концентрации С на активности a .
При такой замене выражения для констант равновесия не меняются по форме. Но этот прием позволяет связать экспериментально найденные свойства реального газа с термодинамическими параметрами.
Летучести и активности – это экспериментальные величины, которые находятся из условия, что для раствора при бесконечном разбавлении или газа при давлении стремящимся к 0 активность приближается к аналитической концентрации, а летучесть к реальному давлению идеального газа. Исходя из этой посылки рассчитываются активности и летучести.
При 1273 К и общем равновесии 30 атм. В равновесной системе




В соответствии с законом Авогадро, объёмный процент равен мольному проценту. Следовательно, 
Отсюда находим
В отличие от 




Для 25% 
Следовательно,
При 2000°С и общем давлении 1 атм. 2% воды диссоцииовано на водород и кислород. Рассчитайте константу равновесия реакции 
- Примеры решения типовых задач
- Реакции разложения
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
- 📸 Видео
Видео:Влияние температуры на скорость химических реакций. 10 класс.Скачать

Примеры решения типовых задач
Глава I. Химическая термодинамика
1. Определить тепловой эффект химической реакции в стандартных условиях при 500 К: СН3ОН + 3/2 О2(г) = СO2(г) + 2Н2O
Из справочника [8] выпишем необходимые для расчёта термодинамические величины
| Вещество | СO2 (г) | Н2O (г) | O2 (г) | СН3ОH (г) |
| ΔН 0 f, 298 кДж/моль | -393,51 | -241,84 | -201,20 | |
| С 0 р, 298 Дж/мольК | 37,13 | 33,56 | 29,36 | 43,90 |
Для расчёта теплового эффекта и изменения теплоёмкости применим следствие из закона Гесса, при этом учитываем, что для простых веществ стандартная теплота образования равна нулю.
ΔH 0 298, х.р. = ΔН 0 298, f ( 


= (– 393,51) + 2(–241,84) – (–201,2) = – 675,99 кДж.
Знак минус перед тепловым эффектом означает, что теплота выделяется в результате реакции.
ΔС 0 р, 298 = (Ср( 



= ( 37,13 + 2·33,56 ) – ( 43,9 + 3/2·29,36) = 16,31 Дж/К
Тепловой эффект при 500 К находим по уравнению Кирхгофа (второе приближение), при условии, что средняя изобарная теплоемкость постоянна
ΔН 0 500 х.р. = 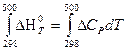

= – 675,99·10 3 + 16,31(500 – 298) = 672,70·10 3 Дж = 672,7 кДж
2. Рассчитать (по теплотам сгорания) стандартную теплоту образования глицерина С3Н8О3 (ж).
Из определения теплоты образования следует, что H298, f ( 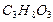
используя следствие из закона Гесса, можно записать:
Δ H298, f ( 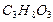
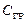
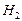
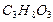
Теплоты сгорания простых веществ при стандартных условиях численно равны стандартным теплотам образования продуктов сгорания, т.е. для реакций
из справочника [8] определяем:
ΔН298, сгор ( 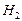

ΔН298, сгор ( 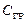

ΔН298, сгор ( 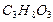
ΔНf, 298 ( 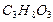
По справочным данным эта величина равна – 668,6 Кдж/моль.
3. Дайте заключение о возможности самопроизвольного протекания химической реакции при Т = 298 К
молочная кислота пировиноградная к-та
| Вещество | ΔH298, f кДж/моль | S298, f, Дж/моль·К |
| молочная кислота | -673 | |
| пировиноградная к-та | -586 | |
| Н2 |
Рассчитаем по следствию из закона Гесса:
1. Изменение энтальпии: ΔН 0 298, р = (– 586 + 0) – (– 673) = 87 (кДж)
2. Изменение энтропии: ΔS 0 298, p = (179 + 130) – 192 =117 (Дж/К)
3. Изменение энергии Гиббса по уравнению Гиббса-Гельмгольца (первое приближение):
ΔG 0 298 = ΔH 0 298 – TΔS = 87·10 3 – 298·117 = 52134 (Дж)
реакция самопроизвольно протекать не может, т.к. ΔG 0 298 > 0
4. При 1000 К и 1,013·10 5 Па из исходной смеси, содержащей 1 моль SО2 и 0,6 моль О2 при достижении равновесия образовалось 0,22 моль SО3. Определить Кр для реакции
2SО2 + О2 
На образование 0,22 моль SО3, согласно уравнению реакции израсходовано 0,22 моль SО2 и 0,11 моль кислорода. Запишем число молей
| SО2 | О2 | SО3 | |
| В исходной смеси | 0,6 | ||
| Прореагировало/образовалось | 0,22 | 0,11 | 0,22 |
| В равновесной смеси | 1 – 0,22 = 0,78 | 0,6 – 0,11 = 0,49 | 0,22 |
| Συi | 0,78 + 0,49 + 0,22 = 1,49 |
P( 

Р( 

P( 

5. Для реакции: СО + Cl2 
а) 1моль СО; 1 моль Cl2; 4 моль COCl2
б) 1моль СО; 1 моль Сl; 8 моль COCl2
в) 1моль СО; 1,565 моль Cl2; 10 моль COCl2
Воспользуемся уравнением изотермы химической реакции.
а) ΔG = – RTln·6,386 + RT·ln 4
He производя вычислений, а лишь сравнивая величины, стоящие за знаком логарифма, можно сделать вывод, что G 0. Это значит, что при смешивании реагирующих веществ в указанных соотношениях реакция пойдёт в сторону образования СО и Cl2;
в) ΔG = – RTln 6,386 + RTln 6,386
Сравнив оба слагаемых, можно сделать вывод, что ΔG = 0. В этом случае система находится в состоянии химического равновесия.
6. Рассчитать значение константы равновесия для реакции при стандартных условиях и 1000 К, если изменение энергии Гиббса равно – 100,79 кДж.
Воспользуемся уравнением изотермы при стандартных условиях.
lgKp = (– ΔG 0 T) / (2,3·RT) = (–100,79) / (2,3·8,31·1000) = 5,27
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:№ 501-600 - Физика 10-11 класс РымкевичСкачать

Разложение солей
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:Как температура влияет на скорость химической реакции? Уравнение АррениусаСкачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Абсолютная температура | Физика 10 класс #31 | ИнфоурокСкачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:ДВИ по химии. Термохимия. Уравнение Аррениуса, закон Гесса, задачи на теплоемкостьСкачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:Урок 112 (осн). Уравнение теплового балансаСкачать

Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Разложение перманганата калия
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
📸 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Количество теплоты, удельная теплоемкость вещества. Практическая часть - решение задачи. 8 класс.Скачать

Количество теплоты, удельная теплоемкость вещества. 8 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать



















