 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 |
Дидактическая единица 4. Физическая и коллоидная химия
Тема заданий 15. Основы химической термодинамики
ЗАДАНИЕ N 15.1 ( — выберите один вариант ответа)
Система, для которой термодинамические параметры во всех точках сохраняют свое постоянное значение, находится в _______ состоянии.
ЗАДАНИЕ N 15.2 ( — выберите один вариант ответа)
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает ________ закон термодинамики.
ЗАДАНИЕ N 15.3 ( — выберите один вариант ответа)
Из первого начала термодинамики следует, что в любой изолированной системе запас внутренней энергии ______ .
совершает колебательные изменения
ЗАДАНИЕ N 15.4 ( — выберите один вариант ответа)
Согласно второму началу термодинамики в изолированных системах самопроизвольно протекают процессы, для которых справедливо выражение… ВАРИАНТЫ ОТВЕТОВ:
ΔH — выберите один вариант ответа)
Согласно второму началу термодинамики, состояние равновесия реализуется в изолированных системах, для которых справедливо выражение…
ЗАДАНИЕ N 15.6 ( — выберите один вариант ответа)
Согласно второму началу термодинамики в изобарно-изотермических системах самопроизвольно протекают процессы, для которых справедливо выражение… ВАРИАНТЫ ОТВЕТОВ:
ΔH — выберите один вариант ответа)
Согласно основным положениям термодинамики, для состояния равновесия в изобарно-изотермических системах справедливо выражение…
ΔG — выберите один вариант ответа)
Процесс перехода системы из одного состояния в другое при постоянном давлении называется …
ЗАДАНИЕ N 15.9( — выберите один вариант ответа)
Процесс, протекающий при постоянном значении количества теплоты в системе, называется …
ЗАДАНИЕ N 15.10 ( -укажите не менее двух вариантов ответа)
Уравнения реакций, для которых в изобарно-изотермических условиях ∆rH = ∆rU, имеют вид…
Fe2O3(т) + 3C(т) = 2Fe(т) + 3CO(г)
CO(г) + 2H2(г) = CH3OH(г)
ЗАДАНИЕ N 15.11 ( — выберите один вариант ответа)
Энтальпия образования СаСО3 соответствует тепловому эффекту реакции …
ЗАДАНИЕ N 15.12 ( — выберите один вариант ответа)
Исходя из уравнения реакции 

ЗАДАНИЕ N 15.13 ( — выберите один вариант ответа)
Формула для расчета теплового эффекта химической реакции 
1)
2)
3)
4)
ЗАДАНИЕ N 15.14 ( — выберите один вариант ответа)
Если энтальпия образования SO2 равна -297 кДж/моль, тогда количество теплоты, выделяемое при сгорании 16 г серы, равно…
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Уравнения реакций для которых в стандартных изобарно изотермических условиях hu имеют вид
Раствор гидроксида бария массой 200 г и массовой долей растворенного вещества 17,1% разбавили водой до объема 400 мл. Молярная концентрация эквивалентов 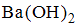
Уравнения реакций, для которых в стандартных изобарно-изотермических условиях 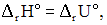
Процесс, протекающий при постоянном значении количества теплоты в системе, называется …
Уравнения реакций, в результате которых происходит образование коллоидных растворов методом химической конденсации, имеют вид …
Процесс нейтрализации электрического заряда и удаления гидратной оболочки коллоидных частиц, в результате которого происходит образование осадка, называется …
Уравнения реакций, в которых при изменении давления не происходит смещения равновесия, имеют вид …
Противоионы, не входящие в состав коллоидной частицы (гранулы), образуют слой, который называется …
Уравнения процессов, для которых при увеличении температуры равновесие смещается в сторону продуктов реакции, имеют вид …
При этерификации пропионовой кислоты этанолом в качестве органического продукта реакции образуется …
Уравнение 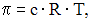
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Первый закон термодинамики в изобарных, изохорных, изотермических и адиабатических условиях для идеальных газовых систем
Уравнение первого закона термодинамики, как уже сказано выше, для изобарных (р = const) условий в идеальной газовой системе имеет вид
В изотермических условиях (АТ = 0) вся теплота, поданная системе, идет на совершение работы расширения:
Для идеального газа предполагается, что изменение внутренней энергии связано только с изменением температуры: AU = vcvAT = 0 (здесь v — количество молей идеального газа; cv — изохорная теплоемкость; АТ — изменение температуры).
Если процесс протекает в изохорных условиях (AV = 0), то работа расширения идеального газа отсутствует (pAV = 0). При этом теплота, поглощаемая системой, равна приросту внутренней энергии, т.е. вся теплота идет на нагревание системы:
Из уравнения первого закона термодинамики (2.1) очевидно, что для адиабатических процессов (Q = 0)
То есть система может совершать работу без подачи энергии извне только за счет понижения внутренней энергии (понижения температуры).
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Тепловые эффекты химических реакций
Количество теплоты — это количественная мера изменения внутренней энергии тела при теплообмене. Единица его измерения — джоуль (Дж). Количество теплоты при нагревании или охлаждении можно рассчитать по формуле

где Q—количество теплоты; ст — мольная теплоемкость вещества [Дж/К • моль] или [кал/моль • град]; АТ = Т <— Т2 — изменение температуры.
Мольной теплоемкостью называется количество тепла, которое необходимо сообщить 1 молю вещества для того, чтобы увеличить его температуру на 1 градус Кельвина. Удельной теплоемкостью называется количество тепла, необходимое для увеличения температуры 1 кг вещества на 1 градус Кельвина.
При нагревании тело получает энергию, при охлаждении — выделяет, так как
Если теплообмен происходит между несколькими телами, составляющими изолированную от окружающих тел систему, то применяют уравнение теплового баланса:

где Q1, Q2, Qз количество теплоты, полученное или отданное телами; п число тел, участвующих в теплообмене.
Теплоту, полученную телом, считают положительной и в уравнении ставят знак «+»; теплоту, отданную телом, считают отрицательной и ставят знак «-«.
Тепловым эффектом химической реакции называют алгебраическую сумму поглощенной при реакции теплоты и совершенной работы за вычетом работы против сил внешнего давления (pAV).
В соответствии с первым законом термодинамики

где AU — изменение внутренней энергии системы; А — совершенная системой работа; тепловой эффект реакции зависит от пути и способа проведения процесса.
Однако при соблюдении но крайней мерe одного из двух условий теплота химической реакции не зависит от пути и способа осуществления взаимодействия:
- 1) если реакция протекает в изохорно-изотeрмичeских условиях и при этом не совершается работа (A = 0; V = const; Т = const), то тепловой эффект реакции равен изменению внутренней энергии системы и, следовательно, не зависит от пути процесса:
(2.9)
где U2 — внутренняя энергия продуктов реакции; U1 — внутренняя энергия исходных веществ;
- 2) если реакция протекает в изобарно-изотермических условиях (p = const; Т = const) и при этом не совершается никакой работы, кроме работы расширения, то тепловой эффект реакции равен изменению энтальпии системы и, следовательно, не зависит от пути процесса:
(2.10)
где H2 — энтальпия продуктов реакции; H1 — энтальпия исходных веществ.
Измерение тепловых эффектов реакций составляет обширную область термохимии, данные которой позволяют составить правильное представление об энергетической ценности той или иной реакции, ее внутреннем механизме, возможном направлении кинетики и т.д.
Для практических измерений тепловых эффектов употребляются калориметры. Результаты опытов по измерению тепловых эффектов очень интересны. Так, оказалось, что 1 г веществ, из которых состоит бактерия (кишечная палочка), выделяет в час около 400 кал (1 кал = 4,1868 Дж), 1 г веществ таракана — 50 кал/ч, 1 г веществ улитки — около 0,5 кал/ч. Особенно поучительно сравнение этих величин с теми, которые характеризуют неживые объекты: 1 г веществ, образующих тело человека, выделяет в 10 000 раз больше теплоты, чем 1 г материи Солнца; летящая муха дрозофила выделяет за единицу времени столько же энергии, сколько автомобиль на полной скорости, а бактерия — столько же, сколько реактивный самолет (в расчете, конечно, на равные веса). Эти парадоксальные результаты указывают на исключительную мощность синтетических процессов в живых организмах и необычайные энергетические возможности жизни.
Результаты термохимических измерений — тепловые эффекты реакций — принято относить к 1 молю образующегося вещества.
Количество теплоты, которое выделяется или поглощается при образовании одного моль химического соединения из простых веществ, носит название теплоты образования химического соединения. Например, выражение «теплота образования воды равна 285,8 кДж/моль» означает, что при образовании 18 г жидкой воды из 2 г водорода и 16 г кислорода выделяется 285,8 кДж.
Или, используя понятие энтальпии, можно сказать, что энтальпией образования вещества называется изменение энтальпии в реакции образования одного моль химического соединения из простых веществ. Напри
мер, образование оксида алюминия протекает согласно термохимическому уравнению:
Так как дана реакция образования одного моль оксида алюминия из простых веществ, то изменение энтальпии этого процесса можно назвать энтальпией образования оксида алюминия и записать ее как ДНАlo2(кр) = = -1675 кДж/моль.
Если элемент может существовать в виде нескольких простых веществ, то при расчете теплоты образования этот элемент берется в виде того простого вещества, которое при данных условиях наиболее устойчиво. Теплоты образования наиболее устойчивых простых веществ принимают равными нулю. Например, при обычных условиях наиболее устойчивой формой кислорода является молекулярный кислород 02, теплота образования которого считается равной нулю. Теплота же образования озона 03 равна -142 кДж/моль, поскольку при образовании из молекулярного кислорода 1 моля озона поглощается 142 кДж.
Тепловые эффекты можно включать в уравнения реакций. Химические уравнения, в которых указано количество выделяющейся или поглощаемой теплоты, называются термохимическими уравнениями. Величина теплового эффекта указывается обычно в правой части уравнения со знаком «+» в случае экзотермической реакции и со знаком «-» в случае эндотермической реакции. Например, термохимическое уравнение реакции образования жидкой воды имеет вид
Возможна и другая запись термохимических уравнений, в которой величина теплового эффекта указана в виде изменения энтальпии АН. Часто изменение энтальпии записывается как АН 0 298Верхний индекс «0» означает стандартную величину теплового эффекта реакции, а нижний температуру, при которой идет взаимодействие. В реакциях, идущих с выделением теплоты (экзотермических), энтальпия системы уменьшается (АН 0).
Ниже приведен пример записи термохимического уравнения с учетом вышесказанного:
Данная запись означает, что реакция образования оксида азота (II) идет с поглощением теплоты (эндотермическая).
Обе формы записи правильны, и возможно использование любой из них.
Важнейшей характеристикой веществ, применяемых в качестве топлива, является их теплота сгорания. Эту величину также принято относить
к 1 молю вещества. Таким образом, выражение «теплота сгорания ацетилена равна 1300 кДж/моль» эквивалентно термохимическому уравнению
Величина теплового эффекта зависит от природы исходных веществ и продуктов реакции, их агрегатного состояния и температуры. Для удобства сравнения различных реакций по величинам их тепловых эффектов последние обычно указывают для случая, когда температура исходных веществ и продуктов реакции равна 25°С.
Таким образом, энтальпии (теплоты) образования веществ являются индивидуальными характеристиками соединений, как и плотность, электропроводность, температура плавления и другие свойства. И точно также зависят от условий, при которых происходит их определение.
🌟 Видео
Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Химия | Молекулярные и ионные уравненияСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Основы теплотехники. Термодинамические процессы. Изохорный, изобарный, изотермический, адиабатный.Скачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Энергетика химических реакцийСкачать

Решение задач на первое начало термодинамики. ТермохимияСкачать

ФИЗИЧЕСКАЯ ХИМИЯ (ТЕРМОДИНАМИКА). ОСНОВНЫЕ ПОНЯТИЯ: СИСТЕМЫ, ПАРАМЕТРЫ, ФУНКЦИИСкачать

Эта тема ВСЕГДА встречается на экзамене ЦТ — Изопроцессы (Физика для чайников)Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

25. Схема реакции и химическое уравнениеСкачать

Все типы химических реакций на ОГЭ по химии | Это попадется на экзамене | Химия ОГЭ 2023 | УмскулСкачать

Составление уравнений реакций. 1 часть. 10 класс.Скачать














 (2.9)
(2.9) (2.10)
(2.10)



