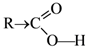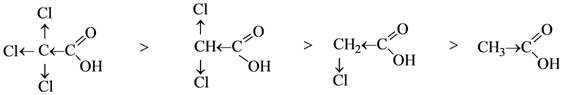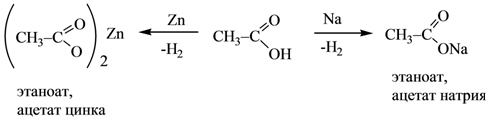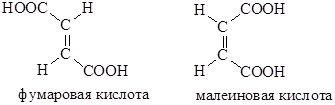1.Реакция декарбоксилирования при нагревании щавелевой и малоновой кислот
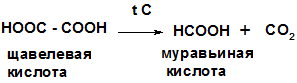 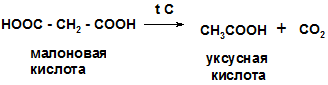 |

Влияние заместителей на величину кислотности.
. Донорные группыувеличивают прочность связи кислород-водород, что приводит к уменьшению силы кислот (к увеличению значения рКа).
рКа 3,75 4,76 4,86
2. Акцепторные группы уменьшают электронную плотность связи кислород-водород, это приводит к увеличению их силы (уменьшению значения рКа).
19. Непредельные карбоновые кислоты: акриловая, фумаровая, малеиновая. Характерные свойства. Сравнительная кислотность дикарбоновых кислот на примере щавелевой и малоновой кислоты. Реакция замещения атома водорода в малоновом эфире. (+сама)
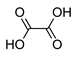
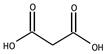
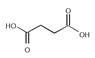
Ненасыщенные карбоновые кислоты содержат в углеводородной цепи одну или несколько двойных или тройных связей. Полимеризацией сложных эфиров и нитрилов этих кислот получают пластмассы, пленкообразующие и связующие вещества. Ненасыщенные карбоновые кислоты вступают в реакции, характерные для карбоксильной группы и для двойных связей. Как карбоновые кислоты они образуют сложные эфиры и другие производные. В живом мире они в основном встречаются в виде сложных эфиров глицерина (триацилглицерины), т.е. в виде жидких масел.
АКРИЛОВАЯКИСЛОТА (пропеновая к-та, этиленкарбоновая к-та) СН2=СНСООН, мол. м. 72,06; бесцв. жидкость с резким запахом;
Акриловая кислота обладает химическими свойствами, присущими карбоновым кислотам: образует соли, хлорангидриды, ангидриды, сложные эфиры. амиды и пр. Она также вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы Na в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd акриловая кислота превращается в пропионовую кислоту, в среде ДМСО гидродимеризуется. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием 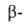
Малеиновая кислота — органическое соединение с формулой HOOC-CH=CH-COOH. Название по номенклатуре — цис-бутендиовая кислота. Её транс-изомером является фумаровая кислота. Наиболее часто она используется для получения фумаровой кислоты.
(хим свойства смотри в учебнике и тетради)
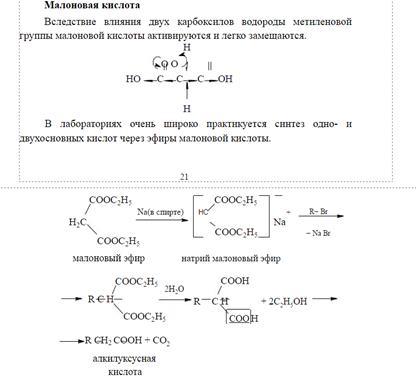
. Реакции эфиров малоновой кислоты и синтезы с малоновым эфиром. В средних эфирах малоновой кислотыатомы водорода группы СН2 способны замещаться на металлы. Так, при действии натрия на этиловый эфир малоновой кислоты (обыкновенно называемый просто малоновым эфиром) можно получить продукты замещения одного или двух атомов водорода на атомы натрия, натриймалоновый эфир CHNa(COOC2H5)2 и динатриймалоновый эфир CNa2(COOC2H5)2 В однозамещенных производных малонового эфира типа R—СН(СООС2Н5)2 может замещаться на натрий лишь один атом водорода с образованием соединений R—CNa(COOC2H5)2. Двузамещенные производные типа R2C(COOC2H5)2 совершенно не способны к замещению водорода на натрий.
Способность малонового эфира давать металлические производные позволяет синтезировать при его помощи многочисленные кислоты различной основности.
Металлическим производным малоновых эфиров придают строение енолятов (аналогично производным ацетилацетона):
Непредельные карбоновые кислоты акриловая, фумаровая, малеинова . Характерные свойства. Сравнительная кислотность дикарбоновых кислот на примере щавелевой и малоновой кислоты. Реакции замещения атома водорода в малоновом эфире сама
Формула акриловой кислоты выглядит следующим образом: СН2 = СН — СООН. Жидкость легко реагирует с мономерами, при этом образуются сополимеры.
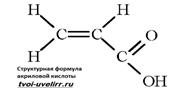
Акриловая кислота образует соли, хлорангидрид, ангидриды, сложные эфиры, амиды и пр. Она вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы натрия в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd в пропионовую кислоту. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием замещённых производных. Как диенофил акриловая кислота участвует в диеновом синтезе. Конденсируется с солями арилдиазония (реакция Меервейна):
При УФ-облучении или в кислых водных растворах (рН = 1), а также в присутствии инициаторов полимеризации образует полиакриловую кислоту ([−СН2−СН(СООН)−]n).
Малоновая
Фумаровая кислота
Фумарат является интермедиатом в цикле Кребса. Он образуется при окислении сукцината ферментом сукцинатдегидрогеназой и далее превращается в малат ферментом фумаразой. Кожа человека образует фумарат при действии солнечного света.
Фумарат также является побочным продуктом цикла мочевины.
Впервые фумаровая кислота была получена из янтарной кислоты [1] . Традиционный метод синтеза включает в себя стадии окисления фурфурола хлоратом натрия в присутствии ванадиевого катализатора [2] . В настоящее время промышленный синтез фумаровой кислоты осуществляется путём каталитической изомеризации малеиновой кислоты в водных растворах [3] .
Эфиры фумаровой кислоты применяют для лечения псориаза, дневная доза 60-105 мг, и повышается до 1300 мг в день. Натриевая соль фумаровой кислоты входит в состав препаратов конфумин и мафусол.
Дикарбоновые кислоты (?)
дикарбоновыми кислотами называют производные углеводородов, содержащие в своем составе две карбоксильные группы.
Имея в своем составе две карбоксильные группы, дикарбоновые кислоты диссоциируют ступенчато, образуя анион (рКа1) и дианион (рХа2).
Высокая кислотность по первой ступени объясняется влиянием второй карбоксильной группы, которая способствует делока-лизации образующегося отрицательного заряда карбоксилат-иона и тем самым повышает его устойчивость. По мере удаления карбоксильных групп друг от друга ослабевает их взаимное влияние, и кислотность по первой ступени падает. Отрыв протона от второй карбоксильной группы происходит труднее вследствие низкой стабильности дианиона, поэтому кислотность дикарбоновых кислот по второй ступени значительно ниже, чем по первой.
При максимальном удалении карбоксильных групп взаимное влияние ослабевает, и через 5—6 связей каждая из них ведет себя независимо.
По химическим свойствам дикарбоновые кислоты так же, как и монокарбоновые, способны образовывать одни и те же функциональные производные. Только в зависимости от того, одна или две карбоксильные группы участвуют в реакции, получают кислые или средние соли, полные и неполные эфиры, галогенангид-риды, амиды и др.
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Электролиз и декарбоксилирование солей карбоновых кислотСкачать  Реакция Дюма (декарбоксилирование)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. Относится к реакциям декарбоксилирования солей карбоновых кислот. Декарбоксилирование – это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (–COOH) или органической кислоты или карбоксилатной группы (–COOMe) соли органической кислоты. Как правило, декарбоксилирование протекает при нагревании с кислотами или щелочами. Сложнее всего отщепить диоксид углерода у монокарбоновых предельных кислот: реакция протекает только при высоких температурах. R–COONa + NaOH → R–H + Na2CO3 Например , ацетат натрия реагирует с гидроксидом натрия только при 400 о С: При этом образуется метан и карбонат натрия. Пропионат калия взаимодействует с гидроксидом калия в расплаве с образованием этана: 🎬 ВидеоДекарбоксилирование. Химический опытСкачать  КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать  8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать  275. Окислительное декарбоксилирование пирувата.Скачать  Соли карбоновых кислот. Химические свойства. Все 8 реакций ЕГЭ.Скачать  ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  ЭНЕРГООБМЕН 2. ОПК: ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРУВАТА И ЦИКЛ КРЕБСАСкачать  Пируватдегидрогеназный комплекс | БиохимияСкачать  Несколько опытов с МАЛОНОВОЙ КИСЛОТОЙСкачать  Лекция 4.2 Аэробный этап гликолиза. Декарбоксилирование пировиноградной кислоты. Цикл Кребса.Скачать  Свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать  Все о получении карбоновых кислот за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать  Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать  ЛЕКЦИЯ 2. КИСЛОТЫСкачать  Взаимодействие металлов с кислотами. 8 класс.Скачать  Биохимия. Лекция 51. Общие пути катаболизма. Энергообмен. Цикл Кребса.Скачать  Теории кислот, оснований и растворов. Теория Брёнстеда-Лоури. 11 класс.Скачать  Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать  |