Хромат калия (K2CrO4): свойства, риски и применение — Наука
- Содержание:
- Физические и химические свойства
- Реакционная способность и опасности
- Приложения
- Хромат калия
- Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
- Токсичность
- Хромат калия. Получение, химические и физические свойства. Применение
- Как получают хромат калия?
- Химические свойства хромата калия:
- Физические свойства хромата калия:
- Оптические свойства хромата калия
- Где применяется калий хромат?
- Калий дихромат (техническое название — хромпик)
- 📸 Видео
Видео:Цветные химические опыты с дихроматом калия.Скачать

Содержание:
В хромат калия представляет собой неорганическое соединение формулы K2CrO4, который характеризуется как мощный окислитель. Его получают обработкой дихромата калия гидроксидом калия по реакции: K2CrO7 + 2KOH → 2K2CrO4 + H2ИЛИ.
Как соединение с относительно уникальным профилем, хромат калия имеет ряд применений в промышленных и научных контекстах. Однако из-за его токсичности его воздействие следует ограничивать (JACOBS, 2015).
Видео:Хромат Бария - BaCrO4. Реакция Хромата Калия и Хлорида Бария. Реакция BaCl2 и K2CrO4.Скачать

Физические и химические свойства
Хромат калия — это желтоватые кристаллы ромбической формы, лишенные характерного аромата и имеющие неприятный горький вкус (Национальный центр биотехнологической информации, 2017).
Его молекулярная масса составляет 194,19 г / моль, а плотность — 2,7320 г / мл. Он имеет температуру плавления 968 ° C и температуру кипения 1000 ° C.
Соединение нерастворимо в спирте и хорошо растворимо в воде, способно растворять 62,9 грамма на 100 мл растворителя при 20 ° C (Royal Society of Chemistry, 2015).
Видео:Из хромата калия K2CrO4 в дихромат калия K2Cr2O7 и обратно - цветные переходы соединений хромаСкачать

Реакционная способность и опасности
Окислители, такие как хромат калия, могут реагировать с восстановителями с выделением тепла и продуктов, которые могут быть газообразными (вызывая повышение давления в закрытых контейнерах).
Продукты могут быть способны к дополнительным реакциям (например, горению на воздухе). Химическое восстановление материалов этой группы может быть быстрым или даже взрывным, но часто требует инициирования (нагревание, искра, катализатор, добавление растворителя).
Взрывоопасные смеси неорганических окислителей с восстановителями часто остаются неизменными в течение длительного времени, если не допускать инициирования. Такие системы обычно представляют собой смеси твердых тел, но могут включать любую комбинацию физических состояний. Некоторые неорганические окислители представляют собой соли металлов, растворимые в воде.
Растворение уменьшается, но не отменяет окислительную способность таких материалов. Органические соединения, как правило, обладают некоторой восстанавливающей способностью и в принципе могут реагировать с соединениями этого класса.
Фактическая реакционная способность сильно зависит от типа органического соединения. Неорганические окислители могут бурно реагировать с активными металлами, цианидами, сложными эфирами и тиоцианатами.
Комплекс представляет угрозу для окружающей среды. Необходимо принять немедленные меры, чтобы ограничить его распространение. При использовании в любом месте и для любых целей, хромат калия требует эффективной локализации и утилизации, чтобы предотвратить любой сток или утечку в окружающую среду.
Кроме того, хромат калия может увеличить интенсивность пожара, если химическое вещество вступает в контакт с горючими материалами. При нагревании соединение выделяет токсичные пары хрома (ХРОМАТ КАЛИЯ, 2016).
Хромат калия очень агрессивен и является сильным окислителем. В основном он поражает нос, горло и легкие, вызывая язвы, одышку, бронхит, пневмонию и астму, но также может влиять на желудочно-кишечный тракт, печень, почки и иммунную систему.
Это вещество является известным канцерогеном для человека и связано с повышенным риском развития рака легких и рака носовых пазух (Хромат калия, 2016).
Его отсутствие запаха становится проблематичным, когда он подвергается воздействию этого химического вещества из-за его токсичности. Во многих случаях вы можете не знать, что вдохнули хромат калия.
Кроме того, вдыхание этого химического вещества создает несколько рисков. Симптомы включают тошноту, рвоту, боль в животе, ощущение жжения, диарею, шок или коллапс.
В случае попадания в глаза следует проверить и снять контактные линзы. Затем необходимо сразу промыть глаза большим количеством воды не менее 15 минут холодной водой.
В случае попадания на кожу пораженный участок следует немедленно промыть большим количеством воды в течение не менее 15 минут, снимая загрязненную одежду и обувь. Покройте раздраженную кожу смягчающим средством.
Перед повторным использованием выстирайте одежду и обувь. При сильном контакте промойте дезинфицирующим мылом и покройте загрязненную кожу антибактериальным кремом.
В случае вдыхания пострадавшего следует переместить в прохладное место. Если не дышит, делают искусственное дыхание.
Если соединение проглочено, не следует вызывать рвоту без указания медицинского персонала. Ослабьте тесную одежду, такую как воротник рубашки, пояс или галстук.
В любом случае следует немедленно обратиться за медицинской помощью (Паспорт безопасности материала Хромат калия, 2013 г.).
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Приложения
Хромат калия находит широкое применение в промышленности. В текстильной промышленности производители используют хромат калия для дубления кожи и окрашивания одежды и тканей (Dye, 2017).
Он также работает как окислитель в промышленности и в органическом синтезе. Он используется в медицине как внешний антисептик или вяжущее средство и присутствует в некоторых ветеринарных препаратах.
Хромат калия используется в качестве индикатора при определении хлорида титрованием стандартным раствором нитрата серебра. Этот метод называется методом определения хлоридов Мора.
Этот метод основан на образовании красного осадка хромата серебра в конечной точке после того, как весь хлорид выпал в осадок в виде белого хлорида серебра.
Обычно используется 5% раствор хромата калия, нейтрализованный хлоридом. Примерно 1 мл этого индикатора следует использовать на 100 мл объема пробы (RICCA Chemical Company, 2015). Реакции для титрования Мора следующие:
Ag + + Cl – → AgCl (белый осадок)
2 Ag + (избыток) + CrO4 2- → Ag2CrO4 (красный осадок в конечной точке)
Видео:Качественная реакция ионов бария с дихроматом калияСкачать

Хромат калия
| Хромат калия | |
|---|---|
 | |
| Систематическое наименование | Хромат калия |
| Традиционные названия | Хромовокислый калий |
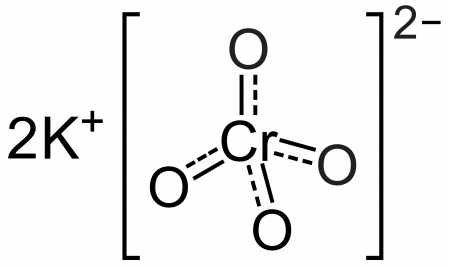
| Хим. формула | K2CrO4 |
| Состояние | жёлтые кристаллы |
| Молярная масса | 194,19 г/моль |
| Плотность | 2,732 г/см³ |
| Температура | |
| • плавления | 968,3; 973 °C |
| • кипения | 1000 °C [1] |
| Растворимость | |
| • в воде | 63,0 20 ; 75,1 80 ; 79,2 100 г/100 мл |
| Показатель преломления | 1,74 |
| Рег. номер CAS | 7789-00-6 |
| PubChem | 24597 |
| Рег. номер EINECS | 232-140-5 |
| SMILES | |
| RTECS | GB2940000 |
| ChEBI | 75249 |
| ChemSpider | 22999 |
| Токсичность | яд и канцероген |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хромат калия — неорганическое соединение, соль металла калия и хромовой кислоты с формулой K2CrO4, жёлтые кристаллы, растворимые в воде, окрашивает раствор, как и многие другие хроматы, в желтый цвет.
Видео:Равновесие в системе хромат-бихроматСкачать

Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Токсичность
Видео:Тетрапероксохромат Kалия - K3Cr(O2)4. Реакция Хромата Калия, Гидроксида Калия и Пероксида Водорода.Скачать

Получение
- В природе встречается редкий минерал тарапакаит — хромат калия с примесями.
- Окисление оксида хрома III хлоратом калия:
Cr2O3 + KClO3 + 2K2CO3 → 500−700oC 2K2CrO4 + KCl + 2CO2
- Растворение оксида хрома VI в едком кали:
CrO3 + 2KOH → K2CrO4 + H2O
- Разложение бихромата калия при нагревании:
4K2Cr2O7 → 500−600oC 4 K2CrO4 + 2Cr2O3 + 3O2
- Действие концентрированного раствора едкого кали на дихромат калия:
K2Cr2O7 + 2KOH → 2 K2CrO4 + H2O
Калий хромат и дихромат калия.
Видео:Все ОВР с дихроматом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Физические свойства
Хромат калия образует жёлтые кристаллы ромбической сингонии, пространственная группа P nam, параметры ячейки a = 0,761 нм, b = 1,040 нм, c = 0,592 нм, Z = 4.
При 668°С переходит в гексагональную красную фазу.
Хорошо растворяется в воде с гидролизом по аниону. Плохо растворим в этаноле.
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Химические свойства
- В разбавленных кислотах переходит в дихромат калия:
2K2CrO4 + 2HCl → K2Cr2O7 + 2KCl + H2O
- С концентрированными кислотами реакция идёт иначе:
K2CrO4 + 2HCl → K[Cr(Cl)O3] + KCl + H2O
- С концентрированными горячими кислотами проявляются окислительные свойства:
2 K2CrO4 + 16HCl → 90oC 2CrCl3 + 3Cl2↑ + 4KCl + 8H2O
- Вступает в обменные реакции:
K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3 K2CrO4 + Hg2(NO3)2 → Hg2CrO4↓ + 2KNO3
Видео:Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Применение
- В качестве поглотителя УФ излучения лампы накачки в твердотельных лазерах для предотвращения деградации активной среды.
- Как протрава при крашении тканей.
- Окрашивание стекла в жёлтый цвет.
- Дубитель в кожевенной промышленности.
- Отбеливатель для масла и воска.
- Окислитель в органическом синтезе.
- Хромат калия используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Видео:Оксид Хрома(6) - CrO3. Реакция Дихромата Калия и Серной Кислоты. Реакция K2Cr2O7 и H2SO4.Скачать

Токсичность
Хромат калия очень ядовит и канцерогенен, как и многие другие соединения шестивалентного хрома.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Хромат калия. Получение, химические и физические свойства. Применение
Хромат калия или хромовокислый калий (международные названия: Kalium chromicum, Kaliumchromat, Potassium chromate) — это неорганическое соединение, кристаллы желтого цвета ромбической системы, растворимые в воде. Относится к солям хромовой кислоты H2CrO4, которая в свободном состоянии не существует. У вещества хромат калия формула следующая: CrK2O4
Видео:Фтористый Хромил - CrO2F2. Реакция Дихромата Калия, Фторида Натрия и Серной кислоты.Скачать

Как получают хромат калия?
Хромовокислый калий получают несколькими способами:
- Путем окисления оксида хрома калия хлоратом (реакция происходит при температуре 500-700 градусов): Cr2O3 (оксид хрома)+ KClO3 (хлорат калия) + K2CO3 (карбонат калия) = 2K2CrO4 (калия хромат) + KCl (хлористый калий) + 2CO2 (углекислый газ)
- Путем растворения оксида хрома в гидроксиде калия: CrO3 (хрома оксид) + 2KOH (гидроксид калия) = K2CrO4 (калия хромат) + H2O (вода)
- Путем разложения дихромата калия при его нагревании (реакция осуществляется при температуре 500-600 градусов): 4K2Cr2O7 (калия бихромат) = 4K2CrO4 (калия хромат) + 2Cr2O3 (оксид хрома) + 3O2 (кислород)
- Путем воздействия концентрированного раствора калия гидроксида на калия бихромат: K2Cr2O7 (калия дихромат) + 2KOH (гидроксид калия) = 2K2CrO4 (калия хромат) + H2O (вода)
- В природе редко встречается минерал, который называется «тарапакаит». Это хромовокислый калий с примесями.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства хромата калия:
- В разбавленных кислотах хромовокислый калий переходит в дихромат калия, формула которого K2Cr2O7. Примером может служить следующая реакция: 2K2CrO4 (хромат калия) + 2HCl (соляная кислота в разбавленном виде) = K2Cr2O7 (дихромат калия) + 2KCl (хлористый калий) + H2O (вода).
- При взаимодействии с концентрированными кислотами происходит уже другая реакция, например: K2CrO4 (хромат калия) + 2HCl (соляная кислота в концентрированном виде) = K(Cr(Cl)O3) (комплексное соединение хрома) + KCl (хлористый калий) + H2O (вода).
- При взаимодействии с горячими концентрированными кислотами калия хромат проявляет окислительные свойства. Примером может служить следующая реакция, осуществляемая при температуре 90 градусов: 2K2CrO4 (калия хромат) + 16HCl (соляная кислота) = 2CrCl3 (хлорид хрома) + 3Cl2 (хлор в виде газа) + 4KCl (хлористый калий) + 8H2O (вода).
- Хромовокислый калий может вступать в обменные реакции. Например: K2CrO4 (калия хромат) + 2AgNO3 (нитрат серебра) = Ag2CrO4 (хромат серебра, выпадает в осадок) + 2KNO3 (нитрат калия); K2CrO4 (калия хромат)+ Hg2(NO3)2 (нитрат ртути) = Hg2CrO4 (хромат ртути, выпадает в осадок) + 2KNO3 (нитрат калия).
Видео:8 класс. Составление уравнений химических реакций.Скачать

Физические свойства хромата калия:
- Плотность составляет 2,732 г/см3.
- Хромат калия плавится при температуре 968,3°С. При температуре 668 градусов переходит в красную гексагональную фазу — приобретает другую окраску — красную. Однако при охлаждении опять становится желтым.
- Образует кристаллы желтого цвета ромбической системы.
- Принадлежит к пространственной группе Р-nam.
- Относится к парамагнетикам.
- Плохо растворяется в этаноле, растворим в воде. Нерастворим в этиловом и диэтиловом спирте.
- Молярная масса составляет 194,19 г/моль.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Оптические свойства хромата калия
Показатель преломления составляет 1,74.
Видео:Хроматы и дихроматы на ЕГЭ по химии | Химия ЕГЭ | УмскулСкачать

Где применяется калий хромат?
- В кожевенной промышленности применяется в качестве дубителя. При крашении тканей используется как протрава.
- Используется как один из компонентов состава электролитов специального химического обезжиривания.
- В качестве отбеливателя для воска и масла.
- В органическом синтезе как окислитель, например, при производстве красителей.
- Также хромовокислый калий используется для приготовления раствором оксидирования серебра электрохимического и для пассирования изделий из сплавов меди и серебра.
- В медицине применяется как гомеопатическое средство.
- В лабораториях для мытья посуды используется смесь равных объемов концентрированной кислоты серной и раствора K2Cr2O7, насыщенного предварительно на холоде.
Видео:Подготовка к ЕГЭ по химии. Цветные переходы соединений хромаСкачать

Калий дихромат (техническое название — хромпик)
Представляет собой кристаллы красно-оранжевого цвета. Не образует кристаллогидратов, обладает плотностью 2,684 грамм на кубический сантиметр, плавится при температуре 397 градусов. При дальнейшем нагревании разлагается. Растворимость в воде при 20 градусах равна 12,48 грамм соли на 100 грамм воды. Дихромат калия получил широкое применение как окислитель в пиротехнике, спичечной промышленности и в хромаметрии как реагент.
📸 Видео
Опыты по химии. Окислительные свойства дихромата калияСкачать

Хромат Индия(3) - In2(CrO4)3. Реакция Хромата Калия и Нитрата Индия(3). Реакция KCrO4 и In(NO3)3.Скачать


