- Реакция термического разложения гидроксида алюминия
- Реакция взаимодействия молибдена и азотной кислоты
- Реакция термического разложения тетрайодида кремния
- Реакция взаимодействия гидроксида рубидия и хлората натрия
- Выбрать язык
- Популярные записи
- Предупреждение.
- Гидроксид алюминия: получение и свойства
- Гидроксид алюминия
- Способы получения
- Химические свойства
- Гидроксид алюминия
- Содержание
- Получение
- Физические свойства
- Химические свойства
- Безопасность
- Применение
- 🌟 Видео
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакция термического разложения гидроксида алюминия
Уравнение реакции термического разложения гидроксида алюминия:
Реакция термического разложения гидроксида алюминия.
В результате реакции образуются оксид алюминия и вода.
Реакция протекает при условии: при температуре выше 575 °C.
Формула поиска по сайту: 2Al(OH)3 → Al2O3 + 3H2O.
Реакция взаимодействия молибдена и азотной кислоты
Реакция термического разложения тетрайодида кремния
Реакция взаимодействия гидроксида рубидия и хлората натрия
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гидроксид алюминия: получение и свойства
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Гидроксид алюминия
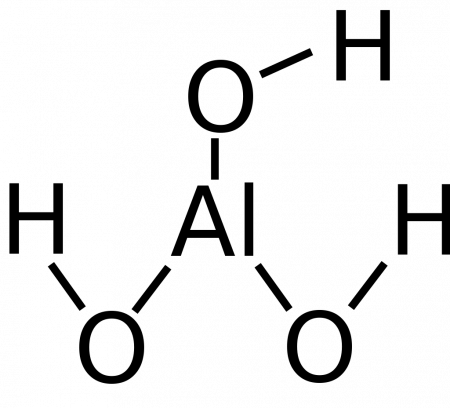
Гидроксид алюминия — вещество с формулой Al(OH)3 (а также H3AlO3) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Безопасность
- 4.1 ЛД50
- 5 Применение
Видео:Химия 8 класс: Реакции разложенияСкачать

Получение
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
AlCl3 + 3 NaOH ⟶ Al(OH)3 ↓ + 3 NaCl
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с растворами карбонатов щелочных металлов:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Физические свойства
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- кислотами
Al(OH)3 + 3 HCl ⟶ AlCl3 + 3 H2O Al(OH)3 + 3 HNO3 ⟶ Al(NO3)3 + 3 H2O
- щелочами
В концентрированном растворе гидроксида натрия: Al(OH)3 + NaOH ⟶ Na[Al(OH)4] При сплавлении твёрдых реагентов: Al(OH)3 + NaOH → 1000oC NaAlO2 + 2 H2O
При нагревании разлагается:
С растворами аммиака не реагирует.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Безопасность
>5000 мг/кг (крысы, перорально).
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Применение
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества.
В медицине, в качестве антацидного средства, в качестве адъюванта при изготовлении вакцин.
В качестве абразивного компонента зубной пасты.
В качестве антипирена (подавителя горения) в пластиках и других материалах.
После обработки до окислов применяется в качестве носителя для катализаторов.
🌟 Видео
Качественные реакции с гидроксидами Cu(OH)2, Fe(OH)3, Fe(OH)2, Al(OH)3, Mg(OH)2, NH4OH, Ag2OСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Реакции разложения. Как понять?Скачать

Реакции разложенияСкачать

Типы химических реакций. 2 часть. 8 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать