Реакция Кучерова (гидратация алкинов) – гидратация ацетилена с образованием ацетальдегида и гомологов ацетилена с образованием кетонов в присутствии солей ртути в качестве катализатора.
Реакция гидратации ацетилена (присоединение воды) была открыта в 1881 г. русским ученым М.Г. Кучеровым, который пытался получить непредельный спирт (виниловый), а затем его полимеризовать. Вместо ожидаемого спирта Кучеров выделил легкокипящую жидкость с характерным запахом – уксусный альдегид.
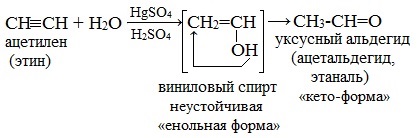
Реакция идет в присутствии солей ртути (обычно HgSO4) в серной кислоте и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
На первой стадии образуются енолы (соединения, в молекулах которых гидроксогруппы соединены с атомом углерода при двойной связи).
Т.к. образующийся на промежуточном этапе виниловый спирт неустойчив, то происходит перегруппировка в термодинамически белее стабильную изомерную структуру – уксусный альдегид. Эта перегруппировка получила название перегруппировка Эльтекова-Эрленмейера.
Реакция имеет большое практическое значение, т. к. уксусный альдегид применяется в технике для получения уксусной кислоты и этилового спирта.
При гидратации гомологов ацетилена образуются кетоны, т.к. присоединение воды по тройной связи происходит в соответствии с правилом Марковникова, и группа -ОН оказывается не у концевого, а у центрального углеродного атома:
- РЕАКЦИЯ КУЧЕРОВА
- Механизм реакции Кучерова для ацетилена
- Механизм реакции Кучерова для гомологов ацетилена
- Этанол: химические свойства и получение
- Строение этанола
- Водородные связи и физические свойства спиртов
- Изомерия спиртов
- Структурная изомерия
- Химические свойства этанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление этанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование этанола
- Получение этанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Получение этанола спиртовым брожением глюкозы
- 🎥 Видео
Видео:Механизм реакции гидратации алкинов (реакция Кучерова).Скачать

РЕАКЦИЯ КУЧЕРОВА
Реакция Кучерова для ацетилена (1881 г) стала основой промышленного получения уксусного альдегида как исходного сырья в синтезе многих органических соединений.
Кучеров Михаил Григорьевич (1850 – 1911) – российский химик-органик, внесший значительный вклад в развитие органического синтеза.
Взаимодействие ацетилена с водой (гидратация) приводит к образованию уксусного альдегида (ацетальдегида):
Обязательным условием протекания реакции является присутствие в качестве катализатора раствора (5%) соли ртути (II) в сернокислой (10%) среде. Катализаторами могут быть также соли Au + , Cu + , Ag + и Ru 3+ . Однако доказана лучшая эффективность солей Hg 2+ (чаще HgSO4).
Механизм реакции Кучерова для ацетилена
Несмотря на кажущуюся простоту процесса, механизм его до сих пор не совсем ясен.
Однако достоверно известно, что одной из промежуточных стадий является образование неустойчивых непредельных спиртов (енолей). Их молекулы содержат гидроксильную группу –ОН у атома углерода с двойной связью.
Например, реакция Кучерова для ацетилена проходит следующим образом:
Механизм реакции Кучерова для гомологов ацетилена
При гидратации гомологов ацетилена образуются не альдегиды, а кетоны . Причем присоединение воды происходит по правилу Марковникова:
Алкины ряда R ̶ C≡CH при гидратации всегда образуют метилкетоны: R ̶ C(O) ̶ CH3. Реакция получения ацетона (диметилкетона) как раз является таким примером.
Алкины ряда R1 ̶ C≡C ̶ R2 при гидратации в зависимости от строения R1 и R2 могут давать смесь кетонов с явным преобладанием одного из них:
Как определить, какой кетон будет преобладать?
Молекула 4-метилпентина-2 содержит третичный атом углерода. Ближний к нему атом углерода с тройной связью находится в α-положении к нему, следующий – в β-положении. Образование карбонильной группы, характерной для кетонов, происходит в основном у углерода в α-положении.
Еще пример:
Итак, реакция Кучерова для ацетилена приводит к образованию ацетальдегида; реакция Кучерова для гомологов ацетилена приводит к образованию кетонов.
Видео:54. Реакция КучероваСкачать

Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Видео:Реакция КучероваСкачать

Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Видео:7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать

Изомерия спиртов
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Видео:Уравнивание реакций горения углеводородовСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
Видео:8 класс. Составление уравнений химических реакций.Скачать

4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Получение этанола
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
Видео:10 класс - Химия - Именные реакции в органической химииСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Видео:Альдегиды. Урок 19. Химия 10 классСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
🎥 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

3.2. Алкины: Способы полученияСкачать