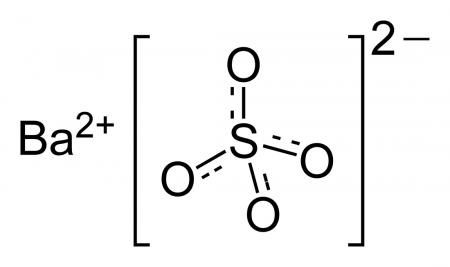
Сульфат бария BaSO4 — соль металла бария и серной кислоты. Белый, тяжелый, при сильном нагревании плавится и разлагается.
Не растворяется в воде. Малореакционноспособный.
Относительная молекулярная масса Mr = 233,39; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 1580º C (разлагается).
Видео:Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Способ получения
1. В результате взаимодействия хлорида бария и сульфата натрия образуется сульфат бария и хлорид натрия:
2. Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства
1. Сульфат бария реагирует с простыми веществами :
1.1. Сульфат бария взаимодействует с углеродом (коксом) при 1100 — 1200º С и образует сульфид бария, угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
1.2. Хлорид бария вступает в реакцию с водородом при 900 — 1000º С с образованием сульфида бария и воды:
2. Сульфат бария вступает в реакцию со сложными веществами :
2.1. Сульфат бария взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид бария и углекислый газ:
BaSO4 + 4CO = BaS + 4CO2
2.2. Сульфат бария может реагировать с концентрированной серной кислотой. При этом сульфат бария образует гидросульфат бария:
3. Сульфат бария разлагается при температуре выше 1580º С, образуя оксид бария, оксид серы (IV) и кислород:
Видео:Соединения серы. 9 класс.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Сульфат бария
Сульфат бария (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4. Видео:Качественная реакция на сульфит- и сульфат-ионыСкачать  Содержание
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  ПолучениеСульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами: Последняя реакция используется также для получения пероксида водорода. В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и декантируется. Видео:Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать  СвойстваКристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой. Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  Химические свойстваСульфат бария нерастворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов. Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария: При прокаливании с углём или коксом сульфат восстанавливается до сульфида: BaSO4 + 4C → BaS + 4CO При температурах выше 1600 °C разлагается: 2BaSO4 → 2BaO + 2SO2 + O2 Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  ТоксичностьСульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества. Видео:Сера. Сероводород. СульфидыСкачать  ПрименениеАналитическая химияВ аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе. Рентгеноконтрастное веществоЧасто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 %. Пигмент-наполнительСульфат бария является одной из составляющих смесей, используемых в качестве белых пигментов:
Употребляется как клеевая краска, так как нерастворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сероводорода. Другие примененияСульфат бария используется для различных промышленных целей:
🔍 ВидеоТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  Качественная реакция на сульфат- и карбонат-ионы.Скачать  ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать  ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  8 класс. Массовая доля растворенного вещества. Решение задач.Скачать  СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать  Опыты по химии. Качественная реакция на сульфат-ионСкачать  Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать  Диоксид серы Сернистая кислота СульфитыСкачать  КАК УЧИТЬ ХИМИЮ ЭЛЕМЕНТОВ? | Разбираем химические свойства водорода, галогенов, кислорода и серыСкачать  | |||||||||||||||||||||||||||||||||||||||||||||||