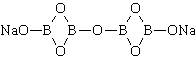Na2B4O7 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Na + + B4O7 2- + HOH ⇄ Na + + HB4O7 — + Na + + OH —
Сокращенное (краткое) ионное уравнение
B4O7 2- + HOH ⇄ HB4O7 — + OH —
Видео:Реакция Тетрабората Натрия С Солями Щелочноземельных Металлов. Реакция Na2B4O7 с MgCl2, CaCl2.Скачать

Тетраборат натрия
| Тетраборат натрия | |
|---|---|
 | |
 | |
| Традиционные названия | бура, боракс |
| Хим. формула | Na2B4O7 |
| Состояние | кристаллы |
| Молярная масса | 201,22 г/моль |
| Плотность | 2,37 ± 0,01 г/см³ |
| Т. плав. | 664 °C (β-модификация) 710 °C (γ-модификация) |
| Т. кип. | 1575 °C |
| Т. разл. | 2867 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 3,2 г/100 мл (25 °C) 10,5 г/100 мл (50 °C) |
| Растворимость в этаноле | 0,05 г/100 мл |
| Растворимость в ацетоне | 0,006 г/100 мл |
| ГОСТ | ГОСТ 8429-77 |
| PubChem | 10219853 |
| SMILES | |
| Кодекс Алиментариус | E285 |
| RTECS | VZ2275000 и ED4588000 |
| ChemSpider | 8395345 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Тетраборат натрия («бура», «боракс» (от лат. borax )) — неорганическое соединение, натриевая соль борной кислоты с химической формулой Na2B4O7, наиболее распространённое и используемое соединение бора, образует несколько кристаллогидратов, широко применяется в промышленности.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
- 5 Нахождение в природе
Видео:Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Физические свойства
Имеет две метастабильные модификации: β и γ. β-модификация является ромбической с температурой плавления 664 °C, γ-модификация — моноклинная с температурой плавления 710 °C. Температура кипения — 1575 °C. Расплав застывает в стекловидную массу с плотностью 2,36 г/см 3 .
Видео:Бор - B. Получение Бора. Реакция Лития и Тетрабората Натрия. Реакция Na2B4O7 и Li.Скачать

Химические свойства
Растворимость в воде составляет 3,2 г / 100 мл (25 °C), 10,5 г / 100 мл (50 °C), в этаноле — 0,05 г / 100 г (25 °C), ацетоне — 0,006 г / 100 г (25 °C), не растворим в диэтиловом эфире и глицерине. Реагирует с метанолом при растворении с образованием бороорганических соединений.
Образует несколько кристаллогидратов с разным содержанием воды. Эти кристаллогидраты и безводный тетраборат натрия Na2B4O7 обычно называют «бура». Примеры кристаллогидратов:
Однако наиболее часто «бурой» называют декагидрат Na2B4O7·10H2O. Эта соль представляет собой прозрачные кристаллы с молярной массой 381,43 г/моль, имеющие хорошую растворимость в тёплой воде. При нагревании свыше 400 °C полностью теряет кристаллизационную воду.
Так как тетраборат натрия является солью слабой кислоты и сильного основания, в воде гидролизуется. Водный раствор тетрабората натрия имеет щелочную реакцию.
Взаимодействует с сильными кислотами, образуя соответствующую соль и борную кислоту:
Многие соли металлов борной кислоты нерастворимы в воде и при взаимодействии в растворе их растворимых солей с тетраборатом натрия образующиеся бораты выпадают в осадок. На этом основано применение буры для «умягчения» воды:
С оксидами многих переходных металлов бура при сплавлении образует разнообразно окрашенные соединения — бораты «перлы буры». По окраске перлов можно судить о качественном химическом составе пробы.
Окрашивает пламя горелки в зелёный цвет (характерная реакция на соединения бора).
Видео:Получение ТРИФТОРИДА БОРА. Реакция Фторида Натрия, Тетрабората Натрия и Серной Кислоты.Скачать

Получение
Десятиводную соль Na2B4O7·10H2O получают из природных минералов, например, буры или кернита, осуществляя их перекристаллизацию. Также для этой цели применяют химическое взаимодействие некоторых природных боратов (ашарита и улексита) с карбонатом или гидрокарбонатом натрия.
Может быть получен реакцией карбоната натрия и борной кислоты при нагреве, пропусканием углекислого газа через растворметабората натрия.
Видео:Качественная реакция на хлорид, бромид, йодид ион.Скачать

Применение
Тетраборат натрия применяется:
- как сырьё для получения борной кислоты и различных соединений бора;
- в производстве эмалей, глазурей, оптических и цветных стёкол, различных керамик;
- при пайке и плавке металлов в составе флюса;
- в бумажной и фармацевтической промышленности;
- в производстве строительных материалов как компонент антисептика для изготовления целлюлозного утеплителя «Эковата»
- как дезинфицирующее и консервирующее средство;
- для приготовления буферных растворов;
- в аналитической химии:
- как стандартное вещество для определения концентрации растворов кислот;
- для качественного определения оксидов металлов (по цвету перлов);
- в фотографии — в составе медленно действующих проявителей в качестве слабого ускоряющего вещества;
- как компонент моющих средств;
- как компонент косметики;
- как инсектицид в отравленных приманках для уничтожения тараканов.
В 1977 году мировое производство тетрабората натрия составило 1,5 млн тонн.
Видео:Метаборат Кобальта - Co(BO2)2. Реакция Оксида Кобальта(2) и Тетрабората Натрия.Реакция CoO и Na2B4O7Скачать

Нахождение в природе
Существуют многочисленные минералы, содержащие тетраборат натрия. К ним относятся:
- бура (боракс, тинкал) — минерал состава Na2B4O7·10H2O — декагидрат тетрабората натрия;
- кернит — тетрагидрат тетрабората натрия — Na2B4O7·4H2O;
- многочисленные минералы класса боратов, в которых помимо оксидов натрия и бора содержатся другие металлы, — кальций, магний, железо и др.;
- кристаллогидраты тетрабората натрия выпадают в осадок при пересыхании некоторых бессточных, сезонно пересыхающих солёных озёр, например, в озере Серлс, расположенном в пустыне Мохаве в США, и некоторых озёр в Турции.
Видео:Лизун. Реакция клея и тетрабората натрия.Скачать

Уравнения реакции на натрия тетраборат
Описание. Белые прозрачные легковыветривающиеся кристаллы или белый кристаллический порошок. Водный раствор имеет щелочную реакцию. Реакция глицериновых растворов кислая.
Получение. Минерал – бура; действие горячего раствора карбоната натрия на борокальциты или борную кислоту:
Растворимость. Растворим в воде, практически нерастворим в спирте, легко растворим в глицерине.
Подлинность. Реакция с куркумином (ГФ Х) Куркумовая бумага окрашивается в розовый или буровато-красный цвет ( SHAPE * MERGEFORMAT 
Примеси. Допустимые: мышьяк, хлориды, сульфаты, железо.
1. Прямая ацидиметрия (ГФ Х):
Титрант – HCl , индикатор – метиловый оранжевый:
f экв ( Na 2 B 4 O 7 )=1/2, 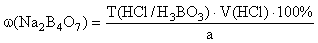
Хранение. В хорошо укупоренной таре.
Применение. Детоксицирующее и десенсибилизирующее средство (внутрь и внутривенно); инсектицид (наружно).
💡 Видео
25. Схема реакции и химическое уравнениеСкачать

Опыты по химии. Реакция нейтрализацииСкачать

Натрия тетраборат раствор инструкция по применению препарата: Показания, как применять, обзорСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Реакция большого количества натрия с водой.Скачать

Реакция Хлората Натрия и Соляной Кислоты. Реакция NaClO3 и HCl. Выделение Хлора.Скачать

Гексафтороиндат(III) Натрия - Na3[InF6]. Реакция Нитрат Индия(3) и Фторида Натрия.Скачать
![Гексафтороиндат(III) Натрия - Na3[InF6]. Реакция Нитрат Индия(3) и Фторида Натрия.](https://i.ytimg.com/vi/9Hd9Ivthn70/0.jpg)
Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Как написать уравнения реакции полимеризации?Скачать

Реакция Йода И Гидроксида Натрия. Реакция I2 и NaOH.Скачать

Фтористый Хромил - CrO2F2. Реакция Дихромата Калия, Фторида Натрия и Серной кислоты.Скачать