- 7. Химические свойства соединений марганца с точки зрения изменения степеней окисления
- Марганец, цинк и серебро
- Марганец
- Содержание
- История открытия
- Распространённость в природе
- Минералы марганца
- Получение
- Физические свойства
- Химические свойства
- Изотопы
- Применение в промышленности
- Применение в металлургии
- Применение в химии
- Определение методами химического анализа
- Биологическая роль и содержание в живых организмах
- Токсичность
- Месторождение
- 🔍 Видео
Видео:Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

7. Химические свойства соединений марганца с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут .
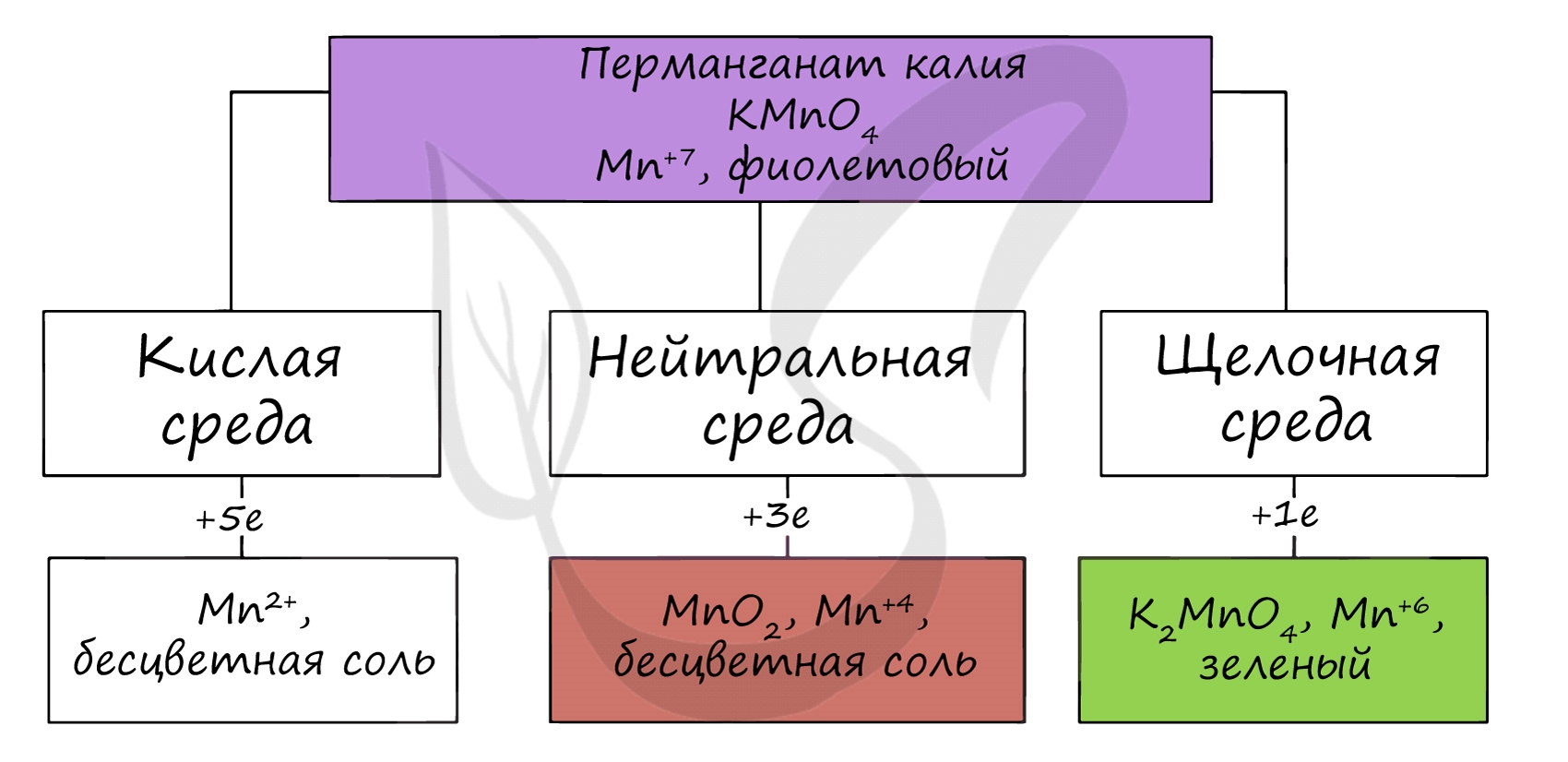
В кислой среде соединения марганца, как правило, восстанавливаются до Mn +2 , образуя соли соответствующих кислот:
Примеры реакций соединений с Mn +7 :
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 16HBr → 2MnBr2 + 5Br2 + 2KBr + 8H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + 10CO2 + K2SO4 + 8H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2HMnO4 + 5SO2 + 2H2O → 2MnSO4 + 3H2SO4
2KMnO4 + 5Na2O2 + 8H2SO4 → 2MnSO4 + O2 + 5Na2SO4 + K2SO4 + 8H2O
10KMnO4 + 10KHS + 11H2SO4 → 4MnSO4 + 10S + 7K2SO4 + 16H2O
2KMnO4 + 5K2S + 8H2SO4 → 2MnSO4 + 5S + 6K2SO4 + 8H2O
2KMnO4 + 5H2S + 3H2SO4 → 2MnSO4 + 5S + K2SO4 + 8H2O
2KMnO4 + 10KBr + 8H2SO4 → 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
8KMnO4 + 5PH3 + 12H2SO4 → 8MnSO4 + 5H3PO4 + 4K2SO4 + 12H2O
6KMnO4 + 10NH3 + 9H2SO4 → 6MnSO4 + 5N2 + 3K2SO4 + 12H2O
Примеры реакций соединений с Mn +4 :
MnO2 + HCl → MnCl2 + Cl2 + H2O
MnO2 + 2KI + 2H2SO4 → MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + 2KBr + 2H2SO4 → MnSO4 + Br2 + K2SO4 + 2H2O
MnO2 + 2FeSO4 + 2H2SO4 → MnSO4 + Fe2(SO4)3 + 2H2O
Примеры реакций соединений с Mn +6 :
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
В щелочной среде, как правило, реакции протекают с образованием соединений Mn +6 , т.е. манганат-иона:
Примеры реакций соединений с Mn +7 :
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
2KMnO4 + NaNO2 + 2KOH → 2K2MnO4 + NaNO3 + H2O
KMnO4 + FeCl2 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
6KMnO4 + Cr2(SO4)3 + 16KOH → 6K2MnO4 + 2K2CrO4 + 3K2SO4 + 8H2O
4KMnO4 + 8KOH → 4K2MnO4 + 2O2 + 4H2O
6NaMnO4 + 2NH3 + 6NaOH → 6Na2MnO4 + N2 + 6H2O
8KMnO4 + PH3 + 11KOH → 8K2MnO4 + K3PO4 + 7H2O
Примеры реакций соединений с Mn +2 :
3MnSO4 + 2O3 + 12KOH → 3K2MnO4 + 3K2SO4 + 6H2O
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
3MnSO4 + 3KClO3 + 12KOH → 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
3MnO + 2KClO3 + 6KOH → 3K2MnO4 + 2KCl + 3H2O
Примеры реакций соединений с Mn +4 в щелочной среде:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
MnO2 + O2 + 4KOH → 2K2MnO4 + 2H2O
В нейтральной среде соединения Mn +7 , как правило, восстанавливаются до Mn +4 , образуя оксид марганца (IV):
Примеры реакций соединений с Mn +7 :
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
2KMnO4 + 3KNO2 + H2O → 2MnO2 + 3KNO3 + 2KOH
2KMnO4 + 3K2S + 4H2O → 2MnO2 + 3S + 8KOH
Реакции с H2S и NH3 протекают аналогично нейтральной среде:
2HMnO4 + 3H2S → 2MnO2+ 3S + 4H2O
2NaMnO4 + 2NH3 → 2MnO2 + N2 + 2NaOH + 2H2O
2KMnO4 + 2NH3×H2O → 2MnO2 + N2 + 2KOH + 4H2O
Примеры реакций соединений с Mn +2 :
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4.
Видео:Марганец - Металл, ЗАЖИВЛЯЮЩИЙ РАНЫ!Скачать

Марганец, цинк и серебро
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит
Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
- Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды.
Реакции с кислотами
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.
Для цинка характерна постоянная степень окисления +2.
Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
- Реакции с неметаллами (и аммиаком 🙂
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Реакции с кислотами
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
- Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Реакции с кислотами
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
С органическими веществами
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
Видео:Химические свойства марганца. Часть 1.Скачать

Марганец
| Марганец | |
|---|---|
| Твёрдый, хрупкий металл серебристо-белого цвета | |
 |
(молярная масса)
(первый электрон)
Марганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn (лат. Manganum , манганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре). Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
Видео:ЕГЭ Химия | ХРОМ. МАРГАНЕЦСкачать

Содержание
- 1 История открытия
- 2 Распространённость в природе
- 2.1 Минералы марганца
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 6 Изотопы
- 7 Применение в промышленности
- 7.1 Применение в металлургии
- 7.2 Применение в химии
- 8 Определение методами химического анализа
- 9 Биологическая роль и содержание в живых организмах
- 10 Токсичность
- 11 Месторождение
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

История открытия
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 году шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от нем. Manganerz — марганцевая руда).
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Распространённость в природе
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Массовая доля марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10 −7 —10 −6 %), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железомарганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Минералы марганца
- пиролюзит MnO2·xH2O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
- гаусманит (Mn II Mn2 III )O4;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
- псиломелан mMnO·MnO2·nH2O (45-60 % марганца);
- пурпурит Mn 3+ [PO4], (36,65 % марганца).
Видео:Химические свойства марганца. Часть 2.Скачать
Получение
- Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: 4MnO2 ⟶ 2Mn2O3 + O2 Mn2O3 + 2Al ⟶ 2Mn + Al2O3
- Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (
80 % Mn).
Видео:ОВР с соединениями марганца, хрома железа и меди | Химия с Юлией ВишневскойСкачать

Физические свойства
Некоторые свойства приведены в таблице. Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент теплового расширения: 0,000022 K −1 (при 0 °C)
- Электропроводность: 0,00695⋅10 6 Ом −1 ·см −1
- Теплопроводность: 0,0782 Вт/(см·K)
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость:
- по шкале Бринелля: Мн/м²
- по шкале Мооса: 4
- Давление паров: 121 Па при 1244 °C
- Молярный объём: 7,35 см³/моль
Видео:№ 315. Неорганическая химия. Тема 39. Марганец и его соединения. Часть 3. Окисление иона марганцаСкачать

Химические свойства
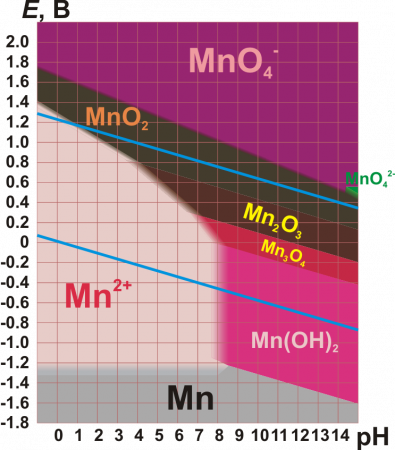
| Окисленная форма | Восстановленная форма | Среда | E 0 , В |
|---|---|---|---|
| Mn 2+ | Mn | H + | −1,186 |
| Mn 3+ | Mn 2+ | H + | +1,51 |
| MnO2 | Mn 3+ | H + | +0,95 |
| MnO2 | Mn 2+ | H + | +1,23 |
| MnO2 | Mn(OH)2 | OH − | −0,05 |
| MnO4 2− | MnO2 | H + | +2,26 |
| MnO4 2− | MnO2 | OH − | +0,62 |
| MnO4 − | MnO4 2− | OH − | +0,56 |
| MnO4 − | H2MnO4 | H + | +1,22 |
| MnO4 − | MnO2 | H + | +1,69 |
| MnO4 − | MnO2 | OH − | +0,60 |
| MnO4 − | Mn 2+ | H + | +1,51 |
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при нагревании разлагает воду, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
С соляной и серной кислотами реагирует по уравнению
С концентрированной серной кислотой реакция идёт по уравнению
С разбавленной азотной кислотой реакция идёт по уравнению
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях — жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца IV (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4 − , и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия)
Под действием сильных окислителей ион Mn 2+ переходит в ион MnO4 − :
Эта реакция используется для качественного определения Mn 2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа». В нейтральных или кислых водных растворах ион Mn 2+ образует окрашенный в бледно-розовый цвет аквакомплекс [Mn(H2O)6] 2+ .
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn2(CO)10.
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF3, NO, N2, P(C5H5)3).
Видео:Диоксид Марганца - ПОЛУЧЕНИЕСкачать

Изотопы
Марганец является моноизотопным элементом — в природе существует только один устойчивый изотоп 55 Mn. Все другие изотопы марганца нестабильны и радиоактивны, они получены искусственно. Известны 25 радиоактивных изотопов марганца, имеющие массовое число А в диапазоне от 44 до 70. Наиболее стабильными из них являются 53 Mn (период полураспада T1/2 = 3,7 млн лет ), 54 Mn ( T1/2 = 312,3 суток ) и 52 Mn ( T1/2 = 5,591 суток ). Преобладающим каналом распада лёгких изотопов марганца ( А ) является электронный захват (и иногда конкурирующий с ним позитронный распад) в соответствующие изотопы хрома. У тяжёлых изотопов ( А > 55 ) основным каналом распада является β − -распад в соответствующие изотопы железа. Известны также 7 изомеров (метастабильных возбуждённых состояний) с периодами полураспада более 100 нс .
Видео:СОЕДИНЕНИЯ МАРГАНЦА IV и VII | Таисия Фламель | ВебиумСкачать

Применение в промышленности
Применение в металлургии
Марганец в виде ферромарганца применяется для раскисления стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12—13 % Mn в сталь (так называемая сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (т. н. «наклёп»). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
В 1920—1940-х годах применение марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале «Сталь» возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определённого содержания марганца в процессе мартеновской плавки, в которой вместе с В. И. Явойским и В. И. Баптизманским принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Применение в химии
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением.
Теллурид марганца — перспективный термоэлектрический материал (термо-ЭДС 500 мкВ/К).
Видео:Все реакции по теме «Хром» для ЕГЭ по химии | Екатерина СтрогановаСкачать

Определение методами химического анализа
Марганец принадлежит к пятой аналитической группе катионов.
Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn 2+ , следующие:
1. Едкие щёлочи с солями марганца (II) дают белый осадок гидроксида марганца (II):
Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца (II) до тёмно-бурого соединения марганца (IV):
Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn 2+ до MnO4 − с образованием марганцевой кислоты малинового цвета:
Эта реакция даёт отрицательный результат в присутствии восстановителей, например хлороводородной кислоты и её солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой. При больших количествах марганца провести эту реакцию не удаётся, так как избыток ионов Mn 2+ восстанавливает образующуюся марганцевую кислоту HMnO4 до MnO(OH)2, и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Mn 2+ в MnO4 − могут быть использованы другие окислители, например, персульфат аммония (NH4)2S2O8 в присутствии катализатора — ионов Ag + или висмутат натрия NaBiO3:
Выполнение реакции. В пробирку вносят стеклянным шпателем немного PbO2, а затем 5 капель концентрированной азотной кислоты HNO3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца II MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 н. HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S осаждает из раствора солей марганца сульфид марганца II, окрашенный в телесный цвет:
Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Выполнение реакции. В пробирку помещают 2 капли раствора соли марганца (II) и добавляют 2 капли раствора сульфида аммония.
Видео:№ 313. Неорганическая химия. Тема 39. Марганец и его соединения. Часть 1. Физические свойстваСкачать

Биологическая роль и содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также лёгкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект.
Видео:Химические свойства марганцаСкачать

Токсичность
Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза для человека не определена.
При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга.
Сообщений о случаях отравления марганцем у людей, вызванных приёмом пищи с высоким содержанием марганца, нет. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве. Оно проявляется в виде тяжёлых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона.
Чтобы развилась клиническая картина хронического отравления марганцем, обычно требуется несколько лет. Она характеризуется достаточно медленным нарастанием патологических изменений в организме, вызываемых повышенным содержанием марганца в окружающей среде (в частности, распространение эндемического зоба, не связанного с дефицитом йода).
Видео:Получение оксида марганца VII. Химический опытСкачать

Месторождение
- Усинское месторождение марганца
- Марганец (Mn)
- 2-Этилгексаноат марганца (Mn(C8H15O2)2)
- Аллил-тетракарбонилмарганец (Mn(C3H5)(CO)4)
- Антимонид димарганца (Mn2Sb) Сурмянистый марганец
- Антимонид марганца (MnSb) Марганец сурмянистый
- Арсенид димарганца (Mn2As) Мышьяковистый марганец
- Арсенид марганца (MnAs) Марганец мышьяковистый
- Ацетат марганца II (Mn(CH3COO)2) Марганец уксуснокислый
- Ацетат марганца III (Mn(CH3COO)3) Уксуснокислый марганец
- Ацетилацетонат марганца III ([Mn(C5H7O2)3]) Ацетилацетонат марганца
- Бензоат марганца (Mn(C7H5O2)2) Марганец бензойнокислый
- Борид димарганца (Mn2B) Бористый марганец
- Борид марганца (MnB) Марганец бористый
- Бромид марганца II (MnBr2) Марганец бромистый
- Бромопентакарбонилмарганец (Mn(CO)5Br)
- Вольфрамат марганца (MnWO4) Марганец вольфрамовокислый
- Гексацианоферрат II марганца (Mn2[Fe(CN)6])
- Гидридопентакарбонилмарганец (Mn(CO)5H)
- Гексакарбонил марганца (Mn(CO)6)
- Гидроксид марганца II (Mn(OH)2) Гидроокись марганца
- Гидроортофосфат марганца II (MnHPO4) Фосфорнокислый марганец кислый
- Гипофосфит марганца (Mn(PH2O2)2) Фосфинат марганца
- Декакарбонилдимарганец (Mn2(CO)10) CORM-1
- Диборид марганца (MnB2)
- Дигидроортофосфат марганца II (Mn(H2PO4)2) Марганец фосфорнокислый кислый
- Динитрид пентамарганца (Mn5N2)
- Динитрид тримарганца (Mn3N2)
- Диселенид марганца (MnSe2) Селенистый марганец
- Дисилицид марганца (MnSi2) Кремнистый марганец
- Дистаннид марганца (MnSn2)
- Дитионат марганца (MnS2O6) Марганец дитионовокислый
- Дифосфид тримарганца (Mn3P2) Фосфористый марганец
- Йодид марганца II (MnI2) Марганец йодистый
- Йодопентакарбонилмарганец (Mn(CO)5I)
- Карбид тримарганца (Mn3C) Углеродистый марганец
- Карбиды марганца
- Карбонат марганца II (MnCO3) Марганец углекислый
- Лактат марганца (Mn(C3H5O3)2) Марганец молочнокислый
- Линолеат марганца (MnC36H62O4) Марганец линолевокислый
- Манганаты
- Манганиты
- Манганоцен (Mn(C5H5)2)
- Мангафодипир (C22H32MnN4O14P2+2)
- Марганцовая кислота (HMnO4)
- Марганцовистая кислота (H2MnO4)
- Метагидроксид марганца (MnO(OH)) Гидроокись марганца III
- Метасиликат марганца II (MnSiO3) Кремнекислый марганец
- Метатитанат марганца (MnTiO3)
- Метафосфат марганца III (Mn(PO3)3)
- Молибдат марганца (MnMoO4) Марганец молибденовокислый
- Нитрат марганца (Mn(NO3)2) Марганец азотнокислый
- Нитрид димарганца (Mn2N) Марганец азотистый
- Нитрид тетрамарганца (Mn4N) Азотистый марганец
- Нитрозилпентакарбонилмарганец (Mn(CO)4NO)
- Оксалат марганца (MnC2O4) Марганец щавелевокислый
- Оксид марганца II (MnO) Окись марганца
- Оксид марганца II,III (Mn3O4)
- Оксид марганца II,IV (Mn5O8)
- Оксид марганца III (Mn2O3)
- Оксид марганца IV (MnO2)
- Оксид марганца VI (MnO3)
- Оксид марганца VII (Mn2O7)
- Оксиды марганца
- Олеат марганца (Mn(C18H33O2)2) Марганец олеиновокислый
- Ортосиликат марганца II (Mn2SiO4) Марганец кремнекислый
- Ортофосфат марганца II (Mn3(PO4)2) Марганец фосфорнокислый
- Перхлорат марганца (Mn(ClO4)2) Марганец хлорнокислый
- Пирофосфат марганца (Mn2P2O7)
- Резинат марганца (MnC40H58O4) Марганец смолянокислый
- Селенат марганца (MnSeO4) Марганец селеновокислый
- Селенид марганца (MnSe) Марганец селенистый
- Селенит марганца (MnSeO3) Марганец селенистокислый
- Силицид димарганца (Mn2Si)
- Силицид марганца (MnSi) Марганец кремнистый
- Силицид тримарганца (Mn3Si)
- Станнид димарганца (Mn2Sn)
- Станнид тримарганца (Mn3Sn)
- Сульфат марганца II (MnSO4) Марганец сернокислый
- Сульфат марганца III (Mn2(SO4)3)
- Сульфат марганца IV (Mn(SO4)2) Сернокислый марганец
- Сульфат марганца III-цезия (CsMn(SO4)2) Цезий-марганцовые квасцы
- Сульфид марганца II (MnS) Марганец сернистый
- Сульфид марганца IV (MnS2) Сернистый марганец
- Теллурид марганца (MnTe) Марганец теллуристый
- Тетраборат марганца (MnB4O7) Марганец борнокислый
- Тиоцианат марганца II (Mn(SCN)2) Марганец роданистый
- Формиат марганца (Mn(HCO2)2) Марганец муравьинокислый
- Фосфид димарганца (Mn2P)
- Фосфид марганца (MnP) Марганец фосфористый
- Фосфид тетрамарганца (Mn4P)
- Фосфид тримарганца (Mn3P)
- Фторид марганца II (MnF2) Марганец фтористый
- Фторид марганца III (MnF3)
- Фторид марганца IV (MnF4) Фтористый марганец
- Хлорид марганца II (MnCl2) Магний хлористый
- Хлорид марганца III (MnCl3)
- Хлорид марганца IV (MnCl4) Хлористый марганец
- Цитрат марганца (Mn3(C6H5O7)2) Марганец лимоннокислый
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
🔍 Видео
№ 314. Неорганическая химия. Тема 39. Марганец и его соединения. Часть 2. Соединения марганцаСкачать

6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

23. Химические свойства и способы получения соединений марганца (II)Скачать

РАЗБИРАЕМ ВСЕ ОВР С МАРГАНЦЕМ ЗА 99 минут!Скачать

Реакция Между Перманганатом Калия, Сульфатом Марганца и Серной Кислотой. Сульфат Марганца(4).Скачать