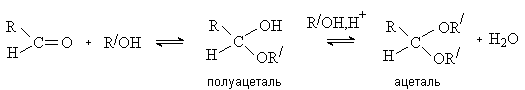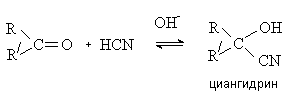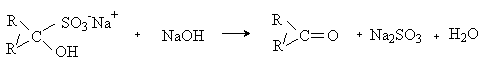Вы будете перенаправлены на Автор24
Альдегиды в щелочной среде вступают в реакции альдольной конденсации (А. Бородин, Ж. Вурц, 1872):
Сначала под действием основного катализатора — гидроксид-аниона или этоксид-аниона $C_2H_5O^-$ из альдегида образуется сопряженный анион — сильный нуклеофил, который атакует электрофильный центр карбонильной группы следующей молекулы альдегида. Полученный в результате такого взаимодействия алкоголятний анион быстро превращается в альдоль.
Так, например, две молекулы пропаналя в реакции с водными растворами гидроксидов при 0-5 $^circ$С образуют 3-гидрокси-2-метилпентаналь с 55-60% выходом, а две молекулы уксусного альдегида дают альдоль с 50%-ным выходом:
Видео:Альдольная конденсацияСкачать

Механизм альдольной конденсации катализируемой основаниями
Механизм реакций альдольной конденсации, катализируемых основаниями, включает три стадии:
На первой стадии образуются енолят-ионы. Равновесные концентрации енолят-ионов очень малы и редко превышают 1-3%, поскольку $pK_a$ альдегидов примерно равны 17-18, а для воды значение $pK_a$ равно 15,7. Присоединение енолят-ионов к карбонильным группам неионизированных молекул альдегидов на второй стадии определяет скорость всего процесса.
Готовые работы на аналогичную тему
Видео:10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать

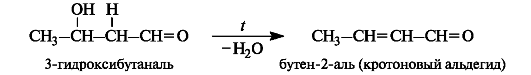
Дегидратация альдолей
Синтезированные альдоли при нагревании, как правило, легко отщепляют воду с образованием ненасыщенных карбонильных соединений. Процесс получения ненасыщенного альдегида или кетона из альдолей называют кротоновой конденсацией, по названию альдегида, впервые полученного таким методом:
Дегидратация альдолей в $alpha, beta$-ненасыщенные альдегиды также катализируется основаниями и протекает с промежуточным образованием енолят-ионов альдолей:
Видео:АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯСкачать

Механизм альдольной конденсации катализируемой кислотами
Альдегиды способны вступать в альдольную конденсацию и в кислой сред, но остановить реакцию на стадии альдолей при этом достаточно трудно, и часто получается продукт кротоновой конденсации.
В кислых средах определяющей скорость всего процесса стадией является присоединение енолов к карбонильным группам.
В отличие от щелочного катализатора, который действует только на метиленовую компонента, при кислотном катализе наблюдается действие как на метиленовый, так и на карбонильный компонент с протонизацией атомов кислорода:
В кислых средах практически невозможно остановить процесс на стадии образования альдолей и конечными продуктами оказываются $alpha, beta$-ненасыщенные альдегиды — продукты их дегидратации.
Для протонованой метиленовой компоненты характерно отщепление $H+$ от группы $OH$ с образованием исходной карбонильной молекулы или от $alpha$-углеродного атома с образованием енола. В еноле же под влиянием $+M$-эффекта атома кислорода и $-I$-эффекта вицильной группы электронная плотность $pi$-связи смещена отгидроксильной группы, в результате чего енол реагирует далее с активированной карбонильной компонентой.
В сильнокислой среде для альдолей обычно характерна дегидратация с образованием оксида мезитила. В условиях реакции оксид мезитила реагирует с последующей молекулой карбонильного соединенния и конечным продуктом, в отличие от реакции в щелочной среде, является форон (в присутствия газообразной кислоты) или мезитилен (в присутствии концентрированной жидкой кислоты).
Видео:Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать  Механизм альдольной конденсации и реакции конницароПрисоединение воды. Альдегиды и кетоны присоединяют воду с Продукт гидратации трихлоруксусного альдегида Присоединение спиртов и Альдегиды присоединяют спирты с образованием полуацеталей. При избытке спирта и в присутствии кислотного катализатора Реакция образования полуацеталя протекает как Процесс образования ацеталя идет как Образование ацеталей – обратимый процесс. В Кетоны в аналогичных условиях кеталей не Тиолы как более сильные нуклеофилы, чем спирты, Присоединение синильной Синильная кислота присоединяется к карбонильным соединением в условиях Реакция имеет препаративное значение и Присоединение бисульфита Альдегиды и метилкетоны присоединяют бисульфит натрия NaHSO3 c образованием бисульфитных производных. Бисульфитные производные карбонильных соединений Механизм альдольной конденсации.При действии основания в карбонильном соединении отщепляется протон из α-положения и образуется карбанион (I), в котором отрицательный заряд делокализован при участии карбонильной группы. Анион (I) представляет собой сильный нуклеофил (на следующей стадии механизма он показан цветом), который присоединяется ко второй (неионизированной) молекуле карбонильного соединения. В результате такого взаимодействия возникает новая связь С-С и образуется промежуточный алкоксид-ион (II). В водной среде этот анион стабилизируется, отщепляя протон от молекулы воды, и превращается в конечный продукт — альдоль. Реакция альдольного присоединения показана на примере пропаналя (цветом выделена молекула, присоединяющаяся к группе С=О другой молекулы); аналогичная реакция приведена на примере ацетона. Продукт конденсации — альдоль — способен к отщеплению воды с образованием α,β-ненасыщенного карбонильного соединения. Обычно это происходит при повышенной температуре. В этом случае реакция в целом называется кротоновой конденсацией. Реакции конденсации могут протекать и в смешанном варианте, с использованием разных карбонильных соединений, причем одно из них может и не содержать СН-кислотного центра, как, например, формальдегид и бензальдегид в следующих реакциях: Альдольная конденсация — обратимая реакция; обратный процесс называется альдольным расщеплением (или ретроальдольной реакцией). Обе реакции происходят во многих биохимических процессах. Реакция Канниццаро Альдегиды, не имеющие в α-положении атомов водорода, при действии концентрированного раствора едкого кали претерпевают диспропорционирование с образованием карбоновых кислот и спиртов. Например, формальдегид превращается в муравьиную кислоту в виде формиата калия (поскольку реакционная среда щелочная) и метиловый спирт. Механизм реакции Канниццаро включает две стадии нуклеофильного присоединения: на первой стадии гидроксид-анион присоединяется по карбонильной группе молекулы формальдегида, а затем от этого аддукта отщепляется атом водорода и вместе со своей парой электронов, т.е. в виде гидрид-аниона присоединяется по карбонильной группе второй молекулы формальдегида. По такому же механизму из бензальдегида образуется смесь бензоата калия и бензилового спирта. Если проводить перекрестную реакцию Канниццаро со смесью какого-либо неенолизующегося альдегида и формальдегида, то формальдегид всегда играет роль восстановителя, т.е. выступает как донор гидрида и окисляется до муравьиной кислоты, например: Дополн: Присоединение спиртов.Спирты при взаимодействии с альдегидами легко образуют полуацетали. Полуацетали обычно не выделяют из-за их неустойчивости. При избытке спирта в кислой среде полуацетали превращаются в ацетали. Применение кислотного катализатора при превращении полуацеталя в ацеталь становится понятным из приведенного ниже механизма реакции. Центральное место в нем занимает образование карбо- катиона (I), стабилизированного за счет участия неподеленной пары электронов соседнего атома кислорода (+M-эффект группы С2Н5О). Реакции образования полуацеталей и ацеталей обратимы, поэтому ацетали и полуацетали легко гидролизуются избытком воды в кислой среде. В щелочной среде полуацетали устойчивы, так как алкоксидион является более трудно уходящей группой, чем гидроксид-ион. Образование ацеталей часто используется как временная защита альдегидной группы. Присоединение воды.Присоединение воды к карбонильной группе — гидратация — обратимая реакция. Степень гидратации альдегида или кетона в водном растворе зависит от строения субстрата. Продукт гидратации, как правило, в свободном виде выделить с помощью перегонки не удается, так как он разлагается на исходные компоненты. Формальдегид в водном растворе гидратирован более чем на 99,9%, ацетальдегид — приблизительно наполовину, ацетон практически не гидратирован. Формальдегид (муравьиный альдегид) обладает способностью свертывать белки. Его 40% водный раствор, называемый формалином, применяется в медицине как дезинфицирующее средство и консервант анатомических препаратов. Трихлороуксусный альдегид (хлораль) гидратирован полностью. Электроноакцепторная трихлорометильная группа настолько стабилизирует хлоральгидрат, что это кристаллическое вещество отщепляет воду только при перегонке в присутствии дегидратирующих веществ — серной кислоты и др. В основе фармакологического эффекта хлоральгидрата СС1зСН(ОН)2 лежит специфическое действие на организм альдегидной группы, обусловливающее дезинфицирующие свойства. Атомы галогена усиливают ее действие, а гидратация карбонильной группы снижает токсичность вещества в целом. Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам. Конфликты в семейной жизни. Как это изменить? Редкий брак и взаимоотношения существуют без конфликтов и напряженности. Через это проходят все. Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор. Что способствует осуществлению желаний? Стопроцентная, непоколебимая уверенность в своем. Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте: 📺 ВидеоОрганические окислительно-восстановительные реакции(видео 6)|Резонансные структурыСкачать  Как написать уравнения реакции полимеризации?Скачать  Альдольно кротоновая конденсацияСкачать  Органика. Механизм реакции этерификации (карбоновая кислота + спирт)Скачать  Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. Практическая часть. 11 класс.Скачать  Лукашев Н. В. - Органическая химия. Часть 1 - Карбонильное соединение 2Скачать  № 82. Органическая химия. Тема 16. Альдегиды. Часть 7. Реакции конденсации, полимеризации альдегидовСкачать  карбонильные соединения. часть 4Скачать  Механизмы химических реакцийСкачать  10 класс § 47 "Карбонильные соединения: номенклатура, изомерия, реакции присоединения"Скачать  Альдегиды и кетоны. Химические свойства. Все 23 реакции ЕГЭ.Скачать  Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  79. Что такое реакции поликонденсацииСкачать  РЕАКЦИЯ АЛЬДЕГИДОВ СО СПИРТАМИСкачать  Методы моделирования при создании ЛС. Модуль 3-3. Механизмы реакций в органической химии. ЛекцияСкачать  |