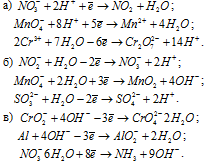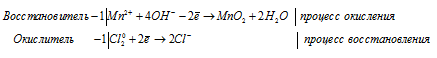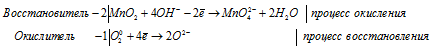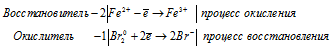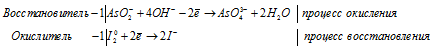Задача 625.
Составить уравнения полуреакций окисления с учетом кислотности среды: 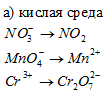
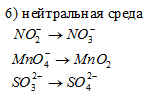
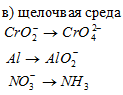
Решение:
Задача 626.
Закончить уравнения реакций:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
б) MnO2 + O2 + KOH = K2MnO4 +
в) FeSO4 + Br2 + H2SO4 =
г) NaAsO2 + I2 + NaOH = Na3AsO4 +
Решение:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
Одна молекула Mn(OH)2 превращается в один ион Mn 2+ и два иона OH — :
Источником кислорода для протекания процесса превращения Mn 2+ в MnO2 служат ионы OH — в щелочной среде. Окислителем данного процесса являются атомы хлора из молекул Cl2.
Марганец повышает свою степень окисления от +4 до +6, т. е. проявляет свойства восстановителя, а кислород понижает свою степень окисления от 0 до -2, проявляя свойства окислителя.
Молекулярная форма процесса:
2Fe 2+ + Br2 0 = 2Fe 3+ + 2Br —
Молекулярная форма процесса:
г) NaAsO 2 + I 2 + NaOH = Na 3 AsO 4 +
AsO 2- + I2 0 + 4OH — = AsO4 3- + 2I — + 2H2O
- Метод полуреакций — составление уравнений ОВР
- Правила составления уравнений ОВР методом полуреакций
- Пример составления уравнения ОВР для кислотной среды
- Пример составления уравнения ОВР для кислотной среды
- Пример составления уравнения ОВР для нейтральной среды
- Метод электронного баланса и ионно-электронный метод (метод полуреакций)
- Метод электронного баланса
- Ионно-электронный метод (метод полуреакций)
- 🎥 Видео
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Метод полуреакций — составление уравнений ОВР
Любая окислительно-восстановительная реакция состоит из двух «половинок» — в ходе ОВР идут два процесса — процесс окисления вещества-восстановителя и процесс восстановления вещества-окислителя. Оба эти процесса могут быть описаны соответственными ионными уравнениями, которые потом можно суммировать и получить итоговое общее ионное уравнение реакции, а потом записать молекулярное уравнение.
В качестве примера составим уравнение реакции сероводорода с раствором калия перманганата в кислой среде методом полуреакций. Ранее это уравнение было составлено методом электронного баланса.
В ходе реакции происходит разложение молекул сероводорода на серу и водород, о чем свидетельствует постепенное помутнение раствора перманганата калия (сера выпадает в осадок). Процесс окисления сероводорода запишем в виде уравнения полуреакции окисления:
Поскольку в левой и правой частях схемы кол-во атомов серы и водорода равно, то стрелку можно заменить на знак равенства, уравняв предварительно число зарядов в исходном веществе и продуктах реакции:
Параллельно с помутнение раствора идет и смена его окраски — из малинового раствор становится бесцветным,что объясняется переходом ионов MnO4 — , имеющих малиновую окраску, в практически бесцветный катион марганца Mn 2+ . Эта полуреакция восстановления выражается схемой:
А куда же делся атом кислорода? — обязательно спросит внимательный читатель. В кислой среде атом кислорода, входящий в состав иона, соединяется с атомами водорода, выделяющимися в ходе полуреакции окисления, образуя молекулу воды, при этом, поскольку из одного иона освобождается аж 4 атома кислорода, то для их связывания требуется 8 атомов водорода:
Чтобы уравнять заряды в левой и правой части схемы, в левую часть надо добавить 5 электронов (в левой части сумма зарядов +7, а в левой +2):
Для получения суммарного уравнения реакции, необходимо почленно сложить две полуреакции, предварительно уравняв кол-во отданных и полученных электронов, по аналогии с методом электронного баланса:
Проверяем кол-во атомов и заряды в левой и правой частях суммарного уравнения, они равны, значит уравнение составлено правильно (водорода — по 16 атомов; серы — по 5; марганца — по 2; кислорода — по 8; заряды — по +4).
Чтобы перейти от ионного уравнения к молекулярному, надо в левой части подобрать к катионам и анионам их «пары» — анионы и катионы соответственно, после чего подобранные ионы записать и в правую часть уравнения, после этого ионы объединяются в молекулы, и получается молекулярное уравнение.
Результат аналогичен уравнению, полученному методом электронного баланса.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Правила составления уравнений ОВР методом полуреакций
- На первом этапе в ионном виде записывают полуреакцию окисления и полуреакцию восстановления, в которых указывают вещество-восстановитель и вещество-окислитель, с продуктами их реакции.
- Сильные электролиты записываются в виде ионов.
- Слабые электролиты, газы и твердые вещества, выпадающие в осадок — в виде молекул.
- Продукты реакции между восстановителем и окислителем устанавливаются по справочникам или по «шпаргалке», приведенной на странице «Определение продуктов ОВР» (это самый сложный этап для начинающих).
- Записывают схему реакции, в которой многоточием обозначают неизвестные продукты реакции.
- Что делать с кислородом:
- Если в исходном веществе кислорода содержится больше, чем в продуктах реакции, то «лишний» кислород в растворах с кислой средой связывается с катионами водорода, образуя молекулы воды (O -2 +2H + =H2O); в нейтральных растворах — в гидроксид-ионы: O -2 +H2O=2OH — ;
- Если в исходном веществе кислорода содержится меньше, чем в продуктах реакции, то «недостающий» кислород «забирается» из молекул воды (в растворах с кислой и нейтральной средой): H2O=O -2 +2H + ; в щелочных растворах — за счет гидроксид-ионов: 2OH — =O -2 +H2O.
- В левой и правой частях уравнения должны быть равны суммарное число и знак электрических зарядов.
Достоинства метода полуреакций:
- Работают с реально существующими ионами (MnO4 — ), а не виртуальными (Mn +7 ).
- Нет необходимости знать степени окисления атомов.
- Прослеживается роль среды, в которой происходит взаимодействие веществ.
- Не нужно знать все продукты реакции, они выводятся «сами собой» в процессе составления уравнения.
Пример составления уравнения ОВР для кислотной среды
Составление уравнения реакции серы с азотной кислотой:
- S+HNO3
- S 0 → SO4 2- — процесс окисления восстановителя.
- NO3 — → NO — процесс восстановления окислителя.
- Приводим в «порядок» первую полуреакцию окисления:
- S 0 → SO4 2- — отличник должен здесь спросить, откуда справа взялся кислород? Немного терпения, сейчас все станет ясно.
- в правую часть схемы, где присутствует избыток кислорода, добавляется катион водорода:
S 0 → SO4 2- +H + - у внимательного читателя тут же должен возникнуть вопрос — а откуда взялся катион водорода? Отвечаем: из молекулы воды, которая добавляется в левую часть схемы:
S 0 +H2O → SO4 2- +H + - Вот теперь настало время уравнять в обеих частях схемы кислород, который, теперь понятно, откуда взялся:
S 0 +4H2O → SO4 2- +H + - Теперь надо уравнять водород:
S 0 +4H2O → SO4 2- +8H + - С атомами элементов в обеих частях схемы полный порядок, осталось разобраться с зарядами — в левой части заряд нулевой; в правой: (-2)+8(+1)=+6:
S 0 +4H2O-6e — → SO4 2- +8H +
- Делаем аналогичную работу со второй полуреакцией восстановления:
- NO3 — → NO
- Добавляем водород, в левую часть, где присутствует «лишний» кислород:
NO3 — +H + → NO - В правую часть добавляем воду:
NO3 — +H + → NO+H2O - Уравниваем кислород:
NO3 — +H + → NO+2H2O - Уравниваем водород:
NO3 — +4H + → NO+2H2O - Уравниваем заряды:
NO3 — +4H + +3e — → NO+2H2O
- Уравниваем кол-во электронов, которые были отданы и приняты в двух полуреакциях:
- Суммируем левые и правые части, предварительно умножив на коэффициент (2) члены второй полуреакции:
- Проводим сокращение одинаковых членов в левой и правой частях схемы и добавляем в пару к анионам «нужные» катионы, чтобы образовались молекулы, в нашем случае это будут молекулы азотной и серной кислоты, для этого мы добавим катион водорода (2H + ):
- Суммарное молекулярное уравнение:
S+2HNO3 = H2SO4+2NO — в результате взаимодействия серы с азотной кислотой получается серная кислота и оксид азота (II).
Пример составления уравнения ОВР для кислотной среды
«Фокус» уравнивания кол-ва атомов кислорода и водорода для уравнений ОВР в щелочной среде заключается в следующем:
- Вода (H2O) добавляется в ту часть полуреакции, в которой присутствует избыток кислорода.
- Соответственно, в противоположную часть уравнения-схемы добавляется удвоенное число гидроксид-ионов (OH — ).
- Перед формулой молекулы воды ставится коэффициент, уравнивающий разницу кол-ва атомов кислорода в левой и правой частях полуреакции.
- Перед формулой гидроксид-иона ставится удвоенный коэффициент.
- Восстановитель присоединяет атомы кислорода из гидроксид-ионов.
- MnO2+KClO3+KOH → ?
- MnO2 → MnO4 2- оксид марганца является восстановителем, он будет связывать гидроксид-ионы.
- Поскольку в правой части схемы килорода больше (на 2 атома), то вода добавляется сюда же, перед ее формулой ставится коэффициент 2, соответственно, в левую часть схемы полуреакции добавляют 4 гидроксид-иона:
MnO2+4OH — → MnO4 2- +2H2O - Уравниваем заряды:
MnO2+4OH — -2e — → MnO4 2- +2H2O - ClO3 — → Cl — — полуреакция восстановления.
- Избыток кислорода (3 «лишних» атома) находится в левой части схемы полуреакции, сюда же добавляем и 3 молекулы воды, а в правую часть 6 гидроксид-ионов:
ClO3 — +3H2O → Cl — +6OH — - Уравниваем заряды:
ClO3 — +3H2O+6e — → Cl — +6OH — - Уравниваем в полуреакциях кол-во отданных и принятых электронов (6 и 2 сокращаем на 2), и получаем суммарное уравнение, путем сложения двух уравнений полуреакций:
- Проводим сокращение подобных слагаемых и добавляем катионы калия, чтобы перейти к молекулярной форме уравнения реакции:
- Молекулярное уравнение реакции:
3MnO2+6KOH+KClO3 = 3K2MnO4+3H2O+KCl
Пример составления уравнения ОВР для нейтральной среды
Среду нейтральной можно счситать лишь условно, в любом случае, среда будет либо слабощелочной, либо слабокислотной.
Составляя уравнение ОВР методом полуреакций для нейтральной среды, одну полуреакцию составляют, как для кислотной среды — в левую часть схемы добавляют молекулу воды, в правую — катион водорода), вторую — как для щелочной (в левую часть добавляют молекулу воды, в правую — гидроксид-ион).
- Na2SO3+KMnO4+H2O
- SO3 2- → SO4 2- — процесс окисления восстановителя;
- MnO4 — → MnO2 — процесс восстановления окислителя;
- Схема реакции:
SO3 2- +MnO4 — → SO4 2- +MnO2+. - Составляем уравнения полуреакций:
- Молекулярное уравнение:
Еще один пример:
- S+KMnO4 → ?
- S → SO4 2-
- MnO4 — → MnO2
- Первую полуреакцию оформляем, как для кислотной среды; вторую — как для щелочной:
- Сокращаем обе части равенства на 8 молекул воды, и добавляем катионы калия:
- Молекулярное уравнение:
S+2KMnO4 = K2SO4+2MnO2
Более подробно составление уравнений окислительно-восстановительных реакций методом полуреакций в различных средах рассмотрено на странице Влияние среды на протекание ОВР.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Решение ОВР методом полуреакцийСкачать

Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
🎥 Видео
Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 5ч. 10 класс.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Основы метода полуреакций для 30 заданияСкачать

Окислительно-восстановительные реакции в нейтральной среде. Продвинутый подход.Скачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 6ч. 10 класс.Скачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 3ч. 10 класс.Скачать

Окислительно-восстановительные реакции. 3 часть. 9 класс.Скачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Как определить продукты в окислительно-восстановительных реакциях. Ч.1. Введение.Скачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 2ч. 10 класс.Скачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Учимся составлять электронный баланс/овр/8классСкачать