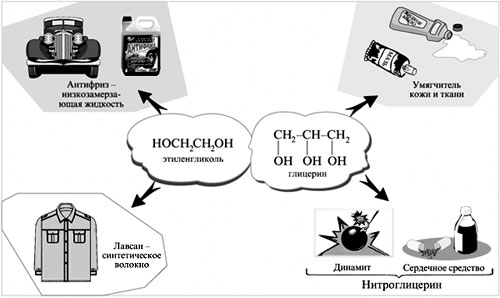
Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных с углеводородным радикалом.
Группы ОН в многоатомных спиртах размещаются у разных атомов углерода:
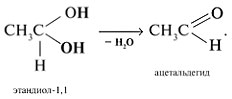
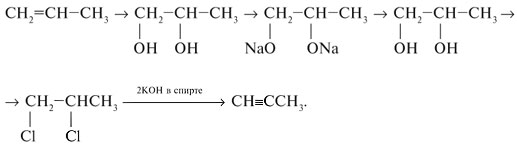
Соединения с двумя группами ОН при одном атоме углерода неустойчивые. Они отщепляют воду и превращаются в альдегиды:
Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами).
- Получение
- Физические свойства
- Химические свойства
- Ответы на упражнения к теме 2
- Урок 20
- Этиленгликоль: химические свойства и получение
- Строение этиленгликоля
- Водородные связи и физические свойства спиртов
- Химические свойства этиленгликоля
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Дегидратация
- 4. Окисление этиленгликоля
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение этиленгликоля
- 5. Дегидрирование этаниленгликоля
- Получение этиленгликоля
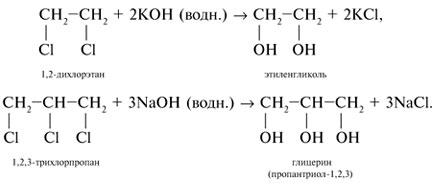
- 1. Щелочной гидролиз дигалогеналканов
- 2. Гидрирование карбонильных соединений
- 3. Гидролиз сложных эфиров
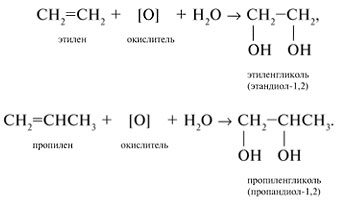
- 4. Мягкое окисление алкенов
- Свойства и получение многоатомных спиртов
- Физические свойства многоатомных спиртов
- Получение многоатомных спиртов
- Химические свойства многоатомных спиртов
Получение



Физические свойства
Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. 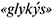
Химические свойства
Этиленгликоль и глицерин подобны одноатомным спиртам.




 | |||||||||||
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Видео:Взаим-вие многоатомных спиртов с гидроксидом медиСкачать

Химические свойства этиленгликоля
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этиленгликоль взаимодействует с калием с образованием гликолята калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Видео:Получение этиленгликоля .Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль : |
Видео:Этиленгликоль. Свойства, применение, производители.Скачать

Видео:Удивительные свойства глицеринаСкачать

3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180 о С) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
Видео:8.1. Многоатомные спирты (этиленгликоль, глицерин): Номенклатура, физические свойства. ЕГЭ по химииСкачать

Видео:Многоатомные спирты. 1 часть. 10 класс.Скачать

4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
Видео:Многоатомные спирты | Химия 10 класс #26 | ИнфоурокСкачать

5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать

Получение этиленгликоля
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

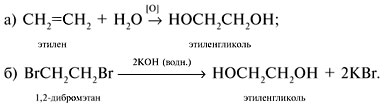
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
Видео:Видеоурок по химии "Понятие о спиртах"Скачать

2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2 → CH2(OH)-CH2OH
Видео:Этиленгликоль или глицерин? Хэштег. Фрагменты #7Скачать

3. Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
Видео:Опыты по химии. Растворение глицерина в водеСкачать

4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Видео:90. Что такое глицеринСкачать

Свойства и получение многоатомных спиртов
Напомним, что многоатомные спирты – это органические соединения, в молекулах которых содержится несколько гидроксильных групп. Общая формула многоатомных спиртов — CnH2n+1(OH)k, где n и k – целые числа более 2. Классификация, строение, изомерия и номенклатура спиртов рассмотрены раннее в соответствующем разделе. В настоящем разделе рассмотрим свойства и получение многоатомных спиртов.
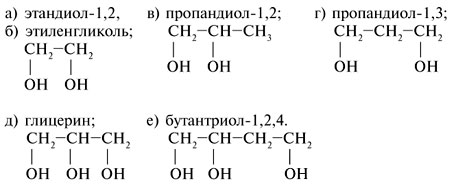
Важнейшие представители многоатомных спиртов содержат от двух до шести гидроксильных групп. Двухатомные спирты (гликоли) или алкандиолы, содержащие две гидроксильные группы в своей молекуле, трехатомные спирты (алкантриолы) – три гидроксильные группы. Четырех-, пяти- и шестиатомные спирты (эритриты, пентиты и гекситы) содержат 4, 5 и 6 ОН-групп соответственно.
Видео:Химия 9 класс (Урок№30 - Производные углеводородов. Спирты.)Скачать

Физические свойства многоатомных спиртов
Многоатомные спирты хорошо растворяются в воде и спиртах, хуже в других органических растворителях. Спирты с небольшим числом углеродных атомов представляют собой вязкие сладковатые на вкус жидкости. Высшие члены ряда — твердые вещества. По сравнению с одноатомными спиртами они имеют более высокие плотности и температуры кипения. Тривиальные названия, названия по систематической номенклатуре и физические свойства некоторых спиртов представлены в таблице:
Видео:Химия, 11-й класс, Этиленгликоль, глицеринСкачать


Получение многоатомных спиртов
Получение гликолей
Гликоли могут быть получены практически всеми способами получения одноатомных спиртов. Выделим основные:
- Гидролиз дигалогенпроизводных алканов :
- Гидролиз хлоргидринов протекает следующим образом:
- Восстановление сложных эфиров двухосновных кислот по методу Буво:
- Окисление алкенов по Вагнеру:
- Неполное восстановление кетонов под действием магния (в присутствии йода). Таким образом получают пинаконы:
Получение глицерина
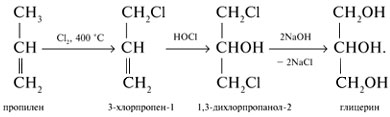
- Хлорирование пропилена по Львову:
- Способ Береша и Якубовича состоит в окислении пропилена в акролеин, который затем восстанавливают до аллилового спирта с последующим его гидроксилированием:
- Каталитическое гидрирование глюкозы приводит к восстановлению альдегидной группы и одновременно разрыв С3-С4 связи:
За счет разрыва С2-С3 связи образуется небольшое количество этиленгликоля и треита (стереоизомер эритрита).
Помимо глюкозы каталитическому гидрированию можно подвергнуть и другие полисахариды, содержащие глюкозные звенья, например, целлюлозу.
4. Гидролиз жиров щелочью проводят с целью получения мыла (калиевые или натриевые соли сложных карбоновых кислот): Такой процесс называется омылением.
Получение четырехатомных спиртов (эритритов)
В природе эритрит (бутантетраол-1,2,3,4) содержится как в свободном виде, так и виде сложных эфиров в водорослях и некоторых плесневых грибах.
Искусственно его получают из бутадиена-1,4 в несколько стадий:
Пентаэритрит (тетраоксинеопентан) в природе не встречаются. Синтетически можно получить при взаимодействии формальдегида с водным раствором ацетальдегида в щелочной среде:
Видео:Не все знают не все так делают. Незамерзайка своими руками из дестиллированной водыСкачать

Химические свойства многоатомных спиртов
Химические свойства многоатомных спиртов сходны со свойствами одноатомных спиртов. Однако наличие в молекулах многоатомных спиртов нескольких гидроксильных групп увеличивает их кислотность. Поэтому они могут вступать в реакции с щелочами и с гидроксидами тяжелых металлов, образуя соли.
- Взаимодействие с гидроксидом меди Cu(OH)2 является качественной реакцией на многоатомные спирты. В результате реакции образуется раствор гликолята или глицерата меди, окрашенного в синий цвет:
- Взаимодействие с натрием и гидроксидом натрия :
- Взаимодействие с галогенводородами происходит довольно легко. При этом образуются соответствующие хлоргидрины:
Замещение второй гидроксогруппы этиленгликоля происходит труднее (под действием РСl5 или SOCl2 – замещение происходит легче).
- Взаимодействие с кислотами ведет к образованию сложных эфиров:
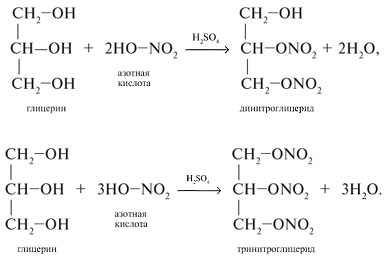
Взаимодействие с азотной кислотой
Данные соединения являются взрывчатыми веществами. Тринитроглицерин, кроме этого, используют в медицине в качестве лечебного препарата.
Взаимодействие с уксусной кислотой
Если в реакции этерификации этиленгликоля участвует двухосновная кислота, то возможно получение полиэфира (реакция поликонденсации):
Обычно в качестве R выступает терефталевая кислота. Продуктом такой реакции является терилен, лавсан:
- Реакции дегидратации многоатомных спиртов:
При дегидратации этиленгликоля получается соединение, имеющее 2 таутомерные формы (кето-енольная таутомерия):
Дегидратация этиленгликоля может происходить с одновременной его димеризацией:
Диэтиленгликоль далее может опять вступить в реакцию с этиленгликолем, в результате чего образуется 1,4-диоксан (сильнейший печеночный яд!):
При дегидратации 1,4-бутандиола можно получить тетрагидрофуран (оксолан):
Дегидратация других гликолей сопровождается процессом пинаколиновой перегруппировки:
- Окисление многоатомных спиртов приводит к образованию альдегидов или кетонов.
При окислении этиленгликоля вначале получается гликолевый альдегид, далее глиоксаль, который при дальнейшем окислении переходит в дикарбоновую кислоту:
При окислении глицерина образуется смесь соответствующего альдегида и кетона:
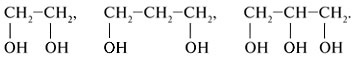
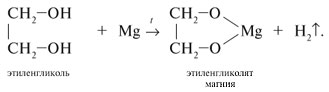
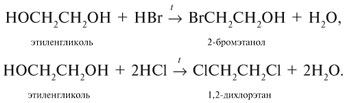
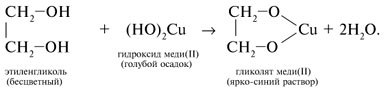
 моногалогенуглеводород
моногалогенуглеводород 

 С(О)O–]n;
С(О)O–]n; 










