Материал для задания 37 ЕГЭ (по-старому С2 ЕГЭ), для олимпиад, да и вообще для тех, кому нужны нормальные знания по химии
Автор статьи — Саид Лутфуллин
В статье приведены многие реакции, которые встречаются в ЕГЭ. Формулировки описания реакций тоже как в ЕГЭ, поэтому не удивляйтесь если встретите что-то вроде «…осадок растворяется в кислотах…», конечно же, он не растворяется, он реагирует с кислотой. Растворение – это немного другой процесс, но господа составители из ФИПИ со мной не согласны и упорно применяют в таких случаях именно этот термин.
Видео:Как понять что вещество выпадает в осадок или образуется газСкачать

Уравнения качественных реакций неорганической химии.
(кликните на название категории, чтобы перейти в соответствующий раздел)
I. Элементы IA-группы (щелочные металлы)
– легкие металлы, настолько пластичные, что их можно разрезать ножом. Из-за чрезвычайной активности, на воздухе легко окисляются (некоторые со взрывом), поэтому их хранят в керосине, кроме лития. Литий хранить в керосине невозможно из-за физических свойств. Этот металл легче керосина, поэтому всплывает в нем. Литий хранят в вазелине или еще в чем-нибудь таком инертном и вязком.
Почти все соли щелочных металлов растворимы в воде.
Поэтому обнаружение их катионов выпадением осадка невозможно. Для определения катионов металлов используют метод пирохимического анализа.
Этот метод основан на способности ионов металлов, входящих в состав летучих солей, окрашивать пламя горелки в определенный цвет.
1) Li +
Окрашивает пламя горелки в карминово-красный цвет
Помимо этого, литий – один единственный щелочной металл, катион которого можно обнаружить с помощью осадка. Катион лития с фосфат-ионом дает белый осадок:
Сокращенное ионное уравнение:
3Li + + PO4 3- → Li3PO4↓
2) Na +
Окрашивает пламя горелки в желтый цвет.
3) K +
Окрашивает пламя горелки в фиолетовый цвет.
4) Rb +
Окрашивает пламя горелки в розово-фиолетовый цвет.
5) Cs +
Окрашивает пламя горелки в голубовато-фиолетовый цвет.
II. Щелочноземельные металлы (подгруппа кальция)
– металлы серого цвета. Твердые, ножом не режутся. На воздухе ведут себя спокойно: покрываются оксидной пленкой.
Определить катионы щелочноземельных металлов можно как с помощью выпадения осадка, так и с помощью пирохимического метода:
1. Ca 2+
Образует белый осадок с карбонат-ионом : CaCl 2 + K 2 CO 3 → CaCO 3 ↓ + 2 KCl
Сокращенное ионное уравнение: Ca 2+ + CO 3 2- → CaCO 3 ↓
Образуется карбонат кальция – мел. Так же карбонат кальция – составная часть накипи. Иногда можно встретить формулировку: «…белый осадок, растворимый в кислотах с выделением газа (без цвета, вкуса, запаха)…». Имеется в виду реакция карбонатов с кислотами:
Катион кальция окрашивает пламя горелки в оранжево-красный цвет .
2. Sr 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : SrCl 2 + K 2 SO 4 → SrSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Sr 2+ + SO 4 2- → SrSO 4 ↓
Окрашивает пламя горелки в темно-красный цвет .
3. Ba 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : BaCl 2 + K 2 SO 4 → BaSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Ba 2+ + SO 4 2- → BaSO 4 ↓
Катионы бария окрашивают пламя горелки в зеленый цвет
4. Mg 2+
Определяется, как и кальций, карбонат-ионами .
Карбонат магния – белый осадок: Mg ( NO 3 ) 2 + K 2 CO 3 → MgCO 3 ↓ + 2 KNO 3
Сокращенное ионное уравнение: Mg 2+ + CO 3 2- → MgCO 3 ↓
III. Be 0 (Be 2+ ), Zn 0 (Zn 2+ ), Al 0 (Al 3+ )
эти три металла объединяют амфотерные свойства. Поэтому если в задании встречается следующая формулировка: «…металл, растворимый в раствор е щелочи…», «…металл, который растворяется и в щелочах, и кислотах…» или «…металл, растворяющийся в щелочи с выделением горючего газа, легче воздуха…» , то имеют в виду один из этих трех металлов.
Ионы этих металлов в растворах тоже определяют добавлением щелочи.
Выпадает белый студенистый осадок (гидроксид металла), который в избытке щелочи растворяется (гидроксиды алюминия, цинка и бериллия реагируют со щелочами, образуя растворимые гидроксоалюминаты, гидроксоцинкаты и гидроксобериллаты соответственно):
BeCl 2 + 2 KOH → Be ( OH ) 2 ↓ + 2 KCl
(образование осадка) сокращенное ионное уравнение:
Be 2+ + 2 OH — → Be ( OH ) 2 ↓ Be ( OH ) 2 + 2 KOH → K 2 [ Be ( OH ) 4 ] (растворение осадка)
ZnCl 2 + 2 KOH → Zn ( OH ) 2 ↓ + 2 KCl (образование осадка)
сокращенное ионное уравнение: Zn 2+ + 2 OH — → Zn ( OH ) 2 ↓
Zn ( OH ) 2 + 2 KOH → K 2 [ Zn ( OH ) 4 ] (растворение осадка)
AlCl 3 + 3 KOH → Al ( OH ) 3 ↓ + 3 KOH (образование осадка)
сокращенное ионное уравнение:
Al 3+ + 3 OH — → Al ( OH ) 3 ↓
Al ( OH ) 3 + KOH → K [ Al ( OH ) 4 ] (растворение осадка)
Оксиды этих металлов, как и гидроксиды, растворяются в кислотах и щелочах, рассмотрим на примере оксида алюминия:
У гидроксида цинка есть характерная особенность: он растворяется в NH 3 (водн.)
Ион Zn 2+ с S 2+ образует белый осадок . Который растворяется в кислотах с выделением газа с запахом тухлых яиц – сероводорода (про него подробнее ниже, в разделе сера):
ZnSO 4 + K 2 S → ZnS ↓ + K 2 SO 4 (образование осадка)
Сокращенное ионное уравнение:
ZnS + H 2 SO 4 → ZnSO 4 + H 2 S ↑ (растворение осадка с выделением сероводорода)
Медь – пластичный розовато-красный металл.
Хороший проводник электрического тока.
Не вытесняет из кислот водород.
Реагирует только с кислотами-окислителями (азотной и концентрированной серной):
Оксид меди – CuO – черный – основный.
Растворяется в кислотах, окрашивая раствор в голубой цвет: CuO + 2HCl → CuCl 2 + H 2 O
Cu 2+
Летучие соли меди окрашивают пламя горелки в зеленый цвет. Соединения меди имеют голубоватую окраску , это можно использовать как диагностический признак.
В растворе ионы меди можно обнаружить добавлением щелочи выпадает растворимый в кислотах, голубой осадок, который используется в нескольких качественных реакциях органической химии.
Сокращенное ионное уравнение:
Осадок Cu ( OH ) 2 растворяется в избытке NH 3 (водн.) образуя интенсивно синий раствор:
Если нагреть осадок Cu ( OH ) 2 , то он почернеет. Потому что гидроксид меди( II ) – нерастворимое основание и разлагается:
Голубой – это фирменный цвет соединений меди, и если в задании ЕГЭ написано про этот цвет, то 90% вероятности, что говорят про соединение меди.
Серебро – мягкий благородный металл. Цвет серебристый.
Оксид серебра Ag 2 O- черный – основный.
Ag +
Катион серебра с хлорид-ионом дает белый творожистый осадок : AgNO 3 + KCl → AgCl ↓ + KNO 3
сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
Осадок хлорида серебра (и остальные галогениды) , как и гидроксида меди, растворяется в NH 3 * H 2 O
Еще одна особенность серебра, которая позволяет определить его ионы в растворе, – это его гидроксид, который нестабилен и быстро разлагается в водном растворе.
При добавлении к раствору соли серебра щелочи , выпадает черный осадок оксида серебра :
AgNO 3 + KOH → KNO 3 + AgOH
можно (и грамотнее) записать сразу:
То есть при добавлении к соли серебра щелочи выпадает черный осадок . Осадок оксида серебра , как и галогениды этого металла, растворяются в NH 3 (водн.) :
[ Ag ( NH 3 ) 2 ] OH – гидроксид диамминсеребра( I ) известен как раствор Толленса.
Он используется в качественной реакции на альдегиды (реакция серебряного зеркала).
Оксид серебра как основный гидроксид растворяется в кислотах (само собой, в тех, с которыми серебро может образовать растворимую соль):
Железо – серебристо-белый пластичный металл.
Обладает магнитными свойствами.
Вытесняет из растворов кислот водород (кроме азотной). Обратите внимание, что при взаимодействии с кислотами-неокислителями, и слабыми окислителями железо приобретает степень окисления +2, а при взаимодействии с сильными окислителями оно приобретет степень окисления +3:
2 Fe + 3 Cl 2 ( t )→ 2 FeCl 3
Катион Fe 3+
При добавлении к раствору, содержащему ионы трехвалентного железа , выпадает бурый осадок гидроксида железа ( III ):
Сокращенное ионное уравнение:
Оксид и гидроксид железа( III ) – амфотерные соединения, поэтому они растворяются в щелочах и кислотах:
Катион Fe 2+ с гидроксид ионом тоже образует осадок, только зеленоватого цвета .
Сокращенное ионное уравнение: Fe 2+ + 2 OH — → Fe ( OH ) 2 ↓
Оксид и гидроксид железа( II ) – основные.
В щелочах не растворяются. Осадок со временем буреет (меняет степень окисления с 2+ на +3):
На ионы железы есть еще две похожие канонические качественные реакции. Образуется одно и то же вещество: берлинская лазурь, или турнбулева синь.
Раньше считали, что это два разных вещества, в книжках писали: «не путайте», а потом оказалось, что это не так.
Ион Fe 2+ определяется добавлением красной кровяной соли (гексацианоферрат (III) калия):
4Fe 2+ + 3 [Fe III (CN) 6 ] 3− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Ион Fe 3+ определяется добавлением желтой кровяной соли (гексацианоферрат (II) калия):
4Fe 3+ + 3 [Fe II (CN) 6 ] 4− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Не очень активный, так как покрывается оксидной пленкой.
Название элемента переводится с греческого «цвет», потому что соединения хрома, как правило, окрашены. Простое вещество хром ведет себя как типичный металл, со щелочами не реагирует.
Реагирует с кислотами. Кислоты-неокислители ( в том числе разбавленная серная кислота) и вообще слабые окислители переводят хром в степень окисления +2:
Cr + S (t)→ CrS C окислителями приобретает степень окисления +3:
В общем тут все как у железа. Правило простое и вполне логичное.
С азотной и концентрированной серной кислотой не реагирует, так как пассивируется.
Проявляет несколько устойчивых степеней окисления.
Степень окисления +2
В этих соединениях хром проявляет сильные восстановительные свойства.
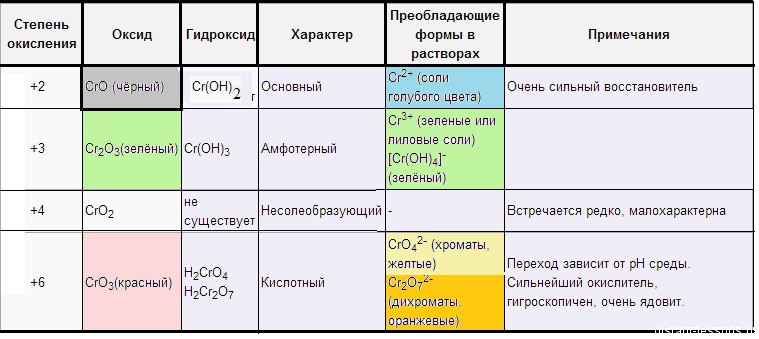
Оксид хрома ( II ) – CrO (основный) – черный.
Растворы солей Cr 2+ голубые . Если обработать черный оксид хрома( II ) соляной кислотой, образуется голубой раствор :
Если к раствору соли двухвалентного хрома добавить щелочь выпадет желтый осадок гидроксида хрома( II ), (осадок на воздухе зеленеет, об этом чуть позже):
Сокращенное ионное уравнение:
Гидроксид хрома( II ) основный,
поэтому он не растворяется в щелочах, зато прекрасно растворяется в кислотах, образуя все тот же синий раствор:
Степень окисления +3.
Оксид хрома( III ) – Cr 2 O 3 (амфотерный) – зеленый .
Как амфотерный оксид Cr 2 O 3 растворяется в кислотах и щелочах:
Соли трехвалентного хрома могут быть разного цвета (от фиолетового до темно-зеленого). Поэтому визуально опознать соль трехвалентного хрома со 100% уверенностью нельзя. Наличие катионов Cr 3+ в растворе определяется добавлением щелочи .
Cr 3+ с гидроксид-ионами образует зеленый осадок гидроксида хрома( III ) :
Сокращенное ионное уравнение:
Cr 3+ + 3 OH — → Cr ( OH ) 3 ↓
Выпавший осадок – гидроксид хрома( III ) амфотерный, поэтому растворяется в кислотах и щелочах, с образованием зеленых солей – гидроксохроматов :
Если оставить на некоторое время на воздухе желтый осадок гидроксида хрома( II ) , то он позеленеет . Cr +2 окисляется до Cr +3 ,
образуется зеленый гидроксид хрома( III ) :
Если подействовать на соединение хрома (+3) сильным окислителем, то произойдет смена окраски. Она станет желтой. Хром окислится до +6
Степень окисления +6.
В этих соединениях хром проявляет сильные окислительные свойства.
Оксид хрома( VI ) – CrO 3 (кислотный) – красный .
Окисляет многие органические соединения. Этот процесс описывают как «растворение [оксида хрома VI ] в спиртах (альдегидах, эфирах)»
Оксид кислотный, поэтому в кислотах не растворяется, растворяется в щелочах, с образованием хроматов:
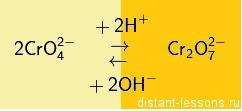
Хроматы – это соли хромовой кислоты ( H 2 CrO 4 ). Они желтого цвета. Кроме хромовой (хром +6) образует дихромовую кислоту ( H 2 Cr 2 O 7 ), ее соли – бихроматы (дихроматы) оранжевые .
Хроматы и бихроматы переходят друг в друга при изменении кислотности среды (с щелочной на кислую и наоборот):
То есть в кислой среде более устойчивы бихроматы, в щелочной хроматы.
Хроматы и бихроматы так же являются сильнейшими окислителями.
При добавлении к раствору хромата катионов бария выпадает желтый осадок хромата бария BaCrO 4 :
Сокращенное ионное уравнение: Ва 2+ + СrO 4 2- → BaCr O 4 ↓
Полученный хромат бария растворяется в сильных неорганических кислотах. Потому что, как уже говорилось ранее, в кислой среде хроматы не устойчивы и переходят в бихроматы:
2 BaCrO 4 + 2 H + → 2 Ba 2+ + Cr 2 O 7 2- + H 2 O
Компактная таблица цветов соединения хрома, приведена у нас в статье “Хром”:
Как и хром малоактивен за счет пассивации.
Реагируя с кислотами (даже с кислотами-окислителями), окисляется до +2:
Mn + HCl → MnCl2 + H2↑
Mn + 2H2SO4(конц.) → MnSO4 + SO2↑ + 2H2O
В более агрессивных средах с кислотами-окислителями процесс окисления идет глубже: до +4 и +7.
Кислородом окисляется до +4 (там конечно есть другие варианты с другими температурами, но мы их рассматривать не будем):
Галогены (кроме фтора) до +2:
Mn + Cl2 (t)→ MnCl2
Проявляет различные степени окисления.
Степень окисления 2+.
Степень окисления 2+. Оксид марганца( II ) – MnO (основный) зеленого цвета .
На воздухе очень быстро окисляется до темно-бурого MnO 2 :
Соли, содержащие катион Mn 2+ как правило имеют бледный светло-розовый цвет .
Катион Mn 2+ обнаруживают гидроксид-ионами, с которыми он образует розовато-белый осадок гидроксида марганца( II ), который окисляется на воздухе и буреет (превращается в бурый оксид марганца( II )):
MnCl 2 + 2 KOH → Mn ( OH ) 2 ↓ + 2 KCl
Сокращенное ионное уравнение:
Mn 2+ + 2 OH — → Mn ( OH ) 2 ↓
Степень окисления 4+. Оксид марганца( IV ) – MnO 2 (амфотерный) т емно-бурый – одно из самых устойчивых и встречаемых соединений марганца.
Mn +4 O 2 + 4 HCl → Mn +2 Cl 2 + Cl 2 ↑ + 2 H 2 O
Степень окисления +6. Оксид марганца( VII ) – Mn 2 O 7 (кислотный) зелено-бурая жидкость.
Очень не стабильное и агрессивное вещество, может спонтанно взорваться. Сильный окислитель.
Оксиду марганца( VII ) соответствует марганцевая кислота HMnO 4 .
Она существует только в водном растворе, который как и растворы ее солей (перманганатов) имеет фиолетово-малиновую окраску .
Перманганаты так же являются сильными окислителями.
В ЕГЭ часто встречаются реакции окисления органических веществ перманганатом калия – это классика:
Приведенное выше уравнение – это качественная реакция на кратные связи – обесцвечивание раствора перманганата и выпадение темно-бурого осадка.
Это весьма необычное вещество. Может быть, трудно представить, но среди всех простых веществ есть только два, которые при нормальных условиях находятся в жидком агрегатном состоянии. Это бром и ртуть.
В нормальных условиях ртуть – серебристо-белая жидкость, с высокой плотностью, поэтому она тонет в воде.
Сама по себе металлическая ртуть вреда не представляет, а вот ее пары и соединения (в особенности органические) чрезвычайно ядовиты.
Качественная реакция на Hg 2+ : при добавлении к раствору соли ртути( II ) щелочи выпадает оранжевый осадок ОКСИДА ртути , гидроксид не образуется, его не существует:
NH 4 + – ион аммония
Если добавить к раствору аммония (иногда нужно нагреть) щелочь образуется нестабильный гидроксид аммония, который разлагается. В ыделяется аммиак – газ с реким запахом (запах нашатырного спирта) :
Можно записать сразу: NH 4 NO 3 + KOH → NH 3 ↑ + H 2 O + KNO 3
Сокращенное ионное уравнение: NH 4 + + NO 3 — → NH 3 ↑ + H 2 O
Выделившийся газ (аммиак) может быть поглощен растворами кислот, с образованием солей аммония: NH 3 + HCl → NH 4 Cl
H +
– частица, в которую превращается атом водорода, отдав электрон.
Получается протон, понятное дело, такая частица в воде не существует.
Частица эта прикреплена по донорно-акцепторному механизму к атому кислорода в молекуле воды, получается ион гидроксония: H 3 O + .
О чем свидетельствует наличие в растворе такого иона?
Конечно же о том, что среда раствора кислая.
А для определения кислотности используют индикаторы.
Рассмотрим несколько индикаторов: лакмус фиолетовый , метиловый оранжевый , фенолфталеин .
Лучше учить названия индикаторов именно так, ведь в таких названиях заключена информации о цвете индикатора в нейтральной среде:
метиловый оранжевый – оранжевый,
| Индикатор | Цвет в кислой среде pH | Цвет в нейтральной среде pH = 7 Цвет в щелочной среде pH > 7 | |
| Лакмус фиолетовый | Красный | Фиолетовый | Синий |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
| Фенолфталеин | Нет (бесцветный) | Нет (бесцветный) | Малиновый |
Существует несколько мнемонических правил для запоминания цветов индикаторов:
Фенолфталеиновый в щелочах малиновый, но несмотря на это в кислотах он без цвета.
В кислотах лакмус красный – цвет такой прекрасный, а в щелочах он синий как январский иней, а в нейтральной среде фиолетовый, как нигде. (Этот стишок сочинили когда-то мы с товарищем. Хоть он не совсем складный и мы так и не можем объяснить, с чего бы это иней, который обычно белый, в январе вдруг станет синим, стишок как-то по-особенному запал в мою память, всегда им пользуюсь)
Кислота – начинается на букву К, как и слово «кислый» — помогает вспомнить цвет лакмуса и метилоранжа в кислотах.
– элементы VIIA -группы( F , Cl , Br , I ), типичные неметаллы.
Пойдем по порядку:
Фтор – F 2 – желтый газ с легким зеленым отливом. Самый электроотрицательный неметалл, поэтому с кислородом образует не оксид фтора, а фторид кислорода: OF 2 степень окисления кислорода в нем равна +2. Чрезвычайно активное вещество, реагирует со всем, с чем не лень. И большинство реакций протекает бурно, взрывообразно.
Фторид-ионы ( F — ) в растворе определяются добавлением катионов кальция ( Ca 2+ ), наблюдается выпадение белого осадка :
2 KF + CaCl 2 → 2 KCl + CaF 2 ↓
Сокращенное ионное уравнение: Ca 2+ + 2 F — → CaF 2 ↓
- Хлор – Cl 2 – зеленый газ, с характерным резким запахом, сильный яд, тяжелее воздуха (при химической атаке стелется по земле):
Хлорид-ионы ( Cl — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение белого творожистого осадка (об этой реакции говорилось ранее в разделе серебро):
KCl + AgNO 3 → AgCl ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
- Бром – Br 2 – красно-бурая летучая жидкость, имеющая очень резкий неприятный запах.
Бромд-ионы ( Br — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение слегка желтоватого осадка :
KBr + AgNO 3 → AgBr ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Br — → AgBr ↓
- Иод – I 2 – летучие черно-серые с фиолетовым отливом кристаллы. Пары фиолетовые, имеют характерный запах.
Иодид-ионы ( I — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение желтоватого осадка (цвет интенсивнее, чем у бромида серебра) :
Сокращенное ионное уравнение: Ag + + I — → AgI ↓
Осадки-галогениды не растворяются в разбавленных кислотах.
Простое вещество сера – хрупкие желтые кристаллы.
Сера может проявлять различные степени окисления:
Степень окисления -2:
в сульфИД-ионе ( S 2- ) и гидросульфИД-ионе ( HS — ).
СульфИДы (и гидросульфИДы) – это соли сероводородной кислоты, которая является слабым электролитом. Поэтому сильные кислоты вытесняют ее из растворов солей. Выделяется H 2 S – сероводород, газ с неприятным запахом тухлых яиц :
K 2 S + 2HCl → 2KCl + H 2 S↑
Сокращенное ионное уравнение: 2 H + + S 2- → H 2 S ↑
Выделившийся газ ( H 2 S ) на воздухе сгорает синим пламенем (не в смысле, что выделился и сразу сгорел, а если начать сжигать):
Так же сероводород ( H 2 S ) может быть поглощен растворами щелочей: H 2 S + 2 NaOH →
Сероводород является хорошим восстановителем, так как сера в нем в низшей степени окисления.
Еще одна особенность ионов S
2- позволяет легко определить их в растворе. Ионы S 2- образуют осадки со многими тяжелыми металлами:
- Классическая реакция с ионами Pb2+ . Образуется черный осадок сульфида серы :
- С ионами Cu 2+ , Fe 2+ , Ni 2+ , Cu 2+ , Pb 2+ , Hg 2+ , Ag + и ионами многих других металлов тоже образуются осадки черного цвета .
- С ионом Zn 2+ образуется белый осадок (один из немногих нечерных нерастворимых сульфидов):
Так как сера в сульфид-ионе в низшей степени окисления, она может окислиться. При действии сильных окислителей на сульфиды они окисляются до сульфатов (как правило). Классическая ЕГЭ-шная реакция, цитата из С2: «…черный осадок побелел после обработки его пероксидом водорода… ». Речь идет о
черном осадке сульфида свинца ( PbS ). Пероксид водорода H 2 O 2 (сильный окислитель) превращает черный сульфид свинца в белый (тоже нерастворимый) сульфат свинца ( PbSO 4 ):
Степень окисления + 4:
встречается в оксиде серы ( IV ) (сернистом газе – SO 2 ), в соответствующей этому оксиду кислоте – сернистой ( H 2 SO 3 , существующей только в растворе) и в солях сернистой кислоты – сульфИТах и гидросульфИТах.
Сернистый газ ( SO 2 ) – бесцветный газ с резким запахом (по легендам – запахом ада). Его можно почувствовать чиркнув спичку. Образуется при сжигании серы, сероводородов, сульфидов, серосодержащих органических веществ. Классическое школьное уточнение: « обесцвечивает раствор фуксина и фиолетовые чернила », при этом совсем не обязательно знать, что такое фуксин, и какие реакции протекают. Просто хорошо бы запомнить эту формулировку.
Так как является кислотным оксидом, реагирует с растворами щелочей. (формулировка из задания ЕГЭ: «…выделившийся газ с резким запахом был поглощен раствором щелочи…» ). Образуются соли сернистой кислоты – сульфиты:
СульфИТ-ионы и гидросульфИТ-ионы в растворе можно обнаружить добавлением сильной кислоты. При этом из раствора сульфита (гидросульфита) вытесняется сернистая кислота: H 2 SO 3 , которая не стабильная, поэтому быстро разлагается на воду и соответствующий оксид ( SO 2 ). То есть, если совсем коротко: при действии на сульфиты и гидросульфиты кислот выделяется SO 2 – газ с резким запахом (обесцвечивающий раствор фуксина и фиолетовые чернила):
Можно (и грамотнее) записать сразу:
Степень окисления +6
встречается в серном ангидриде (оксиде серы( VI ) – SO 3 ), в соответствующей ему серной кислоте ( H 2 SO 4 ) и в ее солях, сульфАТах.
Серный ангидрид ( SO 3 ) и серная кислота( H 2 SO 4 ) содержат серу в высшей степени окисления, поэтому являются сильными окислителями.
Сульфаты в растворе определяются добавлением катионов бария ( Ba 2+ ). Сульфат-ион с катионом бария образует белый осадок ( нерастворимый в кислотах ):
Сокращенное ионное уравнение: Ва 2+ + S O 4 2- → BaS O 4 ↓
CO 3 2-
– карбонат-ион и HCO 3 — – гидрокарбонат-ион
являются анионом слабой, нестабильной, существующей только в растворе, угольной кислоты. Поэтому она легко вытесняется сильными кислотами из растворов солей (карбонатов и гидрокарбонатов).
Вытесняется и тут же распадается на воду и углекислый газ.
При действии кислот на карбонаты выделяется бесцветный газ без вкуса и запаха :
Можно (и грамотнее) записать сразу: K 2 CO 3 + 2 HCl → 2 KCl + CO 2 ↑ + H 2 O
Эта качественная реакция вам хорошо известна, вы наверняка проводили ее у себя дома. Добавим уксус к соде, и как раз будет выделяться газ, в чем можно убедиться если поднести спичку, она погаснет, так как CO 2 не поддерживает горения:
Выделившийся углекислый газ может быть поглощен раствором щелочи:
В связи со способностью поглощаться щелочами для описания углекислого газа часто встречается следующая формулировка: «… газ, при пропускании его через известковую воду, вызвал ее помутнение… ». Известковая вода – это профильтрованный раствор гидроксида кальция (гидроксид кальция полностью не растворяется в воде, образуется взвесь, и чтобы получить прозрачный раствор – его фильтруют, для очищения от не растворившихся частиц гидроксида кальция). При взаимодействии гидроксида кальция с углекислым газом образуется нерастворимый карбонат кальция, который и обеспечивает мутность:
PO 4 3-
– анион ортофосфорной кислоты (H 3 PO 4 ). В растворе его можно определить добавлением катионов серебра , при этом выпадает интенсивно-желтый осадок :
Сокращенное ионное уравнение: 3 Ag + + PO 4 3- → Ag 3 PO 4 ↓
SiO 3 2-
– анион кремниевой кислоты ( H 2 SiO 3 ) , которая являясь слабым электролитом, вытесняется из растворов ее солей. Кроме того, кремниевая кислота малорастврима в воде, поэтому в момент вытеснения ее из раствора соли, появляется гелеобразный осадок – это и будет H 2 SiO 3 :
Кремниевая кислота настолько слабая, что вытесняется даже угольной:
– оксид азота ( VI ).
Ядовитый газ с неприятным запахом бурого цвета.
В ЕГЭ его обычно именно так и обзывают – бурый газ .
Химически очень активное вещество:
- при взаимодействии не очень активных металлов с HNO 3 концентрированной;
- при разложении нитратов этих металлов.
В реакции с водой диспропорционируется, образуя азотную и азотистую кислоты:
Похожая реакция диспропорционирования происходит при растворении NO 2 в щелочах (образуются не кислоты, а соли этих кислот, нитраты и нитриты соответственно):
В присутствии избытка кислорода реакция идет без образования азотистой кислоты (диспропорционирования не происходит):
OH —
Наличие в растворе ионов OH — указывает на щелочную реакцию среды ( pH >7).
Определить pH можно с помощью индикаторов.
Окраски индикаторов в разных средах указаны в пункте про ион H + . Щелочную среду имеют не только щелочи, но и растворы аммиака и аминов, растворы солей, образованных сильными основаниями и слабыми кислотами.
Если нужно определить щелочь, то к раствору надо добавить соль металла, образующего слабое основание. Щелочь с такой солью даст осадок гидроксида металла:
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Как можно заметить из уравнения (2), что до реакции, что после в растворе находятся ионы NO3 − и K + . Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H + и OH − в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Гидроксиду железа (III) соответствует в таблице растворимости обозначение «Н», что говорит нам о его нерастворимости, т.е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
2) Для уравнения:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
3) для уравнения:
Молекулы воды и аммиака запишутся целиком, а NH4NO3, KNO3 и KOH запишутся в ионном виде , т.к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
Полное и сокращенное уравнение будут иметь вид:
Видео:ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
🌟 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химия | Молекулярные и ионные уравненияСкачать

Реакции ионного обмена. 9 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Химические уравнения. Урок 15. Химия 7 классСкачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать