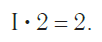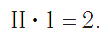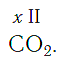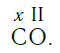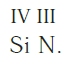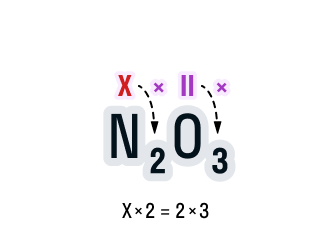В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
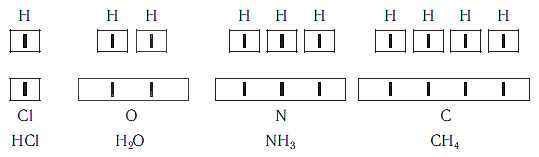
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
- Определение валентности
- Постоянная и переменная валентность
- Составление химических формул по валентности
- Уравнения по химии 8 класс с валентностью с ответами
- Определение возможной валентности элемента по его положению в таблице Менделеева
- Примеры определения валентности
- Валентность
- Понятие валентности
- Постоянная и переменная валентность
- Пример: как определить валентность по таблице Менделеева
- Как определить валентность химического элемента с переменной валентностью в соединении
- Как составить формулу химического соединения по значениям валентностей элементов
- Вопросы для самопроверки
- 📺 Видео
Видео:ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
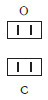
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
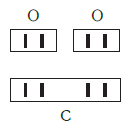
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Постоянная и переменная валентность
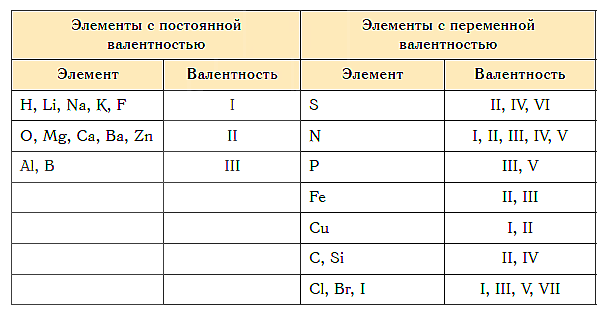
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Уравнения по химии 8 класс с валентностью с ответами
Для бинарных соединений, т. е. образованных двумя элементами типа 
Если в формуле бинарного соединения нет индексов, то валентности элементов одинаковые. Зная валентность одного элемента, можно написать валентность другого, например:
Если валентность одного элемента равна единице, то валентность другого элемента равна индексу при одновалентном элементе, например:
Определение возможной валентности элемента по его положению в таблице Менделеева
- Максимальная или высшая валентность элемента часто равна номеру группы таблицы Менделеева, в которой расположен элемент. (Группы элементов — это вертикальные столбцы в таблице.) Например, высшие валентности некоторых элементов следующие: Si(IV), P(V), S(VI), Cl(VII).
- У элементов V—VII групп в дополнение к высшей валентности, равной номеру группы, бывает другая валентность, представляющая разность: 8 — № группы, т. е. у фосфора Р(III), у серы S(II), у хлора Сl(I). Как правило, это низшая валентность.
Чтобы составить химическую формулу бинарного соединения, надо знать последовательность элементов в формуле (какой элемент первый) и их валентность.
Правила очередности элементов в формул е и проявляемая валентность следующие.
- 1) Первым записывают металл, за ним — неметалл: FeO, AI2O3, Cu2S.
- 2) Если в формуле одни неметаллы, то сначала пишут символ элемента, расположенного в таблице Менделеева левее и ниже: NO2, РСl5, CS2, НСl, SiF4, PBr3.
- 3) Обычно 1-й элемент в формуле бинарного соединения проявляет свою высшую (или большую) валентность, а 2-й элемент проявляет низшую валентность
Примеры определения валентности
Пример 1. Составьте формулу соединения (т.е. вещества) алюминия с кислородом (оксида алюминия).
Решение. Алюминий — металл, поэтому он 1-й в формуле: АlаОb. Валентности кислорода (II) и алюминия (III) — постоянные, следовательно, вид формулы:
Минимальные целые числа, удовлетворяющие равенству а • III = b • II, это а = 2, b = 3. Здесь валентность одного элемента равна индексу при другом элементе, х = b, у = а. Следовательно, искомая формула: Аl2O3.
Пример 2. Составьте формулу соединения серы с кислородом при условии, что сера проявляет свою высшую валентность.
Решение. Сера и кислород — неметаллы. В таблице Менделеева сера находится ниже кислорода, она 1-я в формуле SaOb. Высшая валентность серы равна номеру ее группы (VI) в таблице Менделеева:
Минимальные целые числа, удовлетворяющие равенству а • VI = b • II, это а = 1, b = 3. Здесь валентность одного элемента не равна индексу при другом элементе, х ≠ b, у ≠ а. Искомая формула: SO3.
Пример 3. Составьте формулу соединения серы с фосфором, в котором валентность фосфора — V.
Решение. Оба элемента S и Р — неметаллы. Первым в формуле записываем фосфор, так как он находится левее, чем сера, в таблице Менделеева: PaSb.
Валентность фосфора P(V) указана в задании. Сера (2-й элемент в формуле) проявляет свою низшую валентность S(II). Чтобы удовлетворялось равенство ах = by для соединения 
Пример 4. Составьте химические формулы бинарных соединений с кислородом (оксидов) следующих элементов: a) Li; б) Са; в) Sn(IV); г) С(II); д) Р(III); е) P(V).
Решение. Во всех этих формулах кислород — 2-й в формуле. Там, где валентности элементов нечетные, индекс при кислороде равен валентности соответствующего элемента, а индекс при элементе равен двум — валентности кислорода. В формулах оксидов веществ б) и г) индексов нет, т.к. валентности элементов одинаковые и равны II. В формуле оксида олова, чтобы суммарная валентность кислорода равнялась валентности олова, пишем при кислороде индекс «2». Формулы оксидов:
Конспект урока «Определение валентности на примерах».
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Валентность
О чем эта статья:
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Понятие валентности
Валентность — это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
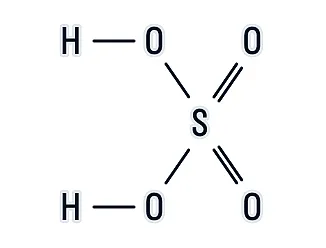
Рассмотрим структурную формулу H2SO4, с помощью которой можно определить, как атомы связаны между собой в веществе:
Исходя из структуры, можно сделать выводы:
атомы водорода H имеют одну химическую связь, то есть одновалентны;
сера S имеет шесть химических связей, то есть шестивалентна;
каждый атом кислорода O имеет две химические связи — двухвалентен.
Валентность обозначается римской цифрой над знаком химического элемента в формуле. Например:
Атом натрия имеет валентность, равную 1, а атом кислорода — равную 2.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Постоянная и переменная валентность
Среди всех элементов выделяют две группы: с постоянной и переменной валентностью.
У элементов с постоянной валентностью в любом соединении она одинакова. Эти элементы и проявляемую ими валентность придется выучить.
O, Be, Mg, Ca, Ba, Zn
Переменная валентность меняется в зависимости от соединения. Элементов с переменной валентностью большинство. Как правило, они характеризуются высшей, промежуточной и низшей валентностью:
высшая валентность для элементов главных подгрупп совпадает с номером группы (№гр);
низшая валентность вычисляется по формуле: 8 − №гр;
промежуточная валентность — число между низшей и высшей валентностью. Обычно промежуточные валентности соответствуют четности группы.
Пример: как определить валентность по таблице Менделеева
Сера S располагается в группе VIА таблицы Менделеева. Значит:
высшая валентность серы равна VI;
вычислим низшую валентность: 8 − 6 = 2. Низшая валентность равна II;
сера расположена в группе VI — это четное число. Значит, промежуточными валентностями будут все четные числа между низшей и высшей валентностью. В случае с серой между числами 2 и 6 расположено только одно четное число — 4. Промежуточная валентность серы — IV.
В таблице собрали все возможные валентности для некоторых химических элементов.
Видео:Как БЫСТРО определить ВАЛЕНТНОСТЬ #shorts #youtubeshortsСкачать

Как определить валентность химического элемента с переменной валентностью в соединении
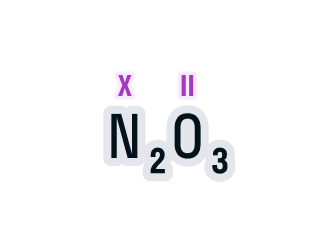
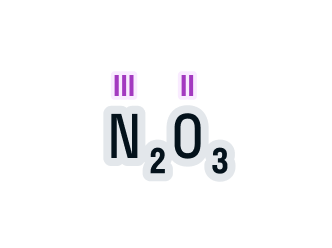
Определим валентность азота в соединении N2O3.
Над элементами с постоянной валентностью подпишем ее значение, в нашем случае это кислород:
Общее число валентностей каждого элемента в соединении должно совпадать. Находится общее число валентностей с помощью умножения валентности на число атомов данного химического элемента в соединении.
Считаем: общее число валентностей кислорода равно 2 · 3. Значит, общее число валентностей азота в данном соединении будет равно x · 2. Получаем уравнение: х · 2 = 2 · 3.
Вычислим х в получившемся уравнении:
Валентность азота в данном химическом соединении равна трем.
Встречаются бинарные соединения (то есть соединения, состоящие только из двух видов атомов), в которых неизвестны валентности обоих атомов элементов. Как найти валентности химических элементов в этом случае?
Для определения значения валентности необходимо запомнить, что неметаллы в бинарных соединениях, расположенные на втором месте, проявляют свою низшую валентность.
Например, в сульфидах (FeS) сера расположена на втором месте и проявляет низшую валентность, равную двум.
Тогда валентность железа в данном сульфиде можно рассчитать по приведенному выше алгоритму — ее значение равно двум.
В хлоридах (например, AgCl) хлор проявляет низшую валентность, равную единице.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Как составить формулу химического соединения по значениям валентностей элементов
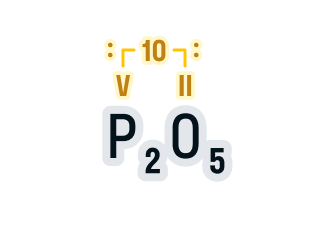
Составим формулу оксида фосфора (V).
Записываем обозначения элементов и над ними указываем валентности. Валентность фосфора в данном соединении указана в названии вещества (V), а валентность кислорода всегда равна II.
Находим НОК валентностей, в нашем случае 5 · 2 = 10. Для удобства запишем его над формулой:
Делим НОК на валентность каждого элемента, а результат записываем в индекс:
10 : 5 = 2 — индекс фосфора;
10 : 2 = 5 — индекс кислорода.
Видео:Валентность. Учимся определять валентность элементов по формуламСкачать

Вопросы для самопроверки
Что такое валентность в химии? Можно ли сказать, что валентность и степень окисления — это одно и то же?
Как узнать высшую и низшую валентность какого-либо химического элемента?
Назовите три химических элемента с валентностью, равной единице.
Среди перечисленных химических элементов выберите те, у которых валентность переменная: K, S, Al, Cu, Ca, P, Si, Mn, Mg, O.
Определите значения валентностей каждого химического элемента в следующих соединениях: FeCl3, Cl2O7, CuS, AlP.
Составьте химические формулы веществ:
Хлорид железа (II).
Оксид углерода (IV).
Верно ли, что значение высшей валентности химических элементов увеличивается по периоду слева направо в таблице Менделеева?
Тему «Валентность» проходят на уроках химии в 8-м классе, и без ее понимания сложно двигаться дальше, а уж тем более сдавать государственные экзамены. Онлайн-курс подготовки к ЕГЭ по химии от Skysmart поможет освежить знания за все годы школьной программы, заполнить пробелы и снять стресс перед экзаменом. Вводный урок бесплатный!
📺 Видео
ВАЛЕНТНОСТЬ | Как определить валентность | Как составить химическую формулу по валентностиСкачать

Составление уравнений реакций (по валентности). 8 класс.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химия 8 класс (Урок№6 - Валентность химических элементов. Определение валентности элементов.)Скачать

8 класс. Химия. ВалентностьСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Валентность. Часть 1. Учимся определять валентность элементов по формулам.Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Вся школьная четверть за 15 секунд #shorts #youtubeshorts #химияСкачать

Проклятая химическая реакция 😜 #shortsСкачать