- Химические свойства основных классов неорганических соединений
- Кислотные оксиды
- Основные оксиды
- Амфотерные оксиды
- Кислоты
- Амфотерные гидроксиды
- Щелочи
- Уравнения на химические свойства неорганических веществ
- Свойства неорганических веществ
- Теория к заданию 9 из ЕГЭ по химии
- Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
- Простые вещества — металлы
- 🎬 Видео
Химические свойства основных классов неорганических соединений
Кислотные оксиды
Кислотный оксид + вода = кислота (исключение — SiO 2 )
SO 3 + H 2 O = H 2 SO 4
Cl 2 O 7 + H 2 O = 2HClO 4
Кислотный оксид + щелочь = соль + вода
SO 2 + 2NaOH = Na 2 SO 3 + H 2 O
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
Кислотный оксид + основный оксид = соль
CO 2 + BaO = BaCO 3
SiO 2 + K 2 O = K 2 SiO 3
Основные оксиды
Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H 2 O = Ca(OH) 2
Na 2 O + H 2 O = 2NaOH
Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl 2 + H 2 O
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Основный оксид + кислотный оксид = соль
MgO + CO 2 = MgCO 3
Na 2 O + N 2 O 5 = 2NaNO 3
Амфотерные оксиды
Амфотерный оксид + кислота = соль + вода
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K 2 ZnO 2 + H 2 O (Правильнее: ZnO + 2KOH + H 2 O = K 2 [Zn(OH) 4 ])
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O (Правильнее: Al 2 O 3 + 2NaOH + 3H 2 O = 2Na[Al(OH) 4 ])
Амфотерный оксид + кислотный оксид = соль
ZnO + CO 2 = ZnCO 3
Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na 2 O = Na 2 ZnO 2
Al 2 O 3 + K 2 O = 2KAlO 2
Cr 2 O 3 + CaO = Ca(CrO 2 ) 2
Кислоты
Кислота + основный оксид = соль + вода
2HNO 3 + CuO = Cu(NO 3 ) 2 + H 2 O
3H 2 SO 4 + Fe 2 O 3 = Fe 2 (SO 4 ) 3 + 3H 2 O
Кислота + амфотерный оксид = соль + вода
3H 2 SO 4 + Cr 2 O 3 = Cr 2 (SO 4 ) 3 + 3H 2 O
2HBr + ZnO = ZnBr 2 + H 2 O
Кислота + основание = соль + вода
H 2 SiO 3 + 2KOH = K 2 SiO 3 + 2H 2 O
2HBr + Ni(OH) 2 = NiBr 2 + 2H 2 O
Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH) 3 = CrCl 3 + 3H 2 O
2HNO 3 + Zn(OH) 2 = Zn(NO 3 ) 2 + 2H 2 O
Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO 3 = CaBr 2 + H 2 O + CO 2
H 2 S + K 2 SiO 3 = K 2 S + H 2 SiO 3
2HCl + Zn = ZnCl 2 + H 2
H 2 SO 4 (разб.) + Fe = FeSO 4 + H 2
Важно: кислоты-окислители (HNO 3 , конц. H 2 SO 4 ) реагируют с металлами по-другому.
Амфотерные гидроксиды
Амфотерный гидроксид + кислота = соль + вода
2Al(OH) 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 6H 2 O
Be(OH) 2 + 2HCl = BeCl 2 + 2H 2 O
Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH) 2 + 2NaOH = Na 2 ZnO 2 + 2H 2 O
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O
Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
Sn(OH) 2 + 2NaOH = Na 2 [Sn(OH) 4 ]
Be(OH) 2 + 2NaOH = Na 2 [Be(OH) 4 ]
Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ]
Щелочи
Щелочь + кислотный оксид = соль + вода
Ba(OH) 2 + N 2 O 5 = Ba(NO 3 ) 2 + H 2 O
2NaOH + CO 2 = Na 2 СO 3 + H 2 O
Щелочь + кислота = соль + вода
3KOH + H 3 PO 4 = K 3 PO 4 + 3H 2 O
Bа(OH) 2 + 2HNO 3 = Ba(NO 3 ) 2 + 2H 2 O
Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na 2 ZnO 2 + H 2 O (Правильнее: 2NaOH + ZnO + H 2 O = Na 2 [Zn(OH) 4 ])
Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH) 2 = Na 2 [Zn(OH) 4 ]
NaOH + Al(OH) 3 = Na[Al(OH) 4 ]
Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH) 2 + Cu(NO 3 ) 2 = Cu(OH) 2 + Ca(NO 3 ) 2
3KOH + FeCl 3 = Fe(OH) 3 + 3KCl
Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H 2 O = Na 2 [Zn(OH) 4 ] + H 2
2KOH + 2Al + 6H 2 O = 2K[Al(OH) 4 ] + 3H 2
Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na 2 SiO 3 + 2HNO 3 = 2NaNO 3 + H 2 SiO 3
BaCO 3 + 2HCl = BaCl 2 + H 2 O + CO 2 (H 2 CO 3 )
Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO 3 ) 2 + K 2 S = PbS + 2KNO 3
СaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl
Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO 3 ) 2 + 2NaOH = 2NaNO 3 + Cu(OH) 2
2FeCl 3 + 3Ba(OH) 2 = 3BaCl 2 + 2Fe(OH) 3
Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO 4 = ZnSO 4 + Cu
Cu + 2AgNO 3 = Cu(NO 3 ) 2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Уравнения на химические свойства неорганических веществ
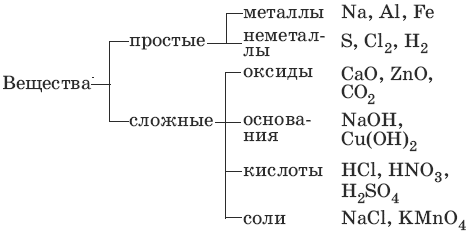
1. Основные классы неорганических соединений
Оксиды – сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента.
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N2O.
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Горение простых веществ:
Горение (обжиг) сложных веществ:
Разложение сложных веществ:
Химические свойства оксидов
Основным оксидам (Na2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н2O ? (оксиды остальных металлов нерастворимы)
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ? (амфотерные оксиды нерастворимы в воде)
ZnO + 2NaOH >t> Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе)
Основания – сложные вещества, состоящие из атомов металла и гидроксиль-ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH)3 – гидроксид железа(III).
– растворимые (щелочи) NaOH, KOH;
– однокислотные NaOH, KOH;
Получение нерастворимых и амфотер-ных оснований:
NaOH > Na + + OH? (? = 1, фенолфталеин – красный)
NaOH + HCl = NaCl + H2O (реакция нейтрализации)
Свойства нерастворимых оснований:
Fe(OH)2 — FeOH + + OH? (? + — Fe 2+ + OH? (? t> FeO + H2O
Свойства амфотерных оснований:
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.
Номенклатура кислот и кислотных остатков:
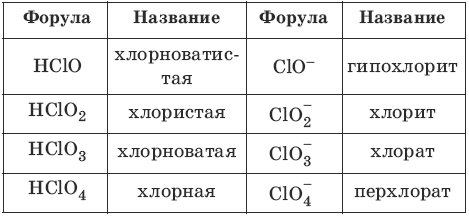
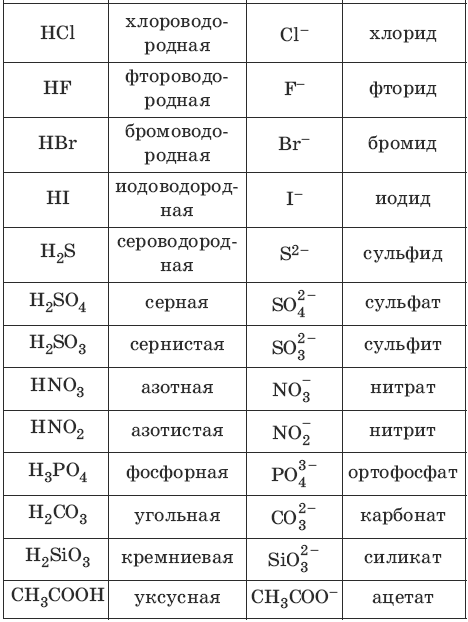
Химические свойства кислот
HCl > H + + CI? (? =1) (лакмус – красный)
HCO3? — H + + CO3 2- (? MgOH + + CI? (? = 1)
MgOH + — Mg 2+ + OH? (? Na + + Н + + SO4? (? = 1)
CuSO4 + Fe = Cu + FeSO4 (Fe до Cu в ряду напряжений)
Pb + ZnCl2 ? (Pb после Zn в ряду напряжений)
Разложение некоторых солей при нагревании
CaCO3 >t> CaO + CO2 (роме устойчивых карбонатов щелочных металлов)
2NaNO3 >t> 2NaNO2 + O2 (металл до Mg в ряду напряжений)
2Pb(NO3)2 >t> 2РbO + 4NO2 + O2 (металл от Mg до Cu в ряду напряжений)
2AgNO3 >t> 2Ag + 2NO2 + O2 (металл после Cu в ряду напряжений)
NH4Cl >t> NH3 + HCl (при охлаждении идет в противоположном направлении)
4KClO3 >400 °C> KCl + 3KClO4
Связь между классами соединений
Металл — основный оксид — основание — соль
Неметалл — кислотный оксид — кислота — соль
Атомы этих элементов имеют электронную формулу ns 1 . Они являются сильными восстановителями. Их активность растет от лития к цезию. Для них характерна степень окисления +1. В природе щелочные металлы находятся в виде хлоридов, сульфатов, карбонатов, силикатов и т. д.
Щелочные металлы мягкие, легко режутся ножом, на свежем срезе имеют серебристую окраску. Все они легкие и легкоплавкие металлы с хорошей электропроводностью. В парообразном состоянии атомы щелочных металлов образуют молекулы Э2, например Na2.
2.1. Получение и химические свойства щелочных металлов
2NaCl >электролиз расплава> 2Na + Cl2
KCl + Na >800?С> К + NaCl
Горение в кислороде
Реакции с другими неметаллами
Реакции с водой и разбавленными кислотами
2Na + 2HCl = 2NaCl + H2^
2.2. Получение и химические свойства соединений щелочных металлов
Оксиды. Оксиды щелочных металлов являются активными основными оксидами.
Гидроксиды. Гидроксиды щелочных металлов – растворимые основания, щелочи. Их степень диссоциации увеличивается от LiOH к CsOH.
NaOH > Na + + OH? (? ? 1)
Гидриды. Гидриды щелочных металлов – восстановители.
NaH + HCl = NaCl + H2
Пероксиды и надпероксиды. Являются окислителями.
Соли. Хорошо растворяются в воде. Соли лития окрашивают пламя горелки в карминово-красный цвет, соли натрия – в желтый цвет, соли калия – в светло-фиолетовый цвет. Соли щелочных металлов со слабыми кислотами гидролизуются, создавая щелочную среду.
Элементы IIА-группы имеют электронную формулу ns 2 . Все они являются металлами, сильными восстановителями, несколько менее активными, чем щелочные металлы. Для них характерна степень окисления +2 и валентность II. Щелочноземельные металлы: Са, Sr, Ba, Ra. В природе элементы IIА-группы находятся в виде солей: сульфатов, карбонатов, фосфатов, силикатов. Элементы IIА-группы представляют собой легкие серебристые металлы, более твердые, чем щелочные металлы.
3.1. Получение и химические свойства простых веществ
Элементы IIА-группы – менее активные восстановители, чем щелочные металлы. Их восстановительные свойства увеличиваются от бериллия к радию. Кислород воздуха окисляет Са, Sr, Ba, Ra при обычной температуре. Mg и Be покрыты оксидными пленками и окисляются кислородом только при нагревании:
3.2. Получение и химические свойства соединений
Оксид бериллия – амфотерный оксид. Оксид магния – нерастворимый основный оксид. Оксид кальция – растворимый основный оксид.
Гидроксид бериллия – амфотерное основание. Гидроксид магния – нерастворимое основание. Гидроксиды щелочноземельных металлов – щелочи.
Имеют восстановительные свойства.
Содержание ионов Са 2+ и Mg 2+ обуславливает жесткость воды: временную, если есть гидрокарбонаты Са и Mg, и постоянную, если в воде есть хлориды или сульфаты Са и Mg.
Элементы IIIА-группы имеют электронную формулу ns 2 np 1 . Они являются значительно менее активными восстановителями, чем щелочноземельные металлы. Для них характерна степень окисления +3 и валентность III. В группе сверху вниз возрастают металлические свойства элементов, увеличиваются восстановительные свойства их атомов. Увеличиваются основные свойства гидроксидов и уменьшаются их кислотные свойства.
Соединения Тl 3+ являются сильными окислителями и восстанавливаются до соединений Тl + .
4.1. Химические свойства бора и его соединений
4.2. Химические свойства алюминия и его соединений
4Al + 3O2 = 2Al2O3 (металл покрыт оксидной пленкой)
2Al + 6Н2O = 2Al(OH)3 + ЗН2 (без оксидной пленки)
Оксид алюминия – амфотерный оксид
Гидроксид алюминия – амфотерный гидроксид.
Соли алюминия гидролизуются. Некоторые из них (Al2S3, Al2(CO3)3) полностью разлагаются водой.
Элементы IVA-группы имеют электронную формулу ns 2 np 2 . Углерод и кремний являются неметаллами, германий, олово, свинец – металлами. Для элементов характерны степени окисления +4, +2, 0, -4 и валентность IV. В возбужденном состоянии атомы имеют конфигурацию ns 1 np s , в этом состоянии для них характерна sp 3 -гибридизация.
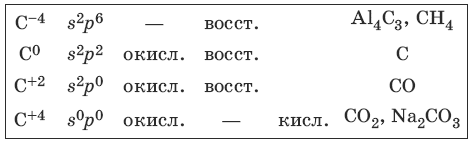
5.1. Свойства углерода и его соединений
Характерные степени окисления углерода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
С + CuO >t> Cu + CO
Свойства оксида углерода (II) – угарного газа
CO + NaOH >t, p> HCOONa
Свойства оксида углерода(IV) – углекислого газа
Свойства карбонатов и гидрокарбонатов
5.2. Получение и свойства кремния и его соединений
SiH4 + 2O2 = SiO2 + 2Н2O (самовоспламенение на воздухе)
Кремниевая кислота и силикаты. Кремниевая кислота имеет полимерное строение и состав xSiO2 • yH2O. H2SiO3 – условная формула, такого соединения не выделено.
5.3. Получение и свойства соединений олова и свинца
Гидроксиды олова и свинца имеют амфо-терные свойства. При этом в степени окисления элемента +2 в гидроксидах преобладают основные свойства, а в степени окисления +4 – кислотные. Соединения Sn 2+ имеют восстановительные свойства, а соединения РЬ 4+ – окислительные:
Элементы VA-группы имеют электронную формулу ns 2 np s . Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э2O5 имеют кислотные свойства, свойства оксидов Э2O3: кислотные – для N и Р, амфотерные – для As и Sb, основные – для Bi.
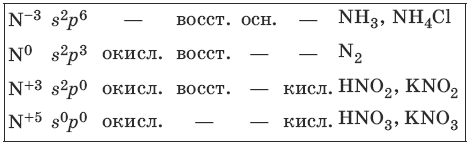
6.1. Получение и свойства азота и его соединений
Характерные степени окисления азота, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
HNO3(конц.) пассивирует на холоду Al, Fe, Cr.
2KNO3 >t> 2KNO2 + O2 (металлы до Mg в ряду напряжений)
2AgNO3 >t> 2Ag + 2NO2 + O2 (металлы после Cu в ряду напряжений)
6.2. Получение и свойства фосфора и его соединений
Простое вещество (Р4 – белый фосфор, Р – красный фосфор)
VIA-группу образуют четыре неметалла: кислород, сера, селен, теллур, называемые халькогенами, и радиоактивный металл полоний. Атомы элементов VIA-группы имеют электронную формулу ns 2 np 4 . Для них характерны степени окисления -2, 0, +4, +6. У атома кислорода отсутствуют 2d-орбитали, поэтому его валентность равна двум. Наличие d-орбиталей у атомов других элементов позволяет им иметь валентности два, четыре или шесть.
7.1. Кислород и его соединения
Кислород – самый распространенный элемент земной коры. Кислород представляет собой газ без цвета, без вкуса, без запаха. Возможные степени окисления кислорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства кислорода
Кислород может быть получен при сжижении и разделении воздуха.
Получение и свойства озона O3
Свойства пероксида водорода
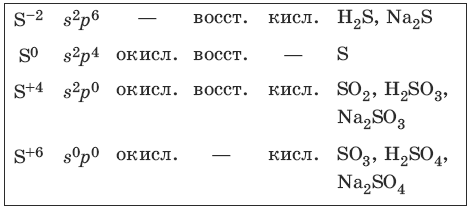
7.2. Сера и ее соединения
Характерные степени окисления серы, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
Чистая сера – хрупкое кристаллическое вещество желтого цвета. Сера имеет несколько модификаций: ромбоэдрическую и призматическую, также пластическую (аморфную). Аллотропия серы обусловлена различной структурой кристаллов, построенных из восьмиатомных молекул S8. В расплаве серы существуют молекулы S8, S6, в парах серы – молекулы S6, S4, S2.
Получение и свойства серы
Получение и свойства соединений серы (-2)
H2S — H + + HS? — 2H + + S 2-
Получение и свойства соединений серы (+4)
Получение и свойства соединений серы (+6)
Концентрированная серная кислота пассивирует на холоду Al, Fe, Cr.
Атомы галогенов, образующих VIIA-группу, имеют электронную конфигурацию ns 2 np 5 . Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F > Cl > Br > I > At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. F2 и Cl2 – газы, Br2 – жидкость, I2 – твердое вещество. С увеличением радиуса атомов галогенов растет объем их атомов и молекул, а также их поляризуемость. Это приводит к увеличению сил межмолекулярного взаимодействия (сил Ван дер Ваальса) и повышению температур плавления и кипения простых веществ.
HF, HCl, HBr, HI при растворении в воде образуют кислоты (HF – слабую, HCl, HBr и HI – сильные). В HF имеются сильные водородные связи. В ряду HCl – HBr – HI сила кислот несколько увеличивается в связи с увеличением поляризуемости молекул, пропорциональной их объему.
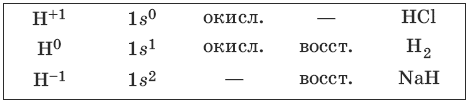
Электронная формула атома водорода 1s 1 . С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s 2 . Поэтому часто водород располагают вместе с галогенами в VIIA-группе.
8.1. Водород и его соединения
Водород – наиболее распространенный элемент во Вселенной. Водород – легкий газ без цвета, без запаха. Возможные степени окисления водорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те.
Кислород в молекуле воды находится в состоянии sp 3 -гибридизации, две связи О—Н и две неподеленные пары кислорода располагаются тетраэдрически, угол между связями О—Н равен 104,5°, поэтому молекула воды полярная. Вода является хорошим растворителем для веществ с ионными или полярными связями.
8.3. Фтор и его соединения
Фтор является наиболее активным неметаллом, сильным окислителем.
8.4. Хлор и его соединения
Хлор – тяжелый газ желто-зеленого цвета, с резким запахом.
2NaCl + 2Н2O >электролиз раствора> Н2 + Cl2 + 2NaOH
Cl2 + Н2O = HCl + HClO (реакция диспропорционирования)
HClO = HCl + О (атомарный кислород – окислитель)
Смесь CaCl2 и Са(ClO)2 – хлорная, или белильная, известь.
KClO3 – хлорат калия, или бертолетова соль.
Сила кислот растет в ряду:
8.5. Бром, иод и их соединения
Бром – темно-бурая жидкость с резким запахом, а иод – кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного – дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор > бром > иод.
В атомах d-элементов (переходных элементов) заполняется электронами d-под-уровень предвнешнего уровня. На внешнем уровне атомы d-элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро– и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент.
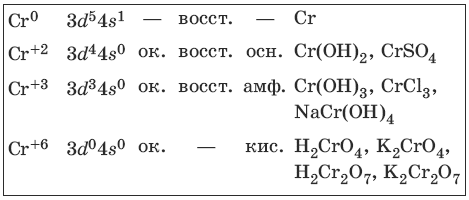
9.1. Хром и его соединения
Хром представляет собой ковкий тягучий металл серо-стального цвета. Электронная формула атома хрома 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 .
Характерные степени окисления хрома, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства хрома
FeO • Cr2O3 + 4CO >t> Fe + 2Cr + 4CO2 (Fe + 2Cr) – феррохром
Хром пассивируется на холоду концентрированными азотной и серной кислотами.
Свойства соединений хрома (+2) и хрома (+3)
Гидроксид хрома(II) сразу окисляется кислородом воздуха.
Свойства соединений хрома (+6)
Желтый раствор хромата калия устойчив в щелочной среде, оранжевый раствор дихромата калия – в кислой среде.
Дихромат калия – окислитель в кислой среде.
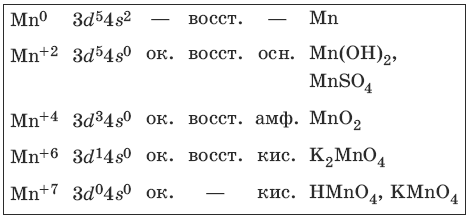
9.2. Марганец и его соединения
Марганец – серебристо-белый твердый и хрупкий металл. Характерные степени окисления марганца, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства марганца
FeO • Mn2O3 + 4CO >t> Fe + 2Mn + 4CO2 (Fe + 2Mn) – ферромарганец
Свойства соединений марганца (+2)
Свойства соединений марганца (+4)
MnO2 – устойчивый амфотерный оксид, сильный окислитель.
Свойства соединений марганца (+6)
Соединения устойчивы лишь в сильнощелочной среде.
Свойства соединений марганца (+7)
Сильные окислители в кислой среде.
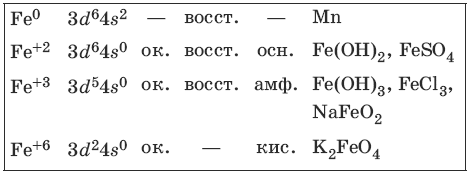
9.3. Железо и его соединения
Железо является вторым после алюминия металлом по распространенности в природе. Характерные степени окисления железа, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Соединения железа (+8) малохарактерны.
Получение и свойства железа
4Fe + 3O2 + 2Н2O = 4FeO(OH)v (коррозия на воздухе)
Концентрированные серная и азотная кислоты пассивируют железо на холоду. При нагревании реакция идет.
Свойства соединений железа (+2)
Гидроксид железа(II) сразу окисляется кислородом воздуха.
Свойства соединений железа (+3)
Fe(OH)3v + NaOH ? не идет в разбавленном растворе
Свойства соединений железа (+6)
Феррат калия – окислитель.
9.4. Медь и ее соединения
Медь – мягкий красный металл, хорошо проводит теплоту и электрический ток.
Получение и свойства меди
Свойства соединений меди(I)
Свойства соединений меди(II)
Cu(OH)2v + NaOH ? не идет в растворе
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Свойства неорганических веществ
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Теория к заданию 9 из ЕГЭ по химии
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно $100$ лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до $3000°С$; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
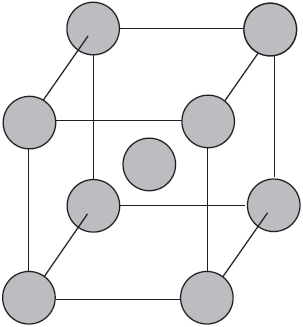
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: $1s^2s^2p^3s^3p^3d^$, где $3s, 3p, 3d$ — валентные орбитали.
Единственный валентный электрон атома натрия $3s^1$ может занимать любую из девяти свободных орбиталей — $3s$ (одна), $3р$ (три) и $3d$ (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
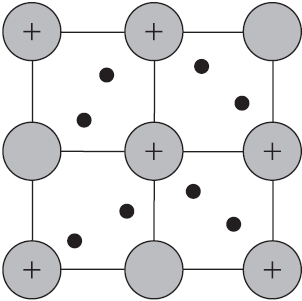
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
- $α$ — устойчива до $768°С$, ферромагнитная;
- $β$ — устойчива от $768$ до $910°С$, неферромагнитная, т.е. парамагнитная;
- $γ$ — устойчива от $910$ до $1390°С$, неферромагнитная, т.е. парамагнитная;
- $δ$ — устойчива от $1390$ до $1539°С$ ($t°_ железа), неферромагнитная.
Олово имеет две кристаллические модификации:
- $α$ — устойчива ниже $13,2°С$ ($ρ=5,75 г/см^3$). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
- $β$ — устойчива выше $13,2°С$ ($ρ=6,55 г/см^3$). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже $13,2°С$ он рассыпается в серый порошок, т.к. при переходе $β→α$ значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Наиболее пластичные металлы — это $Au, Ag, Sn, Pb, Zn$. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной $0,003$ мм, а из $0,5$ г этого металла можно вытянуть нить длиной $1$ км.
Даже ртуть, которая, как вы знаете, при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь $Bi$ и $Mn$, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы ($Li, K, Na, Rb, Cs$), атомы которых имеют один валентный электрон, мягкие, с небольшой плотностью (литий — самый легкий металл с $ρ=0,53 г/см^3$) и плавятся при невысоких температурах (например, температура плавления цезия $29°С$). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную $–38,9°С$.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с $s$-орбиталей.
Вспомните, что самый тяжелый металл — это осмий $Os$ с $ρ=22,5 г/см^3$ (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам $W$ с $t_=3420°С$ (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром $Cr$ (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
Напомним, что при рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп ($s-$ и $р-$элементы) и металлы побочных подгрупп (переходные $d-$ и $f-$элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
🎬 Видео
Химические свойства неорганических веществ: разбор задания 7 | ХИМИЯ ЕГЭ 2022Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Классификация неорганических веществСкачать

Химические свойства неорганических веществ (задание 8)Скачать

Химические свойства неорганических веществ: разбор задания 9 | ХИМИЯ ОГЭ 2022Скачать

Классификация неорганических веществ для ОГЭСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

ВСЕ неорганические реакции | ЕГЭ по Химии | Катя СтрогановаСкачать

Свойства неорганических веществ и РИО, Задание 6 ЕГЭ. | ЕГЭ по химии 2024Скачать

Химические свойства неорганических веществ: разбор задания 8 | ХИМИЯ ОГЭ 2022Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химия 9 класс (Урок№7 - Химические свойства основных классов неорганических соединений.)Скачать

8 класс. Составление уравнений химических реакций.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать