Для правильного проведения химических реакций важно знать, в каких условиях они протекают. Гомогенная среда реагентов позволяет определять скорость их взаимодействия. Существуют особые факторы, которые могут замедлять или ускорять гомогенные реакции.
- Классификация
- Гомогенная среда
- Определение гомогенных взаимодействий
- Гомогенные реакции, примеры уравнений
- Скорость реакций гомогенных
- Факторы, влияющие на скорость
- Классификация реакций
- Научная работа по химии на тему: Классификация химических реакций
- Охрана труда
- Охрана труда
- Библиотечно-библиографические и информационные знания в педагогическом процессе
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- 💡 Видео
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Классификация
Химические взаимодействия можно разделить на разные группы, благодаря присутствию большого числа критериев.
Существуют следующие признаки:
- Наличие раздела реакционной фазы. Реакции могут быть гомогенными или гетерогенными.
- Изменение окислительной степени реагирующих веществ.
- Выделение или поглощение тепла.
- Тип изменений реагирующих веществ, связанных с соединением, разложением, замещением или обменом.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гомогенная среда
Это однородная система, в которой химические и физические характеристики компонентов в любой ее точке постоянны, а если они изменяются, то в непрерывном темпе, без проявления резких скачков. Все ее части не имеют поверхностного разделения. Так протекают гомогенные химические реакции.
Наличие нескольких реагентов в однородной фазе нельзя визуально определить или отделить их механическим способом. Такая особенность возможна благодаря равномерному распределению составных частиц одного компонента в другом.
К примерам однородных фаз следует отнести газовые смеси, замерзшую воду, растворы в жидкой или твердой форме.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Определение гомогенных взаимодействий
Их еще называют гомофазными реакциями. Это процессы, протекающие в области одной однородной среды, а реагирующие компоненты и получаемые продукты находятся в неизменном состоянии.
Гомогенные реакции имеют величины, которые остаются в одинаковых показателях, а если они меняются, то с непрерывной скоростью.
Когда процессы проходят в области разделения двух фаз, то их называют гетерогенными.
Если реакции многостадийные, то они могут быть смешанного типа. В них начальные этапы протекают в гомогенной среде, а конечные процессы в гетерогенной фазе. Такие взаимодействия чаще всего происходят в природе.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Гомогенные реакции, примеры уравнений
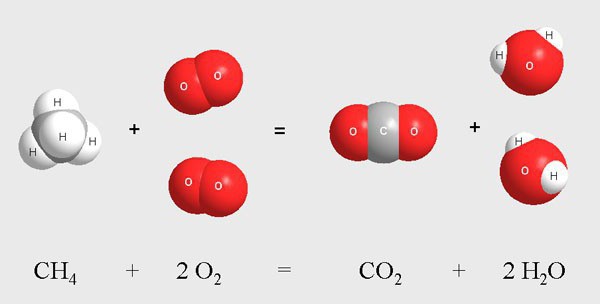
К ним относят процесс хлорирования молекул метана в газовой среде. Данная реакция протекает при высокой температуре или при воздействии ультрафиолета. В результате смешивания метана и хлора происходит поэтапное взаимодействие экзотермического типа.
Промежуточными продуктами являются газообразные вещества, к которым относят молекулы хлорметана, дихлорметана, трихлорметана, хлороводорода. Во время реакции происходит постепенное замещение атомов водорода в метане на атомы хлора. Конечным веществом служит четыреххлористый углерод.
Существуют и одноэтапные гомогенные реакции. Примеры таких взаимодействий указаны ниже.
К гомофазным процессам можно отнести:
- расщепление оксида пятивалентного азота в газовой среде под действием высокой температуры: N2O5↑ + N2O5↑ → NO2 + NO2 + NO2 + NO2 + O2;
- нейтрализацию раствором гидроксида натрия раствора соляной кислоты, с образованием раствора хлорида натрия и воды: HCl + NaOH → NaCl + H2O;
- этановое горение с выделением оксида четырехвалентного углерода и водяного пара: С2Н 6↑ + С2Н 6↑ + 7О2↑ → 4СО2↑ + 6Н2О↑;
- превращение молекулярного кислорода во время грозы в озон: 3О2↑ → 2О3↑.
Гомогенные реакции достаточно часто протекают в жидкой среде. К ним причисляют процессы галоидирования, расщепления всевозможных сложных соединений на более простые или на радикалы, замещение одних атомов другими по нуклеофильному или электрофильному типу, отщепление частей молекулы или их перегруппировка, удлинение цепочки за счет полимеризации, окислительное взаимодействие. В результате образуются жидкие продукты.
Видео:Реакции соединенияСкачать

Скорость реакций гомогенных
Протекание того или иного процесса может занимать разные временные промежутки. Важной характеристикой такого взаимодействия является скорость гомогенной реакции. Представляет она числовую величину, которая определяет изменение концентрации любого реагента за временной промежуток.
Ее можно охарактеризовать по-другому: как значение, устанавливающее перемену количества взаимодействующего компонента в заданном объеме за определенное время. Главным условием является отсутствие изменения массы в системе.
При расчете скорости реакции в гомогенной среде (обозначают как Vi) используют убыль или прирост молярного количества реагирующего вещества (Ci) за определенное время (t). Существует специальная формула расчета:
Для химического процесса HCl + NaOH → NaCl + H2O быстроту протекания можно определить по уменьшению концентрации каждого реагента (соляной кислоты или натрия гидроксида) или по увеличению количества продуктов превращения (натрия хлорида или воды) за временной промежуток при постоянных температурных условиях.
Для определения скорости гомогенных реакций концентрацию берут в молях на литр, а время измеряют в секундах. Расчет производится следующим образом:
Vi = ± Ci / t = − [HCl] / t = − [NaOH] / t = [NaCl] / t = [H2O] / t.
Видео:25. Схема реакции и химическое уравнениеСкачать

Факторы, влияющие на скорость
Гомогенной является реакция, у которой быстрота протекания данного процесса прямо пропорциональна заданному веществу в единице объема. Чем больше молекул задействовано, тем быстрее осуществляется взаимодействие.
Основными факторами, влияющими на скорость процессов в однородной среде, являются концентрация реагентов и продуктов реакции, их химическая природа, температурные условия, давление в реакционном объеме, а также наличие ускорителей, катализирующих изменения.
Зависимость быстроты протекания реакций от нагревания была установлена ученым Вант-Гоффом. Согласно его утверждению, каждое температурное повышение на 10° увеличивает в гомогенных реакциях скорость в 2 или 4 раза. В более теплой среде молекулы начинают активнее двигаться, сталкиваться друг с другом, что приводит к их взаимодействию.
Гомогенные реакции со временем протекают с разной интенсивностью, поэтому их скорости могут быть истинными (в определенный момент) и средними, что следует учитывать при расчетах.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
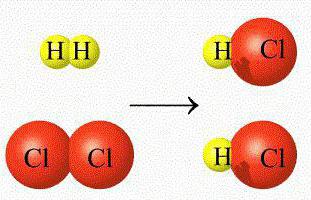
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
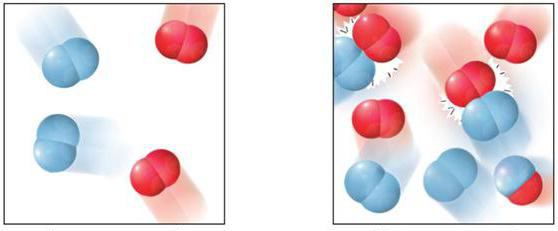
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Научная работа по химии на тему: Классификация химических реакций
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
1 ВАРИАНТ 1.Укажите схемы реакций соединения:
2.Укажите схемы реакций, для проведения которых обязательно используется катализатор:
3.Отметьте уравнения или схемы реакций разложения:
3) NaOH + HCl = NaCl + H2O;
3.Укажите уравнения или схемы реакций замещения:
4.Отметьте уравнения или схемы экзотермических реакций:
4) CaCO3 = CaO + CO2 + 157 кДж .
5.Укажите уравнения или схемы реакций обмена:
6.Число продуктов всегда меньше числа исходных веществ в случае реакций:
7.Отметьте уравнения или схемы окислительно-восстановительных реакций:
8.Укажите уравнения или схемы необратимых реакций:
3) NaOH + HCl = NaCl + H 2 O ;
9.Число продуктов всегда больше числа исходных веществ в случае реакций:
10.Окислительно-восстановительной в неорганической химии всегда является реакция:
2 ВАРИАНТ1.В неорганической химии реакция замещения протекает:
1) между двумя простыми веществами;
2) двумя сложными веществами;
3) простым и сложным веществами;
4) как двумя простыми, так и двумя сложными веществами.
2.Окислительно-восстановительными могут быть реакции:
3.Без изменения степени окисления атомов элементов всегда протекают реакции:
4.В реакцию обмена между собой могут вступать вещества:
1) простое и сложное;
4) как два простых, так и два сложных.
5.В результате реакции разложения могут образоваться:
1) только простые вещества;
2) только сложные вещества;
3) или только простые, или только сложные вещества;
4) одновременно простые и сложные вещества.
6. реакцию соединения между собой могут вступать вещества:
1) только простые;
2) только сложные;
3) как простые, так и сложные;
4) простое со сложным.
7.Укажите справедливые утверждения:
1) в результате реакции разложения образуется не более двух новых веществ;
2) в реакции обмена число различных по составу продуктов всегда равно числу различных по составу исходных веществ;
3) в реакции соединения число различных по составу исходных веществ всегда больше, чем продуктов;
4) в неорганических реакциях замещения число различных по составу исходных веществ равно числу различных по составу продуктов.
8.Укажите схему или уравнение окислительно-восстановительной реакции разложения:
9.Отметьте уравнения или схемы окислительно-восстановительных реакций соединения:
10.Укажите схемы или уравнения окислительно-восстановительных реакций замещения:
3-Вариант 1.Реакция НЕ может быть одновременно:
1) обмена и окислительно-восстановительной;
2) окислительно-восстановительной и разложения;
3) замещения и окислительно-восстановительной;
4) соединения и окислительно-восстановительной.
2.Гомогенными могут быть:
1) только реакции обмена;
2) только реакции соединения;
3) только реакции разложения;
4) все вышеназванные реакции, а также реакции замещения.
3.Одна и та же реакция может быть одновременно:
а) обратимой и экзотермической;
б) замещения и обмена;
в) обмена и разложения;
г) соединения и разложения..
4.Отметьте уравнения или схемы гомогенных реакций соединения:
4.Укажите уравнения или схемы гомогенных окислительно-восстановительных реакций разложения:
5.Отметьте уравнения или схемы гетерогенных окислительно-восстановительных реакций:
6.Укажите схемы или уравнения гомогенных экзотермических реакций обмена :
1) NaOH (p-p) + HCl (p-p) = NaOH (p-p) + H2O (ж) + Q;
7.Даны схемы (уравнения) реакций получения SO2. Из них гетерогенными окислительно-восстановительными будут реакции:
8.Даны реакции: а) обжиг пирита; б) обжиг известняка; в) фотосинтез; г) взаимодействие водных растворов сульфата натрия и хлорида бария. Окислительно-восстановительными из перечисленных будут реакции:
9.Для описания реакции нейтрализации подходят признаки:
1) всегда гомогенная;
3) продукты — как правило, соль и вода;
4) может быть гомогенной и гетерогенной.
10.Даны вещества, формулы которых Zn, ZnO, Zn(OH)2, ZnCO3, SO2. Укажите число веществ, которые могут реагировать с H2SO4 (разб.) по типу реакции обмена:
Курс повышения квалификации
Охрана труда
- Сейчас обучается 106 человек из 42 регионов
Курс профессиональной переподготовки
Охрана труда
- Сейчас обучается 228 человек из 54 регионов
Курс профессиональной переподготовки
Библиотечно-библиографические и информационные знания в педагогическом процессе
- Сейчас обучается 354 человека из 63 регионов
Ищем педагогов в команду «Инфоурок»
Видео:Габриелян О. С. 8 класс §31 "Реакции соединения".Скачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 567 578 материалов в базе
Другие материалы
- 31.12.2020
- 2836
- 0
- 31.12.2020
- 3540
- 1
- 31.12.2020
- 4079
- 0
- 31.12.2020
- 4522
- 9
- 31.12.2020
- 3892
- 0
- 31.12.2020
- 3766
- 0
- 31.12.2020
- 4457
- 0
- 31.12.2020
- 3888
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 15.07.2020 582
- DOCX 21.1 кбайт
- 2 скачивания
- Рейтинг: 1 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Колесникова Юлия Викторовна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 1 год и 1 месяц
- Подписчики: 0
- Всего просмотров: 26385
- Всего материалов: 229
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Реакции соединения 8 классСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Новые курсы: управление детским садом, коучинг, немецкий язык и другие
Время чтения: 18 минут
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Рособрнадзор не планирует переносить досрочный период ЕГЭ
Время чтения: 0 минут
ЕГЭ в 2022 году будут сдавать почти 737 тыс. человек
Время чтения: 2 минуты
Количество бюджетных мест в вузах по IT-программам вырастет до 160 тыс.
Время чтения: 2 минуты
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
💡 Видео
Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Как составлять УРАВНЕНИЯ РЕАКЦИЙ | БИНАРНЫЕ СОЕДИНЕНИЯ | ХИМИЧЕСКИЕ УРАВНЕНИЯСкачать

Скорость химических реакций. Гомогенные и гетерогенные реакции. Химия 8 классСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Гомогенные и гетерогенные реакции. Самоподготовка к ЕГЭ и ЦТ по химииСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

8 класс - Химия - Гомогенные и гетерогенные химические реакции. Скорость химической реакции. Часть 2Скачать

Все типы химических реакций на ОГЭ по химии | Это попадется на экзамене | Химия ОГЭ 2023 | УмскулСкачать

Химические уравнения. Как составлять химические уравнения.Скачать