1. Основные классы неорганических соединений
Оксиды – сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента.
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N2O.
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Горение простых веществ:
Горение (обжиг) сложных веществ:
Разложение сложных веществ:
Химические свойства оксидов
Основным оксидам (Na2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н2O ? (оксиды остальных металлов нерастворимы)
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ? (амфотерные оксиды нерастворимы в воде)
ZnO + 2NaOH >t> Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе)
Основания – сложные вещества, состоящие из атомов металла и гидроксиль-ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH)3 – гидроксид железа(III).
– растворимые (щелочи) NaOH, KOH;
– однокислотные NaOH, KOH;
Получение нерастворимых и амфотер-ных оснований:
NaOH > Na + + OH? (? = 1, фенолфталеин – красный)
NaOH + HCl = NaCl + H2O (реакция нейтрализации)
Свойства нерастворимых оснований:
Fe(OH)2 — FeOH + + OH? (? + — Fe 2+ + OH? (? t> FeO + H2O
Свойства амфотерных оснований:
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.
Номенклатура кислот и кислотных остатков:


Химические свойства кислот
HCl > H + + CI? (? =1) (лакмус – красный)
HCO3? — H + + CO3 2- (? MgOH + + CI? (? = 1)
MgOH + — Mg 2+ + OH? (? Na + + Н + + SO4? (? = 1)
CuSO4 + Fe = Cu + FeSO4 (Fe до Cu в ряду напряжений)
Pb + ZnCl2 ? (Pb после Zn в ряду напряжений)
Разложение некоторых солей при нагревании
CaCO3 >t> CaO + CO2 (роме устойчивых карбонатов щелочных металлов)
2NaNO3 >t> 2NaNO2 + O2 (металл до Mg в ряду напряжений)
2Pb(NO3)2 >t> 2РbO + 4NO2 + O2 (металл от Mg до Cu в ряду напряжений)
2AgNO3 >t> 2Ag + 2NO2 + O2 (металл после Cu в ряду напряжений)
NH4Cl >t> NH3 + HCl (при охлаждении идет в противоположном направлении)
4KClO3 >400 °C> KCl + 3KClO4
Связь между классами соединений
Металл — основный оксид — основание — соль
Неметалл — кислотный оксид — кислота — соль
Атомы этих элементов имеют электронную формулу ns 1 . Они являются сильными восстановителями. Их активность растет от лития к цезию. Для них характерна степень окисления +1. В природе щелочные металлы находятся в виде хлоридов, сульфатов, карбонатов, силикатов и т. д.
Щелочные металлы мягкие, легко режутся ножом, на свежем срезе имеют серебристую окраску. Все они легкие и легкоплавкие металлы с хорошей электропроводностью. В парообразном состоянии атомы щелочных металлов образуют молекулы Э2, например Na2.
2.1. Получение и химические свойства щелочных металлов
2NaCl >электролиз расплава> 2Na + Cl2
KCl + Na >800?С> К + NaCl
Горение в кислороде
Реакции с другими неметаллами
Реакции с водой и разбавленными кислотами
2Na + 2HCl = 2NaCl + H2^
2.2. Получение и химические свойства соединений щелочных металлов
Оксиды. Оксиды щелочных металлов являются активными основными оксидами.
Гидроксиды. Гидроксиды щелочных металлов – растворимые основания, щелочи. Их степень диссоциации увеличивается от LiOH к CsOH.
NaOH > Na + + OH? (? ? 1)
Гидриды. Гидриды щелочных металлов – восстановители.
NaH + HCl = NaCl + H2
Пероксиды и надпероксиды. Являются окислителями.
Соли. Хорошо растворяются в воде. Соли лития окрашивают пламя горелки в карминово-красный цвет, соли натрия – в желтый цвет, соли калия – в светло-фиолетовый цвет. Соли щелочных металлов со слабыми кислотами гидролизуются, создавая щелочную среду.
Элементы IIА-группы имеют электронную формулу ns 2 . Все они являются металлами, сильными восстановителями, несколько менее активными, чем щелочные металлы. Для них характерна степень окисления +2 и валентность II. Щелочноземельные металлы: Са, Sr, Ba, Ra. В природе элементы IIА-группы находятся в виде солей: сульфатов, карбонатов, фосфатов, силикатов. Элементы IIА-группы представляют собой легкие серебристые металлы, более твердые, чем щелочные металлы.
3.1. Получение и химические свойства простых веществ
Элементы IIА-группы – менее активные восстановители, чем щелочные металлы. Их восстановительные свойства увеличиваются от бериллия к радию. Кислород воздуха окисляет Са, Sr, Ba, Ra при обычной температуре. Mg и Be покрыты оксидными пленками и окисляются кислородом только при нагревании:
3.2. Получение и химические свойства соединений
Оксид бериллия – амфотерный оксид. Оксид магния – нерастворимый основный оксид. Оксид кальция – растворимый основный оксид.
Гидроксид бериллия – амфотерное основание. Гидроксид магния – нерастворимое основание. Гидроксиды щелочноземельных металлов – щелочи.
Имеют восстановительные свойства.
Содержание ионов Са 2+ и Mg 2+ обуславливает жесткость воды: временную, если есть гидрокарбонаты Са и Mg, и постоянную, если в воде есть хлориды или сульфаты Са и Mg.
Элементы IIIА-группы имеют электронную формулу ns 2 np 1 . Они являются значительно менее активными восстановителями, чем щелочноземельные металлы. Для них характерна степень окисления +3 и валентность III. В группе сверху вниз возрастают металлические свойства элементов, увеличиваются восстановительные свойства их атомов. Увеличиваются основные свойства гидроксидов и уменьшаются их кислотные свойства.
Соединения Тl 3+ являются сильными окислителями и восстанавливаются до соединений Тl + .
4.1. Химические свойства бора и его соединений
4.2. Химические свойства алюминия и его соединений
4Al + 3O2 = 2Al2O3 (металл покрыт оксидной пленкой)
2Al + 6Н2O = 2Al(OH)3 + ЗН2 (без оксидной пленки)
Оксид алюминия – амфотерный оксид
Гидроксид алюминия – амфотерный гидроксид.
Соли алюминия гидролизуются. Некоторые из них (Al2S3, Al2(CO3)3) полностью разлагаются водой.
Элементы IVA-группы имеют электронную формулу ns 2 np 2 . Углерод и кремний являются неметаллами, германий, олово, свинец – металлами. Для элементов характерны степени окисления +4, +2, 0, -4 и валентность IV. В возбужденном состоянии атомы имеют конфигурацию ns 1 np s , в этом состоянии для них характерна sp 3 -гибридизация.
5.1. Свойства углерода и его соединений
Характерные степени окисления углерода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
С + CuO >t> Cu + CO
Свойства оксида углерода (II) – угарного газа
CO + NaOH >t, p> HCOONa
Свойства оксида углерода(IV) – углекислого газа
Свойства карбонатов и гидрокарбонатов
5.2. Получение и свойства кремния и его соединений
SiH4 + 2O2 = SiO2 + 2Н2O (самовоспламенение на воздухе)
Кремниевая кислота и силикаты. Кремниевая кислота имеет полимерное строение и состав xSiO2 • yH2O. H2SiO3 – условная формула, такого соединения не выделено.
5.3. Получение и свойства соединений олова и свинца
Гидроксиды олова и свинца имеют амфо-терные свойства. При этом в степени окисления элемента +2 в гидроксидах преобладают основные свойства, а в степени окисления +4 – кислотные. Соединения Sn 2+ имеют восстановительные свойства, а соединения РЬ 4+ – окислительные:
Элементы VA-группы имеют электронную формулу ns 2 np s . Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э2O5 имеют кислотные свойства, свойства оксидов Э2O3: кислотные – для N и Р, амфотерные – для As и Sb, основные – для Bi.
6.1. Получение и свойства азота и его соединений
Характерные степени окисления азота, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
HNO3(конц.) пассивирует на холоду Al, Fe, Cr.
2KNO3 >t> 2KNO2 + O2 (металлы до Mg в ряду напряжений)
2AgNO3 >t> 2Ag + 2NO2 + O2 (металлы после Cu в ряду напряжений)
6.2. Получение и свойства фосфора и его соединений
Простое вещество (Р4 – белый фосфор, Р – красный фосфор)
VIA-группу образуют четыре неметалла: кислород, сера, селен, теллур, называемые халькогенами, и радиоактивный металл полоний. Атомы элементов VIA-группы имеют электронную формулу ns 2 np 4 . Для них характерны степени окисления -2, 0, +4, +6. У атома кислорода отсутствуют 2d-орбитали, поэтому его валентность равна двум. Наличие d-орбиталей у атомов других элементов позволяет им иметь валентности два, четыре или шесть.
7.1. Кислород и его соединения
Кислород – самый распространенный элемент земной коры. Кислород представляет собой газ без цвета, без вкуса, без запаха. Возможные степени окисления кислорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства кислорода
Кислород может быть получен при сжижении и разделении воздуха.
Получение и свойства озона O3
Свойства пероксида водорода
7.2. Сера и ее соединения
Характерные степени окисления серы, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
Чистая сера – хрупкое кристаллическое вещество желтого цвета. Сера имеет несколько модификаций: ромбоэдрическую и призматическую, также пластическую (аморфную). Аллотропия серы обусловлена различной структурой кристаллов, построенных из восьмиатомных молекул S8. В расплаве серы существуют молекулы S8, S6, в парах серы – молекулы S6, S4, S2.
Получение и свойства серы
Получение и свойства соединений серы (-2)
H2S — H + + HS? — 2H + + S 2-
Получение и свойства соединений серы (+4)
Получение и свойства соединений серы (+6)
Концентрированная серная кислота пассивирует на холоду Al, Fe, Cr.
Атомы галогенов, образующих VIIA-группу, имеют электронную конфигурацию ns 2 np 5 . Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F > Cl > Br > I > At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. F2 и Cl2 – газы, Br2 – жидкость, I2 – твердое вещество. С увеличением радиуса атомов галогенов растет объем их атомов и молекул, а также их поляризуемость. Это приводит к увеличению сил межмолекулярного взаимодействия (сил Ван дер Ваальса) и повышению температур плавления и кипения простых веществ.
HF, HCl, HBr, HI при растворении в воде образуют кислоты (HF – слабую, HCl, HBr и HI – сильные). В HF имеются сильные водородные связи. В ряду HCl – HBr – HI сила кислот несколько увеличивается в связи с увеличением поляризуемости молекул, пропорциональной их объему.
Электронная формула атома водорода 1s 1 . С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s 2 . Поэтому часто водород располагают вместе с галогенами в VIIA-группе.
8.1. Водород и его соединения
Водород – наиболее распространенный элемент во Вселенной. Водород – легкий газ без цвета, без запаха. Возможные степени окисления водорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те.
Кислород в молекуле воды находится в состоянии sp 3 -гибридизации, две связи О—Н и две неподеленные пары кислорода располагаются тетраэдрически, угол между связями О—Н равен 104,5°, поэтому молекула воды полярная. Вода является хорошим растворителем для веществ с ионными или полярными связями.
8.3. Фтор и его соединения
Фтор является наиболее активным неметаллом, сильным окислителем.
8.4. Хлор и его соединения
Хлор – тяжелый газ желто-зеленого цвета, с резким запахом.
2NaCl + 2Н2O >электролиз раствора> Н2 + Cl2 + 2NaOH
Cl2 + Н2O = HCl + HClO (реакция диспропорционирования)
HClO = HCl + О (атомарный кислород – окислитель)
Смесь CaCl2 и Са(ClO)2 – хлорная, или белильная, известь.
KClO3 – хлорат калия, или бертолетова соль.
Сила кислот растет в ряду:
8.5. Бром, иод и их соединения
Бром – темно-бурая жидкость с резким запахом, а иод – кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного – дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор > бром > иод.
В атомах d-элементов (переходных элементов) заполняется электронами d-под-уровень предвнешнего уровня. На внешнем уровне атомы d-элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро– и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент.
9.1. Хром и его соединения
Хром представляет собой ковкий тягучий металл серо-стального цвета. Электронная формула атома хрома 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 .
Характерные степени окисления хрома, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства хрома
FeO • Cr2O3 + 4CO >t> Fe + 2Cr + 4CO2 (Fe + 2Cr) – феррохром
Хром пассивируется на холоду концентрированными азотной и серной кислотами.
Свойства соединений хрома (+2) и хрома (+3)
Гидроксид хрома(II) сразу окисляется кислородом воздуха.
Свойства соединений хрома (+6)
Желтый раствор хромата калия устойчив в щелочной среде, оранжевый раствор дихромата калия – в кислой среде.
Дихромат калия – окислитель в кислой среде.
9.2. Марганец и его соединения
Марганец – серебристо-белый твердый и хрупкий металл. Характерные степени окисления марганца, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства марганца
FeO • Mn2O3 + 4CO >t> Fe + 2Mn + 4CO2 (Fe + 2Mn) – ферромарганец
Свойства соединений марганца (+2)
Свойства соединений марганца (+4)
MnO2 – устойчивый амфотерный оксид, сильный окислитель.
Свойства соединений марганца (+6)
Соединения устойчивы лишь в сильнощелочной среде.
Свойства соединений марганца (+7)
Сильные окислители в кислой среде.
9.3. Железо и его соединения
Железо является вторым после алюминия металлом по распространенности в природе. Характерные степени окисления железа, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Соединения железа (+8) малохарактерны.
Получение и свойства железа
4Fe + 3O2 + 2Н2O = 4FeO(OH)v (коррозия на воздухе)
Концентрированные серная и азотная кислоты пассивируют железо на холоду. При нагревании реакция идет.
Свойства соединений железа (+2)
Гидроксид железа(II) сразу окисляется кислородом воздуха.
Свойства соединений железа (+3)
Fe(OH)3v + NaOH ? не идет в разбавленном растворе
Свойства соединений железа (+6)
Феррат калия – окислитель.
9.4. Медь и ее соединения
Медь – мягкий красный металл, хорошо проводит теплоту и электрический ток.
Получение и свойства меди
Свойства соединений меди(I)
Свойства соединений меди(II)
Cu(OH)2v + NaOH ? не идет в растворе
- Как решать химические уравнения — схемы и примеры решения для разных реакций
- Основные термины и понятия
- Виды химических реакций
- Окислительно-восстановительный процесс
- Классический алгоритм
- Решение методом полуреакций
- Использование онлайн-расчёта
- Формулы веществ и уравнения химических реакций
- Формулы веществ и уравнения химических реакций
- Расчёты по химическим формулам
- Составление уравнений химических реакций
- Алгоритм составления уравнений реакций
- Закон сохранения массы веществ
- Значение закона сохранения массы веществ
- Соотношение масс реагирующих веществ. Закон постоянства состава
- Типы химических реакций
- Химические реакции в природе и жизнедеятельности живых организмов и человека
- Химия в живых организмах
- Химия в быту
- 🎬 Видео
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как решать химические уравнения — схемы и примеры решения для разных реакций
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Видео:Все типы химических реакций на ОГЭ по химии | Это попадется на экзамене | Химия ОГЭ 2023 | УмскулСкачать

Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
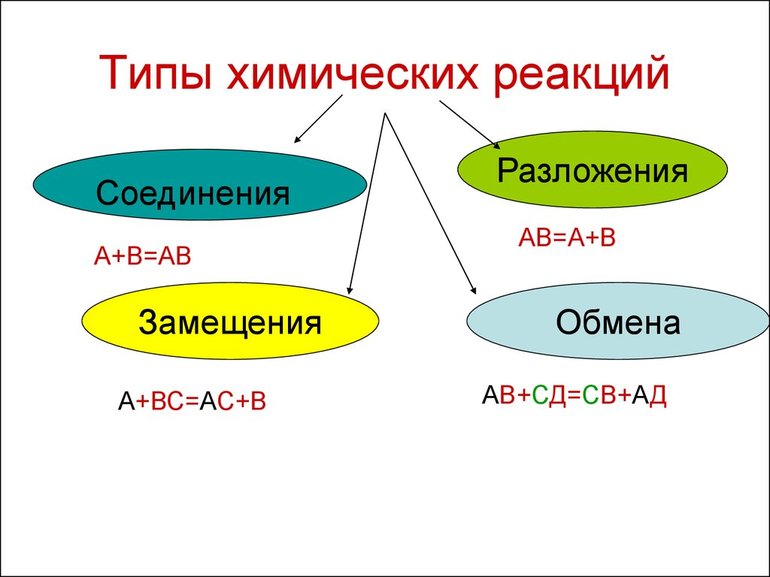
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Видео:ВСЕ неорганические реакции | ЕГЭ по Химии | Катя СтрогановаСкачать

Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Формулы веществ и уравнения химических реакций
Содержание:
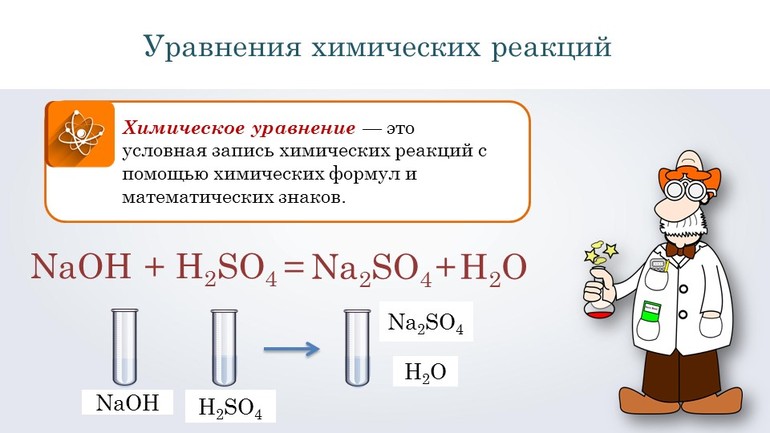
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов. Уравнение химической реакции даёт качественную и количественную информацию о химической реакции.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Формулы веществ и уравнения химических реакций
Химическая реакция — это превращение одних веществ в другие. Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие превращения химическими не называют. В чем же здесь дело? В ядерном реакторе происходят ядерные реакции. Они заключаются в том, что ядра элементов при столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и ядра иных элементов) — разбиваются на осколки, представляющие собой ядра других элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают электроны из окружающей среды и, таким образом, завершается образование двух или нескольких новых веществ. Все эти вещества являются какими-либо элементами Периодической системы.
В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Расчёты по химическим формулам
По химическим формулам веществ можно производить различные расчеты:
1. Определение численного соотношения атомов.
Для молекулы SO3 численное соотношение атомов составляет 1 : 3, а для

2. Определение относительной молекулярной массы вещества.
3. Расчет массы одной молекулы вещества.
Для молекулы
4. Определение массовых отношений химических элементов в сложном
веществе.
Для молекулы 
5. Расчет массы элемента по известной массе вещества и обратная задача.
а) Сколько граммов меди содержится в 320 г оксида меди (II)?

б) В какой массе карбоната кальция 
6. Расчет массовой доли химического элемента в сложном веществе.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля 


n – число атомов элемента (Э) в молекуле вещества;

Массовые доли обычно выражаются в процентах:
Пример: Рассчитать массовые доли водорода и кислорода в воде

Если вещество состоит из трех элементов, для определения массовой доли третьего элемента можно определить массовые доли двух элементов, затем их сумму отнять от 100%.
6. Составление формул по соотношению масс и массовых долей элементов в молекуле.
а) Выведите формулу вещества, если соотношение масс элементов
m (S) : m (O) = 2 : 3.


x (S) = 2 : 32 = 0,0625
y (О) = 3 : 16 = 0,1875


Поскольку в молекулах не может быть дробных чисел атомов, то делением на наименьшее значение или умножением на какое-то число превращаем дробные числа в целое число:


б) Составьте формулу вещества, если массовые доли элементов в соединении таковы:





Массовая доля элементов в веществе, массовые соотношения атомов, соотношения чисел атомов.
Составление уравнений химических реакций
Химические формулы, индексы, химические реакции
Используя различные слова, мы составляем предложения. Используя формулы веществ, составляем уравнения реакций. Химическое уравнение –условная запись химической реакции с помощью химических формул и знаков. По уравнениям реакций можно определить, в каких количественных отношениях реагируют вещества и сколько продуктов при этом образуется. Вещества, вступающие в реакцию, называются реагентами. Образующиеся при этом вещества называются продуктами.
Алгоритм составления уравнений реакций
1. Записываем схему уравнения реакции: формулы вступающих в реакцию веществ – слева, а образовавшихся – справа.
2. Уравнения реакций отличаются от схем этих же реакций. Например, горение железа в кислороде записывается в виде схемы:
3. В уравнениях реакций число атомов реагирующих веществ должно быть равно числу атомов продуктов реакций. Поэтому в схемах реакций перед формулами веществ ставятся коэффициенты. Подбираем коэффициенты, чтобы число атомов каждого элемента в левой и правой частях равенства было одинаковым. Коэффициент 1 не ставится. Вначале уравниваем число атомов кислорода. Для этого находим наименьшее кратное число для атомов кислорода до и после реакции: 2 · 3 = 6. Делением этого числа на число атомов кислорода находим коэффициенты в левой части – 6 : 2 = 3; затем в правой части – 6 : 3 = 2.
4. Теперь уравниваем число атомов железа и, наконец, заменяем стрелку на знак равенства:
Коэффициенты перед формулами веществ в химических уравнениях называются стехиометрическими коэффициентами.
В полученном уравнении число атомов каждого элемента в левой части равно числу тех же атомов в правой части. Уравнение читается так: 4 атома железа плюс 3 молекулы кислорода равны 2 молекулам оксида железа (III).
При записи химического уравнения подбираются только коэффициенты, а индексы в формулах менять нельзя, так как нельзя произвольно менять состав вещества.
По уравнениям реакций можно получить следующие сведения:
1) качественный состав реагирующих и образовавшихся веществ 
2) соотношения коэффициентов перед формулами: 
3) соотношения масс веществ:
Уравнения реакции, реагенты, продукты, коэффициенты.
Закон сохранения массы веществ
При химических реакциях происходит распад молекул реагирующих
веществ, осуществляется перегруппировка атомов и групп атомов, образуются молекулы продуктов реакции. В результате реакций число атомов не изменяется, поэтому не должны изменяться и массы этих атомов.
Рассмотрим реакцию горения магния:
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
В этом и состоит закон сохранения массы. Закон был открыт опытным путем в 1748 г. русским ученым М. В. Ломоносовым. Позднее, в 1789 г., французский ученый А. Лавуазье пришел к такому же выводу независимо от М. В. Ломоносова. Закон сохранения массы веществ имеет огромное значение для естественных наук.
Значение закона сохранения массы веществ
- 1. Открытие закона способствовало дальнейшему развитию химии.
- 2. Все расчетные задачи в химии решаются на его основе. Все химические уравнения составляются на основании этого закона.
- 3. Этот закон является одним из проявлений общего закона природы: вещество не исчезает бесследно и не образуется из ничего.
Закон сохранения массы веществ.
Демонстрация №1
Опыт, доказывающий закон сохранения массы веществ
Цель: Знать закон сохранения массы веществ и доказать это опытным путём.
Проведите реакцию карбоната кальция с соляной кислотой. Для этого предварительно взвесьте колбу с кислотой, а также шарик на весах (рис. 9). Насыпьте 1 г карбоната
кальция в шарик. Затем наденьте его на колбу. Закрепите скотчем. Поднимите надувной шарик, чтобы весь карбонат высыпался в колбу. После проведения реакции взвесьте.
Сделайте выводы.
Соотношение масс реагирующих веществ. Закон постоянства состава
Состав вещества можно выразить числом атомов или массовым отношением атомов в молекуле. Например, для молекулы 
= 1 : 2, а массовые отношения элементов m (C) : m (O) = 12 : 32 = 3 : 8. Или можно взять отношения массовых долей элементов:
Углекислый газ выделяется при горении топлива, при разложении некоторых сложных веществ или в результате дыхания.
Как вы видите, в молекуле 

Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
В настоящее время известны вещества с переменным составом, с ними вы познакомитесь позднее.
В формулах веществ молекулярного строения индекс указывает на количество химического элемента в молекуле вещества.
На основе закона постоянства состава вещества можно производить различные расчеты. Рассмотрим следующий пример:
При взаимодействии меди с серой образуется 1 моль сульфида меди (II):
m (Cu) : m (S) = 64 : 32 = 2 : 1
Значит, из 2 г Cu и 1 г S образуется сульфид меди (ІІ).
Проведем два опыта.
1. Возьмем смесь, состоящую из 5 г меди и 2 г серы. После нагревания получим смесь сульфида меди с медью, так как 1 г меди находится в избытке. В смеси содержится 6 г CuS и 1 г Сu.
2. Теперь возьмем по 4 г меди и серы. В этом случае после нагревания образуется смесь сульфида меди и серы, так как 2 г серы остаются неизрасходованными и образуется 6 г сульфида меди.
Проверим результаты опытов математическим путем.
Для первого опыта:


m(Cu) + m(S) = 4 + 2 = 6 г.

Для второго опыта:

По условию задачи было взято 4 г серы, значит, масса оставшейся
серы:
4 – 2 = 2 г S в избытке.

По закону сохранения массы веществ 4 г Cu взаимодействует с 2 г S с образованием 6 г CuS.

Соотношение масс реагирующих веществ, закон постоянства состава.
Лабораторный опыт №2
І вариант.
Цель: определить опытным путем соотношение масс реагирующих веществ, доказать правильность закона постоянства состава и закона сохранения масс.
Ход работы
1. Налейте во все пробирки, закрепленные в штативах, по 5 мл раствора
гидроксида натрия.
2. С помощью бюретки налейте определенные объемы раствора сульфата
меди в таком порядке: 1 мл, 1,5 мл, 2 мл, 2,5 мл, 3 мл, 3,5 мл, 4 мл.
3. Через некоторое время в некоторых пробирках образуется осадок, и
надо дать ему отстояться.
4. Заполните таблицу. Высота осадка будет измеряться линейкой.
Вопросы и задания:
1. Напишите уравнение реакции.
2. Какое объемное отношение растворов достаточно для образования осадка?
3. Определите массовые отношения исходных веществ.
4. Сделайте выводы: выполняется ли закон постоянства состава и закон сохранения масс.
ІІ вариант.
Цель: определять опытным путем соотношение масс реагирующих веществ.
Ход работы
1. Напишите уравнение реакции взаимодействия железа с серой:
2. Определить соотношение масс реагирующих веществ:
m (Fe) : m (S) = 56 : 32 = 7 : 4
3. Для удобства и экономии реагентов можно брать исходные вещества в соотношении 3,5 : 2, т. е. на технических весах взвесить 3,5 г железа и 2 г серы.
4. Закрепить тигель на кольце штатива, нагреть, перемешивая стеклянной палочкой взвешенные железо и серу до образования однородной темной массы сульфида железа (ІІ) (рис. 10).
Типы химических реакций
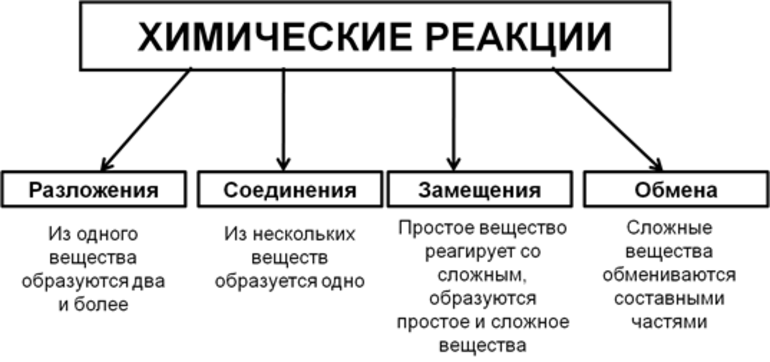
По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций.
1. Реакции соединения – это реакции, в результате которых из нескольких
простых или сложных веществ образуется одно сложное вещество (рис. 10).
2. Реакции разложения – это реакции, в результате которых из одного сложного вещества образуются два и более веществ – простых или сложных.
3. Реакции замещения – это реакции между простым и сложным веществами, в которых атомы простого вещества замещают атомы одного из элементов в сложном соединении. В результате образуются новые простое и сложное вещества (рис. 11а).
4. Реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями и образуются два новых сложных вещества (рис. 11б).
С классификацией химических реакций по другим признакам вы познакомитесь позднее.
Химические реакции в природе и жизнедеятельности живых организмов и человека
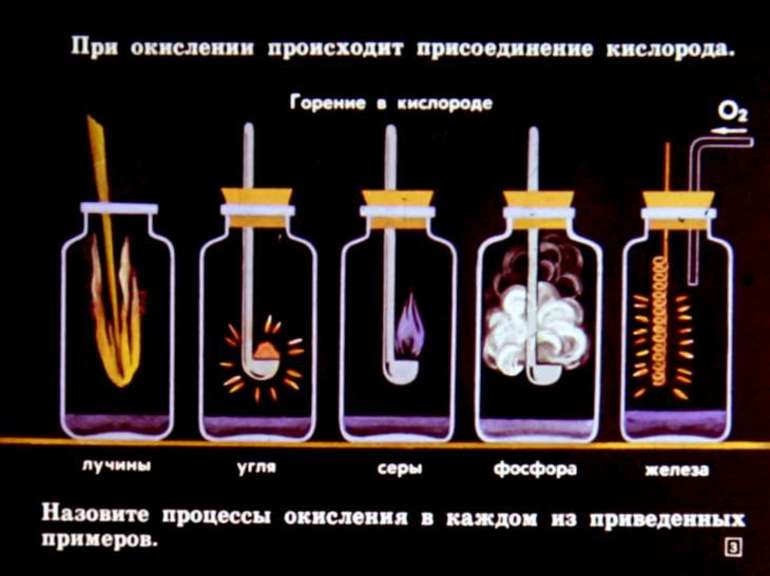
Вам известно, что в результате химических явлений одни вещества превращаются в другие, отличающиеся от исходных веществ по составу. Это вы можете наблюдать в окружающей среде каждодневно. Например: ржавление железного гвоздя, потускнение серебряных украшений и предметов кухонной утвари, позеленение тазика из латуни, горение дров и газа на плите. Что общего между ними? Все эти процессы происходят под действием кислорода
воздуха, т. е. идет окисление.
Химия в природе. В природе непрерывно идут реакции образования органических веществ из простых неорганических соединений, т. е. идут реакции синтеза (рис. 12):
Такой процесс идет в зеленых растениях и водорослях. Хлорофилл находится в хлоропластах зеленых листьев, поэтому они окрашены в зеленый цвет.
Во время грозы в летний период воздух становится свежее и чище в результате следующих реакций:
При разложении кислорода получаем атомарный кислород. Атомарный кислород, соединяясь с молекулой кислорода, образует озон.
Озон – это газ синего цвета с характерным запахом свежести. Накапливается в верхних слоях атмосферы и образует озоновый слой, который выполняет роль щита нашей планеты. Озон защищает Землю от солнечной радиации из космоса и не допускает остывание Земли, поглощая инфракрасное излучение.
Гниение также относится к реакциям окисления. В отличие от горения, гниение – это медленно протекающие процессы. В результате гниения сложные азотсодержащие вещества взаимодействуют с кислородом при участии микроорганизмов. Для того чтобы шел процесс гниения, кроме микроорганизмов, необходимо наличие влаги. Это уникальный, сложный многоступенчатый процесс, позволяющий перерабатывать белки погибших животных и
растений в соединения, пригодные к усвоению растениями.
На реакциях, лежащих в основе брожения сахаристых веществ, основаны многие производства, например, хлебобулочных изделий и напитков.
В результате реакции окисления глюкозы образуется углекислый газ, вода и большое количество тепла:
Это является источником энергии, необходимой для физической и умственной деятельности в повседневной жизни человека.
Использование пищевой соды способствует поднятию теста, так как при взаимодействии с органическими кислотами выделяется углекислый газ.
Выделяющийся углекислый газ 
Химия в живых организмах
С точки зрения химика, дыхание – также процесс окисления органических веществ: углеводов, жиров, белков.
Часть энергии, выделенной в результате этой реакции, организм использует
для совершения умственной, физической работы.
А вторая часть запасается в организме для того, чтобы можно было использовать ее при синтезе характерных для данного организма белков, углеводов и жиров. Таким образом, энергия, необходимая для жизнедеятельности, получается из питательных веществ, поступающих в организм из окружающей среды.
Антацидные вещества – лекарственные средства для лечения желудочно-кишечных заболеваний. Они нейтрализуют соляную кислоту, которая входит в состав желудочного сока.
Химия в быту
Работа двигателей внутреннего сгорания основана на реакции горения углеводородов (топлива).
Вы, наверное, заметили, что на стенках чайника через некоторое время образуется накипь. При этом идет реакция разложения солей магния и кальция, обусловливающих временную жесткость воды. В результате этих реакций образуются нерастворимые соли кальция и магния.
Из-за накипи выходят из строя нагревательные элементы в стиральных и посудомоечных машинах, утюгах, а также промышленные котлы.
Для очистки чайника от накипи достаточно прокипятить воду, в которую добавлена уксусная кислота.
Для этой цели можно использовать и лимонную кислоту.
«Гашение» соды уксусом – часто наблюдаемая на кухне реакция:
сода 4- уксусная кислота -> соль 4- вода 4- углекислый газ
Хозяйственное мыло не мылится в жесткой воде, т. к. идет реакция обмена с солями кальция и магния и образуется нерастворимая соль, которая «всплывает». Это объясняется тем, что натриевые соли органических кислот растворимые, а кальциевые, магниевые соли – нерастворимые в воде.
Санатории для больных туберкулезом обычно расположены в сосновых борах. Почему? Потому что в хвойных растениях содержится соединение, которое при окислении озоном (после грозы) выделяет атомарный кислород, который обладает дезинфицирующим и отбеливающим свойствами.
Еще одно интересное природное явление – образование в пещерах сталактитов и сталагмитов – это осадок карбоната кальция СаСО3. Сталактиты растут сверху вниз как сосульки, а сталагмиты – снизу вверх (рис. 13).
Химия дает человечеству огромные возможности и силы, но только она требует грамотного и ответственного отношения к ней. За день в мире происходят тысячи различных (опасных для человечества, в то же время интересных) химических реакций. Не зря говорится в изречении М. В. Ломоносова: «Широко распространяет химия руки свои в дела человеческие».
- 1. Обозначения качественного и количественного состава простых и сложных веществ с помощью символов элементов и индексов называются химическими формулами.
- 2. Химическое уравнение — условная запись химической реакции с помощью химических формул и знаков.
- 3. По числу и составу реагентов, вступивших в реакцию, и продуктов реакций различают четыре типа химических реакций: реакция соединения, реакция разложения, реакция замещения, реакция обмена.
- 4. Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. Эта формулировка называется законом сохранения масс веществ.
- 5. Состав химически чистого, имеющего молекулярное строение вещества, независимо от способа получения, остается постоянным. Химически чистое вещество имеет постоянный качественный и количественный состав.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
🎬 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

3 вариант ЕГЭ по химии: Д.Ю. Добротин | ПОЛНЫЙ РАЗБОР с СuCuB 🚀🔥Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химия | Молекулярные и ионные уравненияСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические уравнения. Урок 15. Химия 7 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать