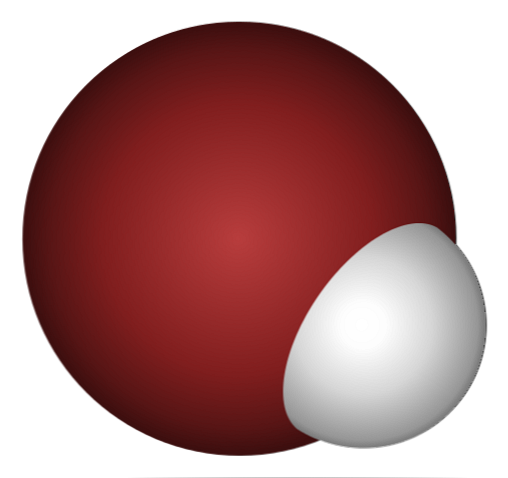
Бромоводородная кислота (другое название бромоводород) — это неорганическое соединение водорода (H) с бромом (Br). Это бесцветный газ, который во влажном воздухе образует густой туман.
Какие существуют способы получения бромоводорода
По причине высокой степени окисляемости бромоводороной кислоты, ее нельзя получить посредством воздействия серной кислоты концентрированной на бромиды металлов щелочных. Происходит следующая реакция:
2KBr (бромид калия) + 2Н2SO4 (кислота серная) = К2SO4 (калия сульфат) + SO2 (оксид серы) + Br2 (молекула брома) + 2Н2О (вода)
1. В промышленности получение кислот, таких как бромоводородная, осуществляется посредством реакции, в ходе которой взаимодействуют составляющие элементы. Например, рассматриваемое нами вещество можно получить следующим способом:
H2 (молекула водорода) + Br2 (молекула брома) = 2HBr (бромоводородная кислота)
Эта реакция осуществима при температуре от 200 до 400 градусов.
2. Также возможно получение бромоводородной кислоты и в лабораторных условиях несколькими способами.
— посредством гидролиза пентабромида фосфора или трибромида:
PBr3 (трибромид) + 3H2O (три молекулы воды) = H3PO3 (кислота фосфорная) + 3HBr (бромоводородная кислота, формула химическая)
PBr5 (пентабромид) + 4H2O (четыре молекулы воды) = H3PO4 (кислота фосфорная) + 5HBr (бромоводород)
— путем восстановления брома:
3Br2 (три молекулы брома) + S (сера) + 4H2O (вода) = (реакция возможна при температуре, равной 100-150 градусов) H2SO4 (серная кислота) + 6HBr (бромоводород)
3Br2 (три молекулы брома) + KNO2 (калия нитрит) + 4H2O (вода) = KNO3 (нитрат калия) + 2HBr (бромоводород)
— посредством вытеснения разбавленной кислотой щелочных металлов из бромидов:
KBr (бромистый калий) + H2SO4 (серная кислота) = KHSO4 (калия гидросульфат) + HBr (выделяется в виде газа)
3. Как побочный продукт бромистый водород можно получить при синтезе органических бромопроизводных соединений.
Физические свойства бромоводорода:
1. Бромоводородная кислота — это газ без цвета, имеющий неприятный и резкий запах. Сильно дымится на воздухе. Обладает высокой устойчивостью к температурам.
2. Хорошо растворяется в H2O (вода) и этаноле с образованием электролита. Водный раствор бромоводорода образует азеотропную смесь, которая кипит при температуре 124 градуса. В одном литре воды растворяется около полулитра бромводорода (при 0 градусов).
3. В процессе охлаждения водного раствора бромистого водорода можно получить следующие кристаллогидраты: HBr*H2O, HBr*2H2O, HBr*4H2O.
4. Чистый бромоводород образует кристаллы сингонии орторомбической, пространственной группы F mmm.
5. При температуре -66,8 градусов переходит в жидкое состояние, а при — 87 градусов затвердевает.
Химические свойства бромоводорода:
1. Бромоводородная кислота при взаимодействии с водой образует сильную кислоту одноосновную. Эта реакция выглядит так:
HBr + H2O (вода) = Br- (анион брома) + H3O+ (ион гидроксония)
2. Данное вещество устойчиво к высоким температурам, однако, при 1000 градусах около 0,5% всех молекул разлагаются:
2HBr (бромоводородная кислота) = H2 (молекула водорода) + Br2 (молекула брома)
3. Рассматриваемое нами химическое соединение реагирует с различными металлами, а также их основаниями и оксидами. Примеры реакций:
2HBr + Mg (магний) = MgBr2 (бромид магния) + H2 (выделяется в виде газа)
2HBr + CaO (кальция оксид) = CaBr2 (бромид кальция) + H2O (вода)
HBr + NaOH (натрия гидроксид) = NaBr (бромид натрия) + H2O (вода)
4. Бромоводород также является восстановителем. На воздухе медленно окисляется. По этой причине его водные растворы через некоторое время окрашиваются в бурый цвет. Реакция будет такая:
4HBr (бромоводородная кислота) + O2 (молекула кислорода) = 2Br2 (молекула брома) + 2H2O (вода)
Применение
Бромоводород используют для создания (синтеза) различных органических производных брома и для приготовления бромидов различных металлов. Особенное значение имеет бромид серебра, так как он используется в производстве кинофотоматериалов.
Как производится транспортировка
В баллонах емкостью 68 или 6,8 литров под давлением в 24 атмосферы.
- Соединения брома
- Бромоводород (НBr)
- Бромноватистая кислота (HBrO)
- Бромистая кислота (HBrO2)
- Бромноватая кислота (HBrO3)
- Бромная кислота (HBrO4)
- Оксиды брома
- Бромистоводородная кислота (HBr) структура, свойства, образование, использование
- Структура бромистоводородной кислоты
- кислотность
- Физико-химические свойства
- Молекулярная формула
- Молекулярный вес
- Внешний вид
- запах
- Порог запаха
- плотность
- Точка плавления
- Точка кипения
- Растворимость в воде
- Плотность пара
- Кислотность пКа
- Калорийность
- Стандартная молярная энтальпия
- Стандартная молярная энтропия
- Точка зажигания
- номенклатура
- Как это формируется?
- Смесь водорода и брома в воде
- Фосфор трибромид
- Диоксид серы и брома
- приложений
- Приготовление бромидов
- Синтез алкилгалогенидов
- Обезвоживание спиртов
- Добавление к алкенам и алкинам
- Эфирный кливаж
- катализатор
- 🎥 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Соединения брома
Видео:8 класс. Составление уравнений химических реакций.Скачать

Бромоводород (НBr)
Способы получения бромоводорода
- из бромидов вытеснением НВr из его соли ортофосфорной кислотой:
- гидролизом галогенидов неметаллов:
- восстановлением свободных галогенов в водных растворах
Химические свойства бромоводорода
НВr по физическим и химическим свойствам сходен с HCl, однако молекула НВr менее устойчива, чем HCl.
Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
- Бромоводород – сильный восстановитель и взаимодействует с окислителями — соединениями марганца, хрома (VI), концентрированной серной кислотой и др:
- Качественная реакция на бромид-ионы – взаимодействие с растворимыми солями серебра. При этом образуется осадок бромида серебра – бледно-желтого цвета:
Кислородные кислоты и окислы брома
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Бромноватистая кислота (HBrO)
HBrO — слабая неустойчивая кислота. В свободном виде не выделена. Максимально полученная концентрация HBrO в водном растворе — 30 %.
Ее соли и сложные эфиры называют гипобромитами.
Получение бромноватистой кислоты
HBrO получается при диспропорционировании брома в воде. Присутствие оксида ртути (II) смещает равновесие в сторону кислоты:
В полученном растворе концентрация бромноватистой кислоты не более 6 %.
Химические свойства бромноватистой кислоты
- Разлагается при комнатной температуре:
В темноте также при нагревании выше 60ºС:
3HBrO = HBrO3 + 2HBr
- Нейтрализуется щелочами:
HBrO + NaOH = NaBrO + H2O
- HBrO является сильным окислителем:
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Бромистая кислота (HBrO2)
Бромистая кислота HBrO2 —неустойчивое соединение, существует только в водных растворах. Разлагается в течение 4 часов.
Образует соли — бромиты, например бромит бария Ba(BrO2)2•H2O.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Бромноватая кислота (HBrO3)
Бромноватая кислота HBrO3 — бесцветная (или слегка желтоватая) жидкость. В свободном состоянии не выделена, существует в растворе с максимальной концентрацией до 50%. Является сильной кислотой.
Получение бромноватой кислоты
- Окисление бромахлором в горячей воде:
- Взаимодействие брома с раствором бромата серебра:
- Гидролиз пентафторида брома:
- Обменными реакциями между броматами и сильными кислотами:
Химические свойства бромноватой кислоты
- При нагревании выше 100ºС разлагается:
- Взаимодействует с щелочами с образованием броматов:
- Проявляет свойства сильного окислителя:
Cоли бромноватой кислоты – броматы
Наиболее важными являются броматы калия и натрия – это белые вещества, хорошо растворимые в воде. Являются окислителями и слабыми восстановителями
Получение броматов
- Получают при взаимодействии хлора и брома с горячим раствором щелочи:
- При электролизе водного раствора бромида натрия:
- При растворении брома в концентрированном горячем растворе щелочи:
Химические свойства броматов
- Разлагаются при температуре выше 400ºС:
- Свойства окислителя:
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Бромная кислота (HBrO4)
Бромная кислота HBrO4 — сильная кислота. Cуществует только в водном растворе с максимальной концентрацией 83%. В свободном виде не выделена, устойчива в растворе с концентрацией менее 55%.
Соли кислоты — перброматы.
Получение бромной кислоты
- Окисление бромноватой кислоты дифторидом ксенона:
- Окисление броматов фтором с последующей обработкой кислотой:
NaBrO3 + F2 + 2NaOH = NaBrO4 + 2NaF + H2O
Химические свойства бромной кислоты
- Бромная кислотаразлагается при нагревании или при комнатной температуре при повышении ее концентрации:
- Как кислота реагирует с щелочами:
- Бромная кислота проявляет свойства сильного окислителя:
Соли бромной кислоты – перброматы
Наиболее выжный – пербромат калия. Белое вещество, умеренно растворимое в воде.
Получение перброматов
- При взаимодействии броматов со фтором в щелочной среде:
- При электролизе водных растворов броматов:
Химические свойства перброматов
- Не разлагаются кислотами и щелочами.
- При нагревании разлагается:
- Являются медленными окислителями:
Видео:Бромоводородная кислота.Скачать

Оксиды брома
Известны оксиды брома — Вr2O, ВrO2 и Вr3O8, которые крайне неустойчивы.
Ни одно из кислородных соединений брома не нашло важного практического применения
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Бромистоводородная кислота (HBr) структура, свойства, образование, использование
Бромистоводородная кислота представляет собой неорганическое соединение, которое получается из водного раствора газа, называемого бромистым водородом. Его химическая формула — HBr, и ее можно считать по-разному эквивалентной: в качестве молекулярного гидрида или галогеноводорода в воде; то есть гидразид.
В химических уравнениях он должен быть записан как HBr (ac), чтобы указать, что это бромистоводородная кислота, а не газ. Эта кислота является одной из самых сильных, даже больше, чем соляная кислота, HCl. Объяснение этому кроется в природе его ковалентной связи.
Почему HBr такая кислота и еще больше растворяется в воде? Поскольку ковалентная связь H-Br очень слабая, из-за плохого перекрытия 1s-орбиталей H и 4p Br.
Это неудивительно, если вы внимательно посмотрите на изображение выше, где атом брома (коричневый) явно больше, чем атом водорода (белый).
Следовательно, любое нарушение вызывает разрыв связи H-Br, высвобождая ион H + . Затем бромистоводородная кислота представляет собой кислоту Бренстеда, поскольку она переносит протоны или ионы водорода. Его сила такова, что он используется в синтезе нескольких броморганических соединений (таких как 1-бромэтан, CH3СН2Br).
Бромистоводородная кислота, после HI, является одним из самых сильных и полезных гидроцидов для расщепления определенных твердых образцов..
- 1 Структура бромистоводородной кислоты
- 1.1 Кислотность
- 2 Физические и химические свойства
- 2.1 Молекулярная формула
- 2.2 Молекулярный вес
- 2.3 Внешность
- 2,4 Запах
- 2.5 Порог запаха
- 2.6 Плотность
- 2.7 Точка плавления
- 2.8 Точка кипения
- 2.9 Растворимость в воде
- 2.10 Плотность пара
- 2,11 пКа кислотность
- 2.12 Калорийность
- 2.13 Стандартная молярная энтальпия
- 2.14 Стандартная молярная энтропия
- 2.15 Температура вспышки
- 3 Номенклатура
- 4 Как это формируется?
- 4.1 Смесь водорода и брома в воде
- 4.2 Фосфор трибромид
- 4.3 Диоксид серы и бром
- 5 использует
- 5.1 Приготовление бромидов
- 5.2 Синтез алкилгалогенидов
- 5.3 Катализатор
- 6 Ссылки
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Структура бромистоводородной кислоты
На изображении показана структура H-Br, свойства и характеристики которого, даже газа, тесно связаны с его водными растворами. Вот почему наступает момент, когда вы вступаете в заблуждение относительно того, на какое из двух соединений намекают: HBr или HBr (ac).
Структура HBr (ac) отличается от структуры HBr, потому что теперь молекулы воды сольватируют эту двухатомную молекулу. Когда это достаточно близко, H передается + к молекуле Н2Или как указано в следующем химическом уравнении:
Таким образом, структура бромистоводородной кислоты состоит из ионов Br — и H3О + взаимодействуя электростатически. Теперь это немного отличается от ковалентной связи H-Br.
Его большая кислотность обусловлена громоздким анионом Br — едва может взаимодействовать с Н3О + , не может помешать ему передать H + к другому окружающему химическому виду.
кислотность
Например, Cl — и F — хотя они не образуют ковалентные связи с Н3О + , они могут взаимодействовать через другие межмолекулярные силы, такие как водородные мостики (которые только F — умеет их принимать). Водородные мостики F — -Н-ОН2 + «Мешают» пожертвованию Н + .
Именно по этой причине плавиковая кислота HF является более слабой кислотой в воде чем бромистоводородная кислота; так как, ионные взаимодействия Br — H3О + не беспокоить передачи Н + .
Однако, хотя вода присутствует в HBr (ac), ее поведение в конце описания аналогично поведению молекулы H-Br; то есть H + Переводится из HBr или Br — H3О + .
Видео:Составление уравнений реакций. 1 часть. 9 класс.Скачать
Физико-химические свойства
Молекулярная формула
Молекулярный вес
80 972 г / моль Обратите внимание, что, как упоминалось в предыдущем разделе, рассматривается только HBr, а не молекула воды. Если молекулярный вес взят из формулы Br — H3О + он будет иметь значение примерно 99 г / моль.
Внешний вид
Бесцветная или бледно-желтая жидкость, которая будет зависеть от концентрации растворенного HBr. Чем оно более желтое, тем более концентрированным и опасным оно будет.
запах
Порог запаха
плотность
1,49 г / см 3 (водный раствор при 48% мас. / мас.). Эта величина, как и те, которые соответствуют точкам плавления и кипения, зависит от количества HBr, растворенного в воде.
Точка плавления
-11ºC (12ºF, 393ºK) (водный раствор при 49% мас. / Мас.).
Точка кипения
122 ° С (252 ° F, 393 ° К) при 700 мм рт. Ст. (Водный раствор 47-49% мас. / Мас.).
Растворимость в воде
-221 г / 100 мл (при 0 ºC).
-204 г / 100 мл (15 ºC).
-130 г / 100 мл (100 ºC).
Эти значения относятся к газообразному HBr, а не к бромистоводородной кислоте. Как видно, повышение температуры снижает растворимость HBr; поведение, которое является естественным в газах. Следовательно, если требуются концентрированные растворы HBr (ac), лучше работать с ними при низких температурах..
При работе при высоких температурах HBr будет выходить в виде газообразных двухатомных молекул, поэтому реактор должен быть герметично закрыт для предотвращения утечки.
Плотность пара
2,71 (по отношению к воздуху = 1).
Кислотность пКа
-9,0. Эта константа, столь отрицательная, свидетельствует о ее сильной кислотности.
Калорийность
Стандартная молярная энтальпия
198,7 кДж / моль (298 ºK).
Стандартная молярная энтропия
Точка зажигания
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

номенклатура
Его название «бромистоводородная кислота» сочетает в себе два факта: присутствие воды и тот, что бром имеет валентность -1 в соединении. На английском языке это несколько более очевидно: бромистоводородная кислота, где префикс «гидро» (или гидро) относится к воде; хотя, действительно, это может также относиться к водороду.
Бром имеет валентность -1, потому что он связан с атомом водорода менее электроотрицательным, чем он есть; но если он связан или взаимодействует с атомами кислорода, он может иметь множество валентностей, таких как: +2, +3, +5 и +7. С помощью H можно принять только одну валентность, и именно поэтому к ее названию добавляется суффикс -ico..
В то время как HBr (г), бромистый водород, является безводным; то есть у него нет воды. Поэтому он назван в соответствии с другими стандартами номенклатуры, что соответствует галогеноводородам.
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как это формируется?
Существует несколько синтетических методов приготовления бромистоводородной кислоты. Некоторые из них:
Смесь водорода и брома в воде
Без описания технических подробностей эту кислоту можно получить из прямой смеси водорода и брома в реакторе, заполненном водой..
Таким образом, когда образуется HBr, он растворяется в воде; Это может затянуть его в дистилляции, поэтому растворы могут быть извлечены с различными концентрациями. Водород — это газ, а бром — темно-красная жидкость..
Фосфор трибромид
В более сложном процессе смешивают песок, гидратированный красный фосфор и бром. Водяные ловушки помещаются в ледяные ванны, чтобы предотвратить выход HBr и образование вместо него бромистоводородной кислоты. Реакции:
Диоксид серы и брома
Еще один способ его приготовления — это реакция брома с диоксидом серы в воде:
Это окислительно-восстановительная реакция. Br2 он уменьшает, он получает электроны, связываясь с атомами водорода; в то время как ТАК2 он окисляется, он теряет электроны, когда он образует больше ковалентных связей с другими атомами кислорода, как в серной кислоте.
Видео:Уравнивание реакций горения углеводородовСкачать

приложений
Приготовление бромидов
Бромидные соли могут быть получены, если HBr (ac) реагирует с гидроксидом металла. Например, производство бромида кальция считается:
Другой пример для бромида натрия:
NaOH + HBr => NaBr + H2О
Таким образом, многие из неорганических бромидов могут быть получены.
Синтез алкилгалогенидов
А как насчет органических бромидов? Это броморганические соединения: RBr или ArBr.
Обезвоживание спиртов
Сырьем для их получения могут быть спирты. При протонировании кислотностью HBr они образуют воду, которая является хорошей исходящей группой, и вместо этого включается объемный атом Br, который становится ковалентно связанным с углеродом:
ROH + HBr => RBr + H2О
Эту дегидратацию проводят при температуре выше 100 ° C, чтобы облегчить разрыв связи R-OH2 + .
Добавление к алкенам и алкинам
Молекула HBr может быть добавлена из ее водного раствора к двойной или тройной связи алкена или алкина:
RC≡CR + HBr => RHC = CRBr
Можно получить несколько продуктов, но в простых условиях продукт сначала образуется там, где бром связан с вторичным, третичным или четвертичным углеродом (правило Марковникова)..
Эти галогениды вмешиваются в синтез других органических соединений, и диапазон их применения очень широк. Кроме того, некоторые из них могут даже использоваться в синтезе или разработке новых лекарств..
Эфирный кливаж
Из простых эфиров можно получить два алкилгалогенида одновременно, каждый из которых несет одну из двух боковых цепей R или R ‘исходного эфира R-O-R’. Случается что-то похожее на обезвоживание спиртов, но механизм его реакции другой.
Реакция может быть схематизирована с помощью следующего химического уравнения:
ROR ‘+ 2HBr => RBr + R’Br
И вода тоже выделяется.
катализатор
Его кислотность такова, что он может быть использован в качестве эффективного кислотного катализатора. Вместо добавления аниона Br — к молекулярной структуре, открывает путь для другой молекулы, чтобы сделать это.
🎥 Видео
Типы химических реакций. 1 часть. 8 класс.Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ - Топ 5 Ошибок в уравнениях химических реакций // Подготовка к ЕГЭ по ХимииСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

3.3. Алкины: Химические свойстваСкачать

Классификация химических реакций | Химия 11 класс #14 | ИнфоурокСкачать