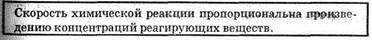Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Скорость химических реакций. 9 класс.Скачать

Гомогенные и гетерогенные реакции
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда — вещества, окружающие систему. Обычно система отграничена от среды.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы. Гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства системы изменяются скачком.
Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом. Другим примером гомогенной системы может служить раствор хлорида натрия, сульфата магния, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фазы: из газовой фазы в первом примере и из водного раствора во втором.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора:
Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности
раздела фаз, образующих систему. Например, растворение металла в кислоте:
может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества. В связи с этим4скорость гомогенной реакции и скорость гетерогенной реакции определяются различно,
Величину поверхности твердого тела не всегда легко измерить. Поэтому иногда скорость гетерогенной реакции относят не к единице поверхности, а к единице массы или объема твердой фазы.
Оба этих определения можно записать в математической форме. Введем обозначения: vгомог — скорость реакции в гомогенной системе; vгетерог — скорость реакции в гетерогенной системе; n — число молей какого-либо из получающихся при реакции веществ; V — объем системы; t — время; S -— площадь поверхности фазы, на которой протекает реакция; D — знак приращения (Dn= n2-n1; D = t2-t1). Тогда: vгомог=Dn/(SDt).
Первое из этих уравнений можно упростить. Отношение числа молей (n) вещества к объему (V) системы представляет собою мольно-объемную концентрацию (С) данного вещества:
Последнее уравнение является математическим выражением другого определения скорости реакции в гомогенной системе: скоростью реакции в гомогенной системе называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее в единицу времени.
Как уже говорилось, при практическом использовании химических реакций весьма важно знать, с какой скоростью будет протекать данная реакция в тех или иных условиях и как нужно изменить эти условия для того, чтобы реакция протекала с требуемой скоростью.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции, важнейшими из которых являются следующие: концентрация с, температура t, присутствие катализаторов, а также от некоторых других факторов (например, от давления — для газовых реакций, от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция, от измельчения — для твердых веществ, от радиоактивного излучения).
Влияние концентрации реагирующих веществ, Чтобы осуществилось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
A+B=C+D этот закон выразится уравнением:
где сA и сB — концентрации веществ А и В, моль/л; k — коэффициент пропорциональности, называемый константой скорости Реакции. Основной закон химической кинетики называют законом действующих масс.
Из уравнения (12.1) нетрудно установить физический смысл константы скорости k: она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляет 1 моль/л или когда их произведение равно единице.
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентрации.
Уравнение (12.1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислить скорости при других концентрациях тех же реагирующих веществ.
Основной закон химической кинетики не учитывает реагирующие вещества, находящиеся в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности. Так, например, для реакции горения угля:
С+O2=СО2 кинетическое уравнение реакции имеет вид:
где k — константа скорости, сC — концентрация твердого вещества; S — площадь поверхности. Это величины постоянные. Обозначив произведение постоянных величин через k’, получим v=k’cO2, т.е. скорость реакции пропорциональна только концентрации кислорода.
Влияние температуры. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
Математически эта зависимость выражается соотношением;
и конечной (t2) температурах, а g — температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
Энергия активации
Сильное изменение скорости реакции с изменением температуры объясняется тем, что в химическое взаимодействие вступают только активные молекулы (частицы), обладающие энергией, достаточной для осуществления данной реакции. Неактивные частицы можно сделать активными, если сообщить им необходимую дополнительную энергию, — этот процесс называется активацией. Один из способов активации — увеличение температуры: при повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость реакции.
Ее определяют опытным путем, обозначают буквой Eа и обычно выражают в кДж/моль. Так, например, для соединения водорода с иодом (Н2+I2=2HI) Еa=167,4 кДж/моль, а для распада иодоводорода (2HI = Н2 +I2) Еa=186,2 кДж/моль.
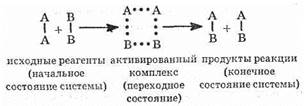
Энергия активации Ea зависит от природы реагирующих веществ и служит характеристикой каждой реакции. Эти представления поясняются рис. 17 на примере реакции в общем виде А2+В2=2АВ. Ось ординат характеризует потенциальную энергию системы, ось абсцисс — ход реакции: исходное состояние ® переходное состояние ® конечное состояние. Чтобы реагирующие вещества А2 и В2 образовали продукт реакции АВ, они должны преодолеть энергетический барьер С(рис. 17). На это затрачивается энергия активации Ea, на значение которой возрастает энергия системы. При этом в ходе реакции из частиц реагирующих веществ образуется промежуточная неустойчивая группи-
ровка, называемая переходным состоянием или активированным комплексом (в точке С), последующий распад которой приводит к образовании) конечного продукта АВ. Механизм реакции можно изобразить схемой:
Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая. Примером эндотермической реакции служит обратный процесс — образование из вещества АВ веществ А2 и В2: 2АВ= А2+В2. В этом случае процесс протекает также через образование активного комплекса A2B2, однако энергия активации больше, чем для прямого процесса: Е’а=Еа+DH (DН — тепловой эффект реакции). Для протекания эндотермических реакций требуется подвод энергии извне.
Как видно из рис. 17, разность энергий конечного состояния , системы (Hкон) и начального (Hнач) равна тепловому эффекту реакции:
Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания реакции энергетический барьер преодолевает большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно.
При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью (практически мгновенно).
Видео:Гомогенные и гетерогенные реакцииСкачать

Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Видео:8 класс - Химия - Гомогенные и гетерогенные химические реакции. Скорость химической реакции. Часть 1Скачать

Факторы, влияющие на скорость химической реакции
Видео:Химическая кинетика. Скорость химической реакции | ХимияСкачать

1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
Видео:Скорость химической реакции. Гомо- и гетерогенные реакции. Механизм реакции.Скачать

2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
Видео:Скорость химических реакций. Гомогенные и гетерогенные реакции. Химия 8 классСкачать

4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
Видео:Гомогенные и гетерогенные реакции. Самоподготовка к ЕГЭ и ЦТ по химииСкачать

5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
🎬 Видео
Химическое равновесие. Константа равновесия. 10 класс.Скачать

8 класс - Химия - Гомогенные и гетерогенные химические реакции. Скорость химической реакции. Часть 2Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Скорость химической реакции. Практическая часть. 10 класс.Скачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

Все о скорости химической реакции | Химия ЕГЭ 10 класс | УмскулСкачать