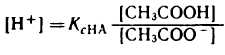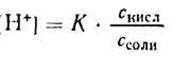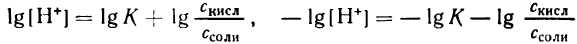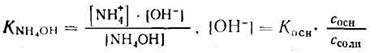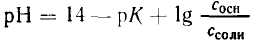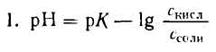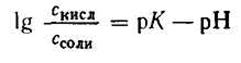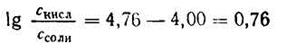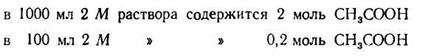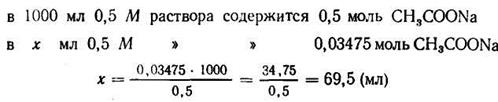1) Аналитическое выражение для расчета рН буферного раствора, например, ацетатного буфера можно получить из уравнения для константы диссоциации (к реакциям диссоциации применим закон действующих масс).
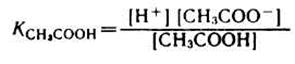
разрешив его относительно концентрации ионов водорода [H + ] можно написать:
Уксусная кислотаприсутствует в растворе в смеси с CH3COONa в виде неионизированных молекул. Поэтому концентрацию молекул можно принять равной общей молярной концентрации кислоты в растворе, т. е. [СН3СООН] = Скисл. Концентрацию анионов уксусной кислоты можно принять равной концентрации соли, т. е. [СН3СОО — ] = Ссоли, так как CH3COONa— сильный электролит, диссоциирующий в растворе на 100%. Приняв эти упрощения, получим:
2. Логарифмируя полученное уравнение и заменяя знаки логарифмов на обратные, получаем:
но – Ig [Н + ] есть рН, а – Ig К есть рК — силовой показатель кислоты.
С учетом этого получим:
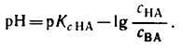
Если при приготовлении буферной системы взять одинаковые концентрации кислоты и соли, то концентрация ионов водорода в таком растворе будет равна константе ионизации кислоты, так как отношение Скис/Ссоли = 1 и [Н + ]=К1, т.е. [Н + ]=К, поэтому рН=рК.
Аналогично для систем NH4OH + NH4C1получают выражения:
1. Запишем уравнение константы ионизации NH4OH и найдем [ОН — ]:
2. Отсюда находим:
Зная, что рН + рОН = 14, получим:
Задача 1. Сколько 0,5 М раствора CH3COONa нужно прибавить к 100 мл 2М раствора СН3СООН, чтобы получить буферный раствор с рН=4?
Откуда
Подставляем числовые данные и получаем:
Число Ig 0,76 = 5,754. Следовательно, отношение концентрации кислоты к концентрации соли должно быть равно 5,754 : 1.
2. Находим концентрацию кислоты в буферной системе:
3. Зная концентрацию кислоты, находим концентрацию солив буферной системе; она должна быть равна 0,2:5,754= 0,03475 (моль).
4. Находим количество 0,5 М раствора ацетата натрия, содержащего 0,03475 моль:
Задача 2.Вычислить рН аммиачной буферной системы, содержащей по 0,5 М NH4ОН и NH4C1. Как изменится рН при добавлении к 1 л этой смеси 0,1 М НС1 и при добавлении к 1 л этой смеси 0,1 М NaOH и при разбавлении раствора водой в 10 раз, если рК (NH4ОН) =4,75?
Дата добавления: 2015-08-08 ; просмотров: 10441 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Буферные растворы и уравнение Гендерсона-ГассельбахаСкачать

Уравнение Гендерсона — Гассельбаха.
В качестве примера возьмем буферную систему А/НА, состоящую из слабой кислоты НА и анионов А-, образующихся при диссоциации какой-либо соли этой кислоты, например натриевой.
При значительной концентрации одноименного иона А — из соли диссоциация слабой кислоты НА по приведенной выше схеме будет практически подавлена, и буферная система будет состоять из слабой кислоты и сопряженного с ней слабого основания.
Буферное действие такой системы но отношению к сильной кислоте будет выражаться уравнением
по отношению к сильному основанию — уравнением
Если концентрации НА и А” достаточно велики, то кислотность раствора будет определяться единственным протолитическим равновесием
константой которого будет являться соответствующая константа диссоциации (Ка) кислоты НА
Выражая [Н + ] из уравнения (6.10), находим, что концентрация ионов водорода в растворе пропорциональна отношению концентраций сопряженных кислоты и основания:
Логарифмируя выражение (6.11), получаем уравнение Гендерсона —Гассельбаха для расчета pH любого двухкомионентного буферного раствора:
где [А ] — концентрация основания; [НА] — концентрация сопряженной кислоты.
Поскольку оба компонента в буферном растворе находятся в едином объеме, в уравнение Гендерсона — Гассельбаха можно вместо концентраций подставлять количества веществ сопряженных основания и кислоты.
Пример 6.14. Рассчитайте pH раствора, полученного смешиванием 50 мл
раствора 0,5 М раствора уксусной кислоты (рКа = 4,76) и 25 мл 0,4 М раствора
Если в буферном растворе концентрация основания равна концентрации сопряженной кислоты, pH = рКа. Таким образом можно экспериментально определять рК.х слабых кислот.
Интервал значений pH рКа ± 1 называется интервалом буферного действия, ему соответствуют соотношения количеств основания и сопряженной кислоты от 10 : 1 до 1 : 10.
Для буферных систем, включающих производные многоосновных кислот (или многокислотных оснований), величина рКа в уравнении (6.12) должна соответствовать равновесию между компонентами данной буферной системы.
Уравнение Гендерсона —Гассельбаха показывает, что pH буферного
©раствора зависит от соотношения количеств основной и кислотной форм. Значение pH буферного раствора мало меняется при разбавлении в довольно широких пределах (1 : 100).
Расчет pH буферных растворов при сильном разбавлении требует учета диссоциации и сопряженной кислоты, и растворителя.
Формулы для расчета двухкомпонентных кислотно-основных буферных систем приведены в табл. 6.5.
Двухкомпонентные кислотно-основные буферные системы
Видео:Уравнение Гендерсона-ХассельбахаСкачать

Вычисление рН и рОН буферных систем. Уравнение Гендерсона-Гассельбаха
Каждая из буферных систем характеризуется определенной присущей ей концентрацией ионов Н+ (активной кислотностью), которую система и стремится сохранить на неизменном уровне при добавлении к ней сильной кислоты либо щелочи.
Установим на примере ацетатного буфера факторы, влияющие на величину активной кислотности.
В растворе данной буферной системы происходят следующие реакции электролитической диссоциации:
CH3COOH CH3COO- + H+
CH3COONa > CH3COO- + Na+
(Гидролиз соли, т.е. взаимодействие ацетат-ионов с Н2О
CH3COO- + HOH CH3COOH + OH-
учитывать не будем.)
Таким образом, ионы Н+ образуются только за счет диссоциации некоторого числа молекул уксусной кислоты. Этот процесс является обратимым и количественно характеризуется константой кислотности Kа:


где (или ), и равновесные молярные концентрации ионов Н+, СН3СОО- и непродиссоциированных молекул кислоты.
Из данного уравнения можно выразить или активную кислотность буферной системы:
Кроме уксусной кислоты в растворе присутствует ее соль CH3COONa. Она является сильным электролитом и полностью распадается на ионы. В результате этого концентрация анионов СН3СОО- резко возрастает и согласно принципа Ле-Шателье равновесие реакции диссоциации уксусной кислоты смещается влево, т.е. в сторону образования ее молекул. Причем диссоциация уксусной кислоты в присутствии собственной соли может быть настолько подавленной, что равновесную концентрацию ее нераспавшихся молекул в растворе можно считать равной концентрации СН3СООН, а равновесную концентрацию ацетат-ионов — исходной концентрации соли. В связи с этим выражение, по которому рассчитывается концентрация ионов Н+, можно записать иначе:
где Скислоты и Ссоли — исходные концентрации компонентов буферной системы.
Прологорифмируем полученное уравнение (с учетом того, что логарифм произведения равен сумме логарифмов сомножителей):
и умножим обе его части на -1:
Как было показано нами ранее
В связи с этим запишем уравнение для расчета концентрации ионов Н+ в окончательном виде:
Данное выражение называется иначе уравнением Гендерсона-Гассельбаха. Его можно использовать для вычисления рН любой кислотной буферной системы. Например, для фосфатного буфера уравнение Гендерсона-Гассельбаха запишется следующим образом:
(в данной системе роль слабой кислоты играет анион Н2РО4-, то .
В водных растворах рН и рОН являются сопряженными величинами. Их сумма всегда равна 14, т.е.:
Зная концентрацию ионов Н+ или рН можно вычислить концентрацию гидроксильных ионов или рОН.
Уравнения Гендерсона-Гассельбаха для расчета рОН и рН в оснoвных буферных системах выглядят следующим образом:

где pKb = -lg Kb (основания), Соснования и Ссоли — исходные молярные концентрации компонентов данных буферных систем, т.е. слабого основания и его соли с сильной кислотой.
Из приведенных выше уравнений следует, что рН и рОН буферной системы зависит от константы кислотности или основности слабого электролита, входящего в ее состав и от соотношения концентраций компонентов буфера.
Значение рК для слабого электролита является величиной постоянной, не зависит от концентрации этого электролита в растворе и приводится в соответствующих справочниках. Зная его можно с помощью уравнения Гендерсона-Гассельбаха рассчитать рН буферного раствора, если известен его количественный состав или, наоборот, определить состав раствора (исходные концентрации его компонентов), который будет обеспечивать заданное значение рН.
На практике обычно пользуются готовыми таблицами, в которых указано, в каком соотношении должны быть взяты компоненты для получения буферного раствора с желаемым значением рН.
Если концентрации веществ в буферной системе одинаковые, т.е.
Скислоты = Ссоли или Соснования = Ссоли, то
рН = рKa (для кислотной буферной системы)
pOH = pKb (для оснoвной буферной системы)
Изменяя концентрацию какого-либо компонента можно сместить значение рН в ту или иную сторону для достижения нужной величины.
В буферных системах, используемых на практике, концентрации компонентов не отличаются друг от друга более чем в 10 раз, т.е. их рН не отклоняется больше чем на единицу от величины рK своего слабого электролита. Таким образом, область практических значений рН буферных систем (область буферирования) лежит в интервале pK ± 1.
Если концентрации компонентов буферного раствора различаются более чем в 10 раз, то такой раствор обладает слабым буферным действием и может удерживать неизменным содержание ионов Н+ только при добавлении очень малых количеств сильной кислоты либо щелочи. Это делает неудобным его использование в практических целях.
При разбавлении концентрации обоих компонентов буферных растворов уменьшаются в одинаковое число раз, поэтому их соотношение остается неизменным. Следовательно по уравнению Гендерсона-Гассельбаха величина рН буферного раствора при этом тоже не должна изменяться. При разбавлении в 10-20 раз экспериментальные измерения рН хорошо согласуются с теоретическими расчетами. Однако при большем разбавлении наблюдается небольшое увеличение рН раствора, которое связано с возрастанием степени диссоциации слабого электролита и увеличением константы его диссоциации.
Уравнение Гендерсона-Гассельбаха является приближенным и его не рекомендуется использовать в следующих случаях:
- 1) если кислота либо основание буферной системы не является достаточно слабым электролитом (например, для кислоты pKa 11). Тогда нельзя пренебрегать гидролизом их солей.
Способность буферных систем противодействовать резкому изменению рН при добавлении к ним сильной кислоты или основания является ограниченной. Буферная смесь поддерживает рН постоянным только при условии, что количество вносимых в раствор сильной кислоты или щелочи не превышает определенной величины. В противном случае наблюдается резкое изменение рН, т.е. буферное действие раствора прекращается.
Это связано с тем, что в результате протекающей реакции изменяется соотношение молярных концентраций компонентов буферной системы: Скислоты/Ссоли или Соснования/Ссоли.
При этом концентрация компонента, реагирующего с добавленной кислотой или щелочью, уменьшается, а концентрация второго компонента возрастает, т.к. он дополнительно образуется в ходе реакции.
Количественно буферное действие раствора характеризуется с помощью буферной емкости (В). При этом различают буферную емкость по кислоте (Вк.) и буферную емкость по основанию или щелочи (Во.).
Буферной емкостью по кислоте является то количество химического эквивалента сильной кислоты, которое нужно добавить к 1 литру (1 дм3) буферной системы, чтобы уменьшить её рН на единицу. Ее можно рассчитать по следующей формуле:
где n(1/z HA) — число молей химического эквивалента сильной кислоты, добавленное к 1 литру буферной системы;рН1 — водородный показатель системы до добавления сильной кислоты;рН2 — водородный показатель системы после добавления сильной кислоты.
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем, выраженный в литрах или дм3) формула для подсчета буферной емкости будет иметь следующий вид:
где С(1/z НА) — молярная концентрация химического эквивалента сильной кислоты в добавляемом растворе; V(НА) — объем (л) добавленного раствора сильной кислоты; V(буферной системы) — объем буферного раствора, к которому добавляют раствор кислоты.
Соответственно буферной емкостью по основанию является то количество химического эквивалента сильного основания (щелочи), которое нужно добавить к 1 литру (1 дм3) буферной системы, чтобы вызвать увеличение ее рН на единицу:
где n(1/z В) — число молей химического эквивалента основания, которое добавили к 1 литру буферного раствора; рН1 — водородный показатель раствора до добавления основания; рН2 — водородный показатель раствора после добавления основания.
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем) формула для подсчета буферной емкости по основанию примет следующий вид:
где С(1/z В) — молярная концентрация химического эквивалента основания в добавляемом растворе; V(В) — объем (л) добавленного раствора сильного основания; V(буферной системы) — объем буферного раствора (л), к которому добавляют раствор сильного основания.
Величина буферной емкости зависит от концентраций компонентов буферной системы и от их соотношения.
Чем более концентрированным является буферный раствор, тем выше его буферная емкость, т.к. в этом случае добавление небольших количеств сильной кислоты или щелочи не вызовет существенного изменения концентраций его компонентов, а значит и их соотношения.
Из буферных растворов с одинаковым суммарным содержанием химического количества их компонентов наибольшей емкостью будут обладать те, которые составлены из равного числа молей слабой кислоты и её соли или слабого основания и его соли (рис. 35). В таких растворах молярные концентрации компонентов будут одинаковые, а значит соотношение Скислоты/Ссоли = 1 и Соснования/ Ссоли.= 1.
Рис. 35 Изменение буферной емкости (1) и изменение рН кислотной буферной системы при добавлении к ней определенного количества сильной кислоты (2) в зависимости от содержания её компонентов
Данные растворы будут иметь примерно одинаковые значения буферной емкости как по кислоте, так и по основанию.
Если же соотношение концентраций компонентов буферной системы не равно 1, то значения ее буферной емкости по основанию и кислоте будут отличаться друг от друга (причем тем существеннее, чем в большей степени соотношение Скислоты/Ссоли и Соснования/Ссоли отклоняется от единицы).
Например, если в кислотной буферной системе солевой компоненты содержится больше чем слабой кислоты, то ее буферная емкость по кислоте будет выше чем по основанию, т.е. Вк. > Во.
Соответственно буферная емкость по кислоте для основной буферной системы будет больше чем по основанию в том случае, если содержание солевой компоненты в этом случае будет меньше чем слабого основания.
Таким образом можно сделать вывод, что в данных случаях буферная емкость выше по тому веществу, которое реагирует с избыточным компонентом буферного раствора.
Если буферная система не обладает достаточной буферной емкостью, то ее можно повысить, увеличив концентрацию обоих компонентов в необходимое количество раз.
Буферные системы человеческого организма
В организме человека в результате протекания различных метаболических процессов постоянно образуются большие количества кислых продуктов. Среднесуточная норма их выделения соответствует 20-30 литрам раствора сильной кислоты с молярной концентрацией химического эквивалента кислоты равной 0,1 моль/л (или 2000-3000 ммоль химического эквивалента кислоты).
Образуются при этом и основные продукты: аммиак, мочевина, креатин и др., — но только в гораздо меньшей степени.
В состав кислых продуктов обмена веществ входят как неорганические (H2CO3, H2SO4), так и органические (молочная, масляная, пировиноградная и др.) кислоты.
Соляная кислота секретируется париетальными гландулацитами и выделяется в полость желудка со скоростью 1-4 ммоль/час.
Угольная кислота является конечным продуктом окисления липидов, углеводов, белков и различных других биоорганических веществ. В пересчете на СО2 ежесуточно ее образуется до 13 молей.
Серная кислота выделяется при окислении белков, поскольку в их состав входят серосодержащие аминокислоты: метионин, цистеин.
При усвоении 100 г белка выделяется около 60 ммоль химического эквивалента H2SO4.
Молочная кислота в большом количестве образуется в мышечных тканях при физических нагрузках.
Из кишечника и тканей образовавшиеся при обмене веществ кислые и основные продукты постоянно поступают в кровь и межклеточную жидкость. Однако подкисление этих сред не происходит и их водородный показатель поддерживается на определенном постоянном уровне.
Так значения рН большей части внутриклеточных жидкостей находится в интервале от 6,4 до 7,8, межклеточной жидкости — 6,8-7,4 (в зависимости от вида тканей).
Особенно жесткие ограничения на возможные колебания значений рН накладываются на кровь. Состоянию нормы соответствует интервал значений рН = 7,4±0,05.
Постоянство кислотно-основного состава биологических жидкостей человеческого организма достигается совместным действием различных буферных систем и ряда физиологических механизмов. К последним прежде всего относятся деятельность легких и выделительная функция почек, кишечника, клеток кожи.
Основными буферными системами человеческого организма являются: гидрокарбонатная (бикарбонатная), фосфатная, белковая, гемоглобиновая и оксигемоглобиновая. В различных количествах и сочетаниях они присутствуют в той или иной биологической жидкости. Причем только кровь содержит в своем составе все четыре системы.
Кровь представляет собой взвесь клеток в жидкой среде и поэтому ее кислотно-основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови.
Бикарбонатная буферная система является самой регулируемой системой крови. На ее долю приходится около 10% всей буферной емкости крови. Она представляет собой сопряженную кислотно-основную пару, состоящую из гидратов молекул СО2 (СО2 · Н2О) (выполняющих роль доноров протонов) и гидрокарбонат ионов НСО3- (выполняющих роль акцептора протонов).
Гидрокарбонаты в плазме крови и в других межклеточных жидкостях находятся главным образом в виде натриевой соли NaНСО3, а внутри клеток — калиевой соли.
Концентрация ионов НСО3- в плазме крови превышает концентрацию растворенного СО2 примерно в 20 раз.
Последующее снижение концентрации получившегося СО2 достигается в результате его ускоренного выделения через легкие в результате их гипервентиляции.
Если же в крови увеличивается количество оснoвных продуктов, то происходит их взаимодействие со слабой угольной кислотой:
Н2СО3 + ОН- > НСО3- + Н2О
При этом концентрация растворенного углекислого газа в крови уменьшается. Для сохранения нормального соотношения между компонентами буферной системы происходит физиологическая задержка в плазме крови некоторого количества СО2 за счет гиповентиляции легких.
Фосфатная буферная система представляет собой сопряженную кислотно-оснoвную пару Н2РО4-/НРО42-.
Роль кислоты выполняет дигидрофосфат натрия NaH2PO4, а роль ее соли — гидрофосфат натрия Na2HPO4. Фосфатная буферная система составляет всего лишь 1% буферной емкости крови. Отношение С(Н2РО4-)/С(НРО42-) в ней равно 1 : 4 и не изменяется со временем, т.к., избыточное количество какого-либо из компонентов выделяется с мочой, правда, это происходит в течение 1-2 суток, т.е. не так быстро, как в случае гидрокарбонатного буфера.
Фосфатная буферная система играет решающую роль в других биологических средах: некоторых внутриклеточных жидкостях, моче, выделениях (или соках) пищеварительных желез.
Белковый буфер представляет собой систему из белковых (протеиновых) молекул, содержащих в своих аминокислотных остатках как кислотные СООН-группы, так и оснoвные NH2-группы, выполняющие роль слабой кислоты и основания. Компоненты этого буфера могут быть условно выражены следующим образом:
💥 Видео
Буферные системы, ацидоз и алкалоз, ур-ие Гендерсона-Гассельбаха (Атриум и Учим химию)Скачать

Расчёты pH буферных растворов (видео 5) | Буферные растворы | ХимияСкачать

Уравнение Гендерсона-Хассельбаха в решении задачиСкачать

Буферные растворы и уравнение Хендерсона-Хассельбаха (видео 4) | Буферные растворы | ХимияСкачать

Буферные растворы. Практическая часть. 11 класс.Скачать

Буферные растворы. 1 часть. 11 класс.Скачать

Буферные растворыСкачать

Связь pH и pKa для буферных растворов (видео 6) | Буферные растворы | ХимияСкачать
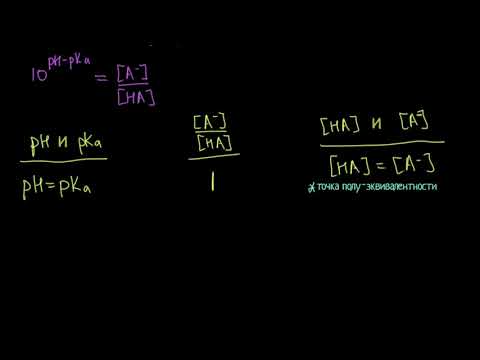
Буферные растворы. 2 часть. 11 класс.Скачать

pH и буферные растворы | Медицинская химия | МедвузаСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Буферные системыСкачать

Буферные системы. рНСкачать

Уравнение Гендерсона-ГассельбахаСкачать

3 5 Буферные растворыСкачать