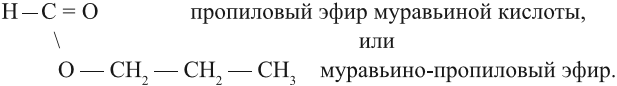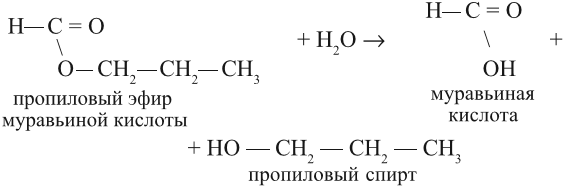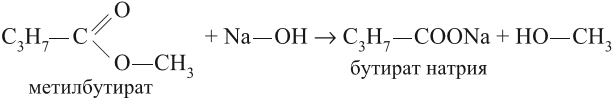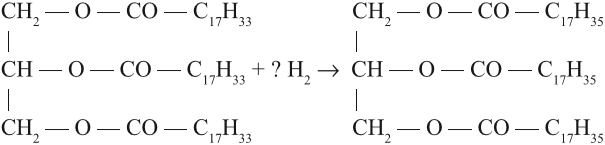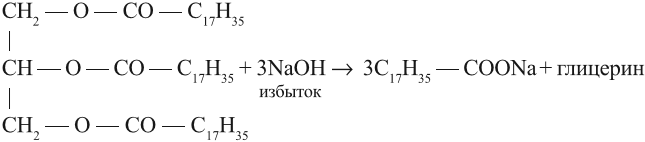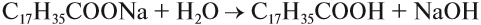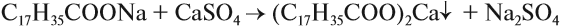Сложные эфиры: способы получения, химические и физические свойства, строение.
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
- Классификация сложных эфиров
- По числу карбоксильных групп:
- Номенклатура сложных эфиров
- Химические свойства сложных эфиров
- 2. Переэтерификация
- 3.Восстановление сложных эфиров
- Получение сложных эфиров
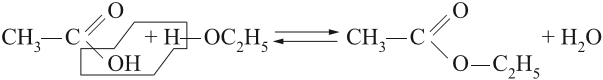
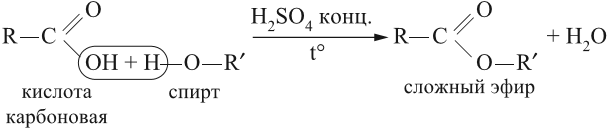
- 1. Этерификация карбоновых кислот спиртами
- 2. Соли карбоновых кислот с галогеналканами
- Acetyl
- Урок 25. Сложные эфиры. Жиры
- Выводы
- 🔥 Видео
Видео:91. Что такое реакция этерификацииСкачать

Классификация сложных эфиров
Видео:8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
| Например, метилформиат |
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
| Например, тристеарат глицерина |
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Видео:8.2. Многоатомные спирты (этиленгликоль, глицерин): Способы получения. ЕГЭ по химииСкачать

Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Видео:Реакция этерификации. Химический опытСкачать

Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
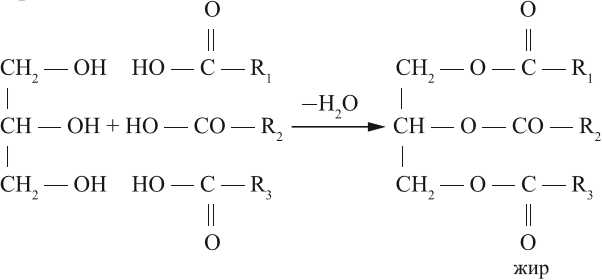
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
Видео:Удивительные свойства глицеринаСкачать

2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
Видео:Практическая работа.Получение и свойства уксусной кислоты.Скачать

3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

Получение сложных эфиров
Видео:Опыты по химии. Растворение глицерина в водеСкачать

1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Видео:Взаимодействие уксусной кислоты с металламиСкачать

2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Видео:Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Получение этилового эфира уксусной кислоты.Скачать  Урок 25. Сложные эфиры. ЖирыСложные эфиры — это продукт взаимодействия спирта с кислородсодержащей кислотой. Задание 25.1. Составьте уравнение реакции глицерина с азотной кислотой. Назовите полученное соединение. Так, при взаимодействии глицерина с азотной кислотой получается сложный эфир нитроглицерин. Разберём свойства и способ получения эфиров карбоновых кислот. Такие эфиры получаются при помощи реакции этерификации, т. е. при взаимодействии спирта с карбоновой кислотой в присутствии концентрированной серной кислоты, например: Название этого и других сложных эфиров составляют из названий кислоты и спирта. Например, название этого эфира звучит так: этиловый эфир уксусной кислоты, или уксусно-этиловый эфир. Очень часто употребляют названия эфиров, совпадающие с названиями солей данных кислот. Например, «химическое» название нитроглицерина «тринитрат глицерина». Это название совпадает с названиями солей азотной кислоты. Вопрос. Как называются соли уксусной кислоты? Поскольку углеводородный радикал спирта (в данной случае) называется этил, а соли уксусной кислоты — ацетаты, то полученный сложный эфир называется этилацетатом. Задание 25.2. Составьте уравнения реакций получения Дайте другие названия полученным эфирам. Для составления таких реакций нужно: 1. Выяснить, какая кислота образует данную соль (урок 24.4); 2. Выяснить, какой спирт имеет соответствующий радикал; 3. Записать формулы кислоты и спирта так, чтобы функциональные группы были рядом («голова к голове»); 4. Отщепить молекулу воды и соединить остатки молекул простой связью: 5. Назвать сложный эфир. При правильном выполнении задания вы получите для пропилформиата: Сложные эфиры легко подвергаются гидролизу, т. е. взаимодействуют с водой, образуя исходные кислоту и спирт: Задание 25.3. Составьте уравнения реакций гидролиза для пропилформиата, метилбутирата. Вопрос. Могут ли вещества, полученные в результате реакции гидролиза, реагировать друг с другом? Что при этом получается? Поскольку полученные кислота и спирт могут реагировать друг с другом, реакция гидролиза сложного эфира обратима. Она происходит в присутствии растворов кислот (Н + ). В присутствии щелочей реакция гидролиза сложного эфира становится необратимой (!). Вопрос. Реагирует ли с раствором щелочи: Что получается в результате возможной реакции? В результате щелочного гидролиза образуется соль кислоты и спирт: Вопрос. Почему эта реакция необратима? Задание 25.4. Составьте уравнения реакций щелочного гидролиза для: Назовите полученные вещества. Жидкие сложные эфиры, как правило, имеют приятный запах, являются хорошими растворителями. Но твёрдые сложные эфиры одноатомных спиртов запаха не имеют и по внешнему виду напоминают жир. Но это не жир, это воск. Настоящий ЖИР — это сложный эфир трёхатомного спирта глицерина и карбоновых кислот: В состав природных жиров могут входить остатки как предельных кислот (масляная, стеариновая, пальмитиновая С15Н31СООН), так и непредельных (олеиновая С17Н33СООН) кислот. Задание 25.5. Напишите формулы масляной и стеариновой кислот. Если в составе жира преобладают твёрдые предельные кислоты, то жир — твёрдый; если непредельные (жидкие) кислоты, то жир — жидкий. Задание 25.6. Напишите по приведённой выше схеме уравнения реакций:
Какое агрегатное состояние имеет каждый из полученных жиров? Названия жиров составляют, исходя из названий кислот, входящих в его состав, так как спирт, образующий жир, один и тот же — глицерин. Так, если в состав жира входят три остатка пальмитиновой кислоты, то он называется трипальмитин. Задание 25.7. Назовите жиры, полученные в предыдущем задании 25.6. Задание 25.8. Сравните состав жиров: тристеарина и триолеина. Сделайте вывод: можно ли жидкий жир (триолеин) превратить в твёрдый (тристеарин)? Как? На практике часть жидких жиров превращают в твёрдые путем гидрирования, т. е. насыщения водородом: Задание 25.9. Расставьте коэффициенты в этом уравнении. Твёрдые жиры медленнее портятся (почему?), их легче хранить, поэтому реакция гидрирования имеет большое практическое значение. Полученный искусственный жир называется саломас. Из него получают маргарин, смазочные материалы, мыло. В последнем случае проводят щелочной гидролиз саломаса твёрдого жира: Задание 25.10. Назовите полученное соединение. Мыло — это соль очень слабой органической кислоты и сильного основания (щелочи). Вопрос. Какой процесс происходит с такими солями в растворе? Поэтому мыло в растворе подвергается гидролизу, т. е. реагирует с водой; при этом образуются исходные продукты, т. е. щёлочь и кислота: Получившаяся щёлочь «щиплет» глаза, разъедает кожу рук, некоторые ткани. Кроме того, мыло плохо моет в жёсткой воде (см. урок 9.2), так как реагирует с солями кальция и магния (именно они делают воду жёсткой), образуя нерастворимые соединения: Поэтому к стеарату натрия (он составляет около 60 % хозяйственного мыла) добавляют вещества, которые уменьшают нежелательное действие чистого мыла. Так получают туалетные мыла и другие моющие составы. Жиры применяют также для получения стеарина (смесь твёрдых предельных кислот), олифы, клеёнок и др. материалов. Кроме того, жиры — обязательный компонент нашей пищи. Они являются источником энергии, которая выделяется при биохимическом окислении жира (при окислении жиров выделяется около 9 ккал/г энергии), необходимы для усвоения витаминов. Жидкие жиры более полезны для здоровья, чем твёрдые. Видео:Качественная Реакция На Салициловую И Уксусную КислотуСкачать  ВыводыСложные эфиры образуются при взаимодействии спиртов и кислородсодержащих кислот в результате реакции этерификации. Жиры — это сложные эфиры глицерина и жирных кислот. Жиры — обязательный компонент нашей пищи. 🔥 ВидеоЛабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать  Получение ледяной уксусной кислоты/Synthesis of glacial acetic acidСкачать  Как из 70 уксусной кислоты сделать уксусную эссенцию любого процентаСкачать  Получение ЛЕДЯНОЙ УКСУСНОЙ кислоты!Скачать  Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать  Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать  11.2. Карбоновые кислоты: Способы получения. ЕГЭ по химииСкачать  Химия 9 класс (Урок№31 - Карбоновые кислоты. Сложные эфиры. Жиры.)Скачать  |