Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
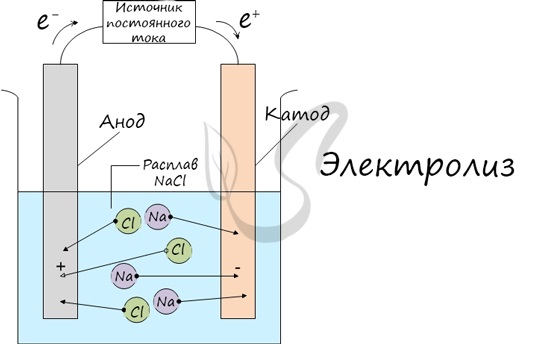
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
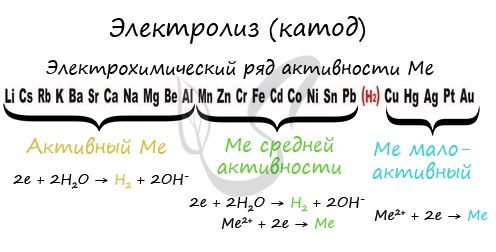
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + — 2e = H2
К аноду притягиваются анионы — отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl — , Br — , I — , F — , S 2- , CH3COO — .
При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
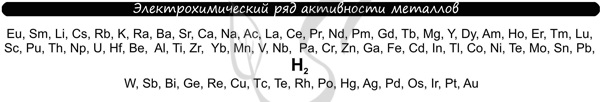
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
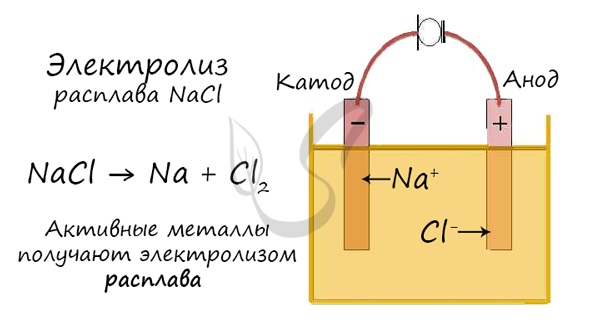
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Электролиз. 10 класс.Скачать

Электролиз
Видео:Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O | Реакция взаимодействия алюминия и азотной кислотыСкачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:How to Balance Al + AgNO3 = Ag + Al(NO3)3 (Aluminum + Silver nitrate)Скачать

Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:How to Balance Al2O3 + HNO3 = Al(NO3)3 + H2OСкачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Видео:ХИМИЯ ЕГЭ Гидролиз солей: K2CO3 KClO3 Al(NO3)3 ZnCl2 Среда раствора Сильные и слабые электролитыСкачать

Уравнения электролиза растворов al no3 3
Опубликовано 11.06.2017 по предмету Химия от Гость >>
Ответ оставил Гость
4Al (NO3)3 = 4 Al 3+ +12NO3 —
На катоде выделяется водород. Н забирает 12 электронов, а на аноде выделяется кислород, т.к. гидроксильная группа отдает 12 электронов.(гидроксильная группа образуется из воды)
12 H2O = 12OH- +12H+
12OH(-) — 12e = 6 H2O + 3O2
4al(+3) + 12NO3(-) + 18H2O = 4Al(OH)3 +6 H2 +3O2+ 12H(+) +12NO3(-)
🎬 Видео
Электролиз растворов. 3 часть. 10 класс.Скачать
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

уравнения электролизаСкачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Гидролиз солей. 9 класс.Скачать

Электролиз растворов. 1 часть. 10 класс.Скачать

Гальванические элементы. 1 часть. 10 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Урок 298. Электрический ток в жидкостях. Закон Фарадея для электролизаСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать