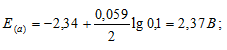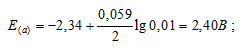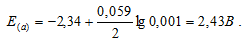Задача 652.
Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с.?
Решение: 


H20 — 2 
Серебро, потенциал которой +0,80 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ag + + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим
H20 + 2Ag + = 2H + + 2Ag 0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:


Ответ: +0,80В.
Задача 653.
Э. д. с. гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1 М раствор соли свинца, равна 126 мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода? Составить схему элемента. Какие процессы протекают на его электродах?
Решение: 
Pb 0 — 2 
А на водородном – восстановительный:
2H + + 2 
Таким образом, свинцовый электрод будет анодом, а водородный – катодом.
Уравнение окислительно-восстановительного процесса, протекающего при работе данного гальванического элемента, можно получить, сложив электронные процессы на электродах:
Pb 0 + 2H + = Pb 2+ + H2 0
Для расчета электродного потенциала свинца, можно использовать уравнение определения ЭДС гальванического элемента:
E = 

Подставив в уравнение данные задачи, получим:
Е = 



Ответ: -0,126В.
Задача 654.
Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 2+ 0,1, 0,01 и 0,001 молы/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация (при точных измерениях активность) гидратированных ионов металла в растворе. Е 0 для магния равен -2,34 В.
Определим электродные потенциалы магния в растворах при разных значениях концентрации его ионов:
а) Mg 2+ = 0,1 молы/л.
б) Mg 2+ = 0,01 молы/л.
в) Mg 2+ = 0,001 молы/л.
Ответ: а) 2,37 В; б) 2,40 В; в) 2,43 В.
Видео:Разбор схемы гальванического элементаСкачать

Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg 0 -2e — = Mg 2+
К : Cu 2+ +2e — = Cu
Mg 0 + Cu 2+ = Mg 2+ + Cu
Вычислим ЭДС гальванического элемента:
ЭДС =0,337 + 2,37 = 2,71 В
ΔG 0 298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb 0 -2e — = Pb 2+
К: 2 H + +2 e — = H 2
Pb 0 + 2H + = Pb 2+ + H2
Определим электродный потенциал свинца:
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Ni2+/Ni и E 0 Cu2+/Cu
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg 2+ ] = 0,001 моль/л, [Pb 2+ ] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg и E 0 Pb2+/Pb
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg 0 -2e — = Mg 2+
К: Pb 2+ +2 e — = Pb 0
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Составим схему гальванического элемента:
(-) Mg 0 |Mg 2+ || Pb 2+ |Pb 0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
Рассчитаем стандартную ЭДС реакции
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg, E 0 Co2+/Co, E 0 Fe2+/Fe, E 0 Ag+/Ag
Протекание реакции возможно при условии, когда E 0 восст 0 ок.
В нашем случае восстановителем является кобальт и условие E 0 восст 0 ок соблюдается только для пары
Co 0 + Ag + = Co 2+ + Ag 0
Молекулярное уравнение, например:
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химическая реакция, протекающая при работе гальванического элемента
Стандартная ЭДС медно-цинкового гальванического элемента
Если цинковый и медный электрод в этом гальваническом элементе соединить внешней цепью, сопротивление которой сравнительно невелико, то по ней потечет электрический ток. Потенциал цинкового электрода ниже, чем медного, поэтому электроны по внешней цепи будут двигаться в направлении, показанном на схеме:
Равновесия на границах раздела электрод-раствор при этом нарушатся: на цинковом электроде при уменьшении концентрации электронов равновесие Zn
+ + 2е 2п в соответствии с принципом Ле Шагелье смещается влево, а равновесие Си» + + 2е Си на медном электроде, куда «прибывают» электроны, смещается вправо.
Таким образом, при работе гальванического элемента на цинковом электроде идет процесс окисления, а на медном — процесс восстановления. Электрод, на котором идет процесс окисления, называется анодом, а электрод, на котором идет процесс восстановления — катодом’. Уравнения электродных процессов:
Гальванический элемент совершает электрическую работу, преобразуя энергию химической реакции. В данном случае суммарное уравнение реакции при работе гальванического элемента (в сокращенной ионной форме): Си :+ + 2п = Си + Zn 2+ . Эта же окислигельно- восстановигельная реакция протекает при опускании цинка в раствор соли меди.
На этом примере мы продемонстрировали, что одну и ту же окислительно-восстановительную реакцию можно осуществить в разных условиях: в одном сосуде при непосредственном контакте окислите- [1]
ля и восстановителя и в гальваническом элементе, когда процессы окисления и восстановления пространственно разделены, а передача электронов идет по внешней цепи.
Самопроизвольное протекание реакции при работе гальванического элемента, обусловливает возможность протекания этой реакции при непосредственном взаимодействии окислителя и восстановителя.
Вычислите ЭДС гальванического элемента при стандартных условиях:
Составьте уравнения электродных процессов и суммарной окислительно-восстановительной реакции, идущей при работе гальванического элемента.
Решение. В отсутствие тока на электродах устанавливаются равновесия:
которым соответствуют стандартные электродные потенциалы:
Стандартная ЭДС гальванического элемента
При замыкании внешней цепи на электродах процессы идут в определенных направлениях: на электроде с более высоким значением равновесного потенциала идет процесс восстановления, на электроде с более низким значением — процесс окисления. Запишем уравнения электродных процессов, идущих при работе гальванического элемента, и просуммируем уравнения этих процессов:
Мы получили уравнение окислительно-восстановительной реакции, проходящей при работе гальванического элемента, записанное в сокращенной ионной форме.
При работе гальванического элемента Си | Си 2+ 1| Ag + | Ag масса одного из электродов уменьшилась на 1,6 г. Рассчитайте изменение массы другого электрода.
Решение. Стандартный электродный потенциал медного электрода меньше, чем серебряного: ф°Си2+/Си =+0,34 8; ф°А8+/А, =+0,80 В.
Следовательно, при работе гальванического элемента на медном электроде идет процесс окисления, медь переходит в раствор и масса медной пластины уменьшается. На серебряном электроде происходит процесс осаждения серебра из раствора, за счет чего масса серебряной пластины увеличивается. Уравнения электродных процессов и суммарной реакции:
Коэффициенты в уравнении реакции показывают, что при растворении одного моля меди осаждаются два моля серебра. Определим число молей растворившейся меди:
Число молей выделившегося из раствора серебра и его масса:
Масса серебряной пластины увеличилась на 5,4 г.
🔍 Видео
Гальванические элементы. 1 часть. 10 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Электролиз. 10 класс.Скачать

Уравнивание реакций горения углеводородовСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Гальванические элементы. Практическая часть. 10 класс.Скачать

ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТСкачать

Эту задачу ГРИГОРИЙ ПЕРЕЛЬМАН решил в 10-м классеСкачать

Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

Гальванический элементСкачать

Химия 11 класс (Урок№8 - Химические источники тока. Ряд стандартных электродных потенциалов.)Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Гальванические элементы. 2 часть. 10 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Технологический институт - гальванический элемент, электролиз, коррозия. Задачи.Скачать