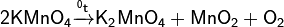Читайте также:
|
| Вещество | Константа диссоциации | ||
| К I | К II | К III | |
| HF | 6,6 ∙ 10 -4 | — | — |
| HNO2 | 4,0 ∙ 10 -4 | — | — |
| H2S | 1,1 ∙ 10 -7 | 1,0 ∙ 10 -14 | — |
| H2SO3 | 1,6 ∙ 10 -2 | 6,3 ∙ 10 -8 | — |
| H2CO3 | 4,5 ∙ 10 -7 | 4,8 ∙ 10 -11 | — |
| H2SiO3 | 1,3 ∙ 10 -10 | 2,0 ∙ 10 -12 | — |
| H3PO4 | 7,5 ∙ 10 -3 | 6,3 ∙ 10 -8 | 1,3 ∙ 10 -12 |
| NH4OH | 1,8 ∙ 10 -5 | — | — |
| Cu(OH)2 | — | 3,4 ∙ 10 -7 | — |
| Fe(OH)2 | — | 1,3 ∙ 10 -4 | — |
| Fe(OH)3 | — | 1,8 ∙ 10 -11 | 1,4 × 10 -12 |
| Zn(OH)2 | 4,4 ∙ 10 -5 | 1,5 ∙ 10 -9 | — |
| Mg(OH)2 | — | 2,5 ∙ 10 -3 | — |
| Pb(OH)2 | 9,6 ∙ 10 -4 | 3,0 ∙ 10 -8 | — |
| Mn(OH)2 | — | 5,0 · 10 -4 | — |
| Al(OH)3 | — | — | 1,38 ∙ 10‾ 9 |
Ba(OH)2 и Mn(OH)2относятся к классу гидроксидов, являются основаниями, которые при растворении в воде под действием полярных молекул растворителя диссоциируют на ионы ОН — и ионы основного остатка. Формулы средних основных остатков приведены в верхней строке таблицы растворимости (табл. 3).
Ba(OH)2 — гидроксид бария,является сильным основанием (a=1), диссоциирует необратимо и в одну ступень с образованием двух ионов ОН — и одного иона основного остатка: Ba(OH)2 → Ва 2+ + 2ОН — .
Таблица растворимости солей, кислот и оснований в воде
| Катион | H + | K + , Na + | NH4 + | Mg 2+ | Ca 2+ | Cu 2+ | Zn 2+ | Mn 2+ | Fe 2+ | Fe 3+ | AI 3+ | Ва 2+ |
| Анион | ||||||||||||
| OH — | Р | Р | Н | М | Н | Н | Н | Н | Н | Н | Р | |
| CI — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| S 2- | Р | Р | Р | ─ | ─ | Н | Н | Н | Н | Н | ─ | ─ |
| SO3 2- | Р | Р | Р | М | М | ─ | М | Н | М | ─ | ─ | Н |
| SO4 2- | Р | Р | Р | Р | М | Р | Р | Р | Р | Р | Р | Н |
| CO3 2- | Р | Р | Р | М | Н | Н | Н | ─ | Н | ─ | ─ | Н |
| HCO3 — | Р | Р | Р | Р | Р | ─ | ─ | ─ | Р | Р | Р | Р |
| SiO3 2- | Н | Р | Р | Н | Н | Н | Н | ─ | Н | Н | Н | Н |
| РО4 3 ─ | Р | Р | ─ | Н | Н | Н | Н | Н | Н | Н | Н | Н |
Р ─ растворимое вещество, М ─ малорастворимое, Н ─ нерастворимое, «─» ─ разлагается водой
Mn(OH)2 — гидроксид марганца (II),относится к слабым электролитам (табл. 1, 2), степень его диссоциации a + + ОН ─ ; К I Mn(OH)2 = 
Вторая ступень диссоциации Mn(OH)2 :
II. MnOH + ↔ Mn 2+ + ОН ─ ; K II Mn(OH)2 =
Na2SO3, NaHSO3, MnCl2, (MnOH)Clотносятся к классу солей, являются сильными электролитами, имеют степень диссоциации, равную единице. Соли диссоциируют необратимо и в одну ступень на основные и кислотные остатки (табл. 2).
гидросульфита натрия: NaHSO3 ® Na + + HSO3 — ;
хлорида марганца: MnCl2 ® Mn 2+ + 2Cl — ;
гидроксохлорида марганца: (MnOH)Cl ® MnOH + + Cl — .
Задание 2.Напишите молекулярные, полные и сокращённые ионно-молекулярные уравнения реакций взаимодействия между:
а) нитратом цинка и сульфидом натрия;
б) хлоридом аммония и гидроксидом калия;
в) карбонатом натрия и азотной кислотой.
Укажите причину протекания реакции двойного обмена между растворами электролитов.
Дата добавления: 2015-01-05 ; просмотров: 21 | Нарушение авторских прав
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Оксиды и гидроксиды марганца
Получение марганца
Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
Химические свойства
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при нагревании разлагает воду, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Оксиды и гидроксида марганца
| Оксиды | MnO | Mn2O3 | MnO2 | (MnO3) | Mn2O7 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | Сильно кислотные |
| Гидроксиды | Mn(OH)2 | Mn(OH)3 | Mn(OH)4 H2MnO3 | H2MnO4 | HMnO4 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | сильно кислотные |
| Названия | гидроксид марганца (II); солиMn(II) | гидроксид марганца (III); солиMn(III) | гидроксид марганца (IV); манганаты(IV) | Марганцевая (VI) кислота; манганаты(VI) | марганцевая (VII)кислота;перманганаты |
Оксиды и гидроксиды марганца
Соединения марганца (II).Оксид и гидроксид марганца (II) проявляют только основные свойства. Они нерастворимы в воде, но легко растворяются в кислотах с образованием солей двухвалентного марганца.
Большинство солей двухвалентного марганца хорошо растворимы в воде и подвергаются гидролизу по катиону. К труднорастворимым солям относятся средние соли – сульфид, фосфат и карбонат.
В кристаллическом состоянии соли марганца (II) имеют слабо розовую окраску, в водных растворах – практически бесцветны.
Гидроксид двухвалентного марганца образуется косвенным путём – действием щёлочи на растворы солей. В момент образования образуется белый осадок (чаще наблюдаемый как телесный), который на воздухе постепенно буреет под действием кислорода воздуха:
Оксид марганца (II) MnO — твердое вещество зеленого цвета — можно получить восстановлением оксида марганца (IV) в токе водорода:
MnO2+Н2=MnO+Н2О
MnO — типичный основной оксид, с водой в реакцию не вступает. Ему соответствует гидроксид марганца (II), Mn(ОН)2, представляющий собой слабое основание. В виде осадка телесного цвета выпадает при взаимодействии щелочей с солями марганца (II):
MnСl2+2NaOH=Mn(OH)2¯+2NaCl
Mn(OH)2+2HCl=MnСl2+2H2O
Соли марганца (II), как правило, хорошо растворимы в воде, кроме Mn3(PO4)2, MnS, MnCO3.
Соединения марганца (III).Соли трёхвалентного марганца окрашены в тёмный цвет и склонны к образованию комплексных солей (ацидокомплексов). Все соли марганца (III) малоустойчивы. В кислом растворе они легко восстанавливаются до солей марганца (II). В нейтральном растворе простые соли легко гидролизуются с образованием гидроксида Mn(III), который быстро переходит на воздухе в гидроксид марганца (IV). Гидроксид марганца (III) –Mn2O3 ּН2О или MnО(OH) встречается в природе в виде минерала манганита(бурая марганцевая руда).
• В природе встречаются минералы браунит, курнакит и биксбиит — оксид марганца с различными примесями.
• Окисление оксида марганца(II):
• Восстановление оксида марганца(IV):
Соединения марганца (IV).Оксид Mn(IV) наиболее устойчивое при обычных условиях кислородное соединение марганца.MnO2 и соответствующий ему гидроксид практически нерастворимы в воде.
Получение оксида марганца 4:
· В лабораторных условиях получают термическим разложением перманганата калия.
· но реакция, в действительности, следует по уравнению:
· Также можно получить реакцией перманганата калия с пероксидом водорода.
· При температуре выше 100 °C перманганат калия восстанавливается водородом:
Химические свойства
1)При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2) Хлорид марганца(II) – в безводном состоянии представляет собой листочки светло-розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (по этой реакции в лабораториях получают хлор)
3) MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (реакция идет при сплавлении)
Гидроксид марганца (IV) проявляет амфотерный характер– кислотный и основной в равн Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO3)2:
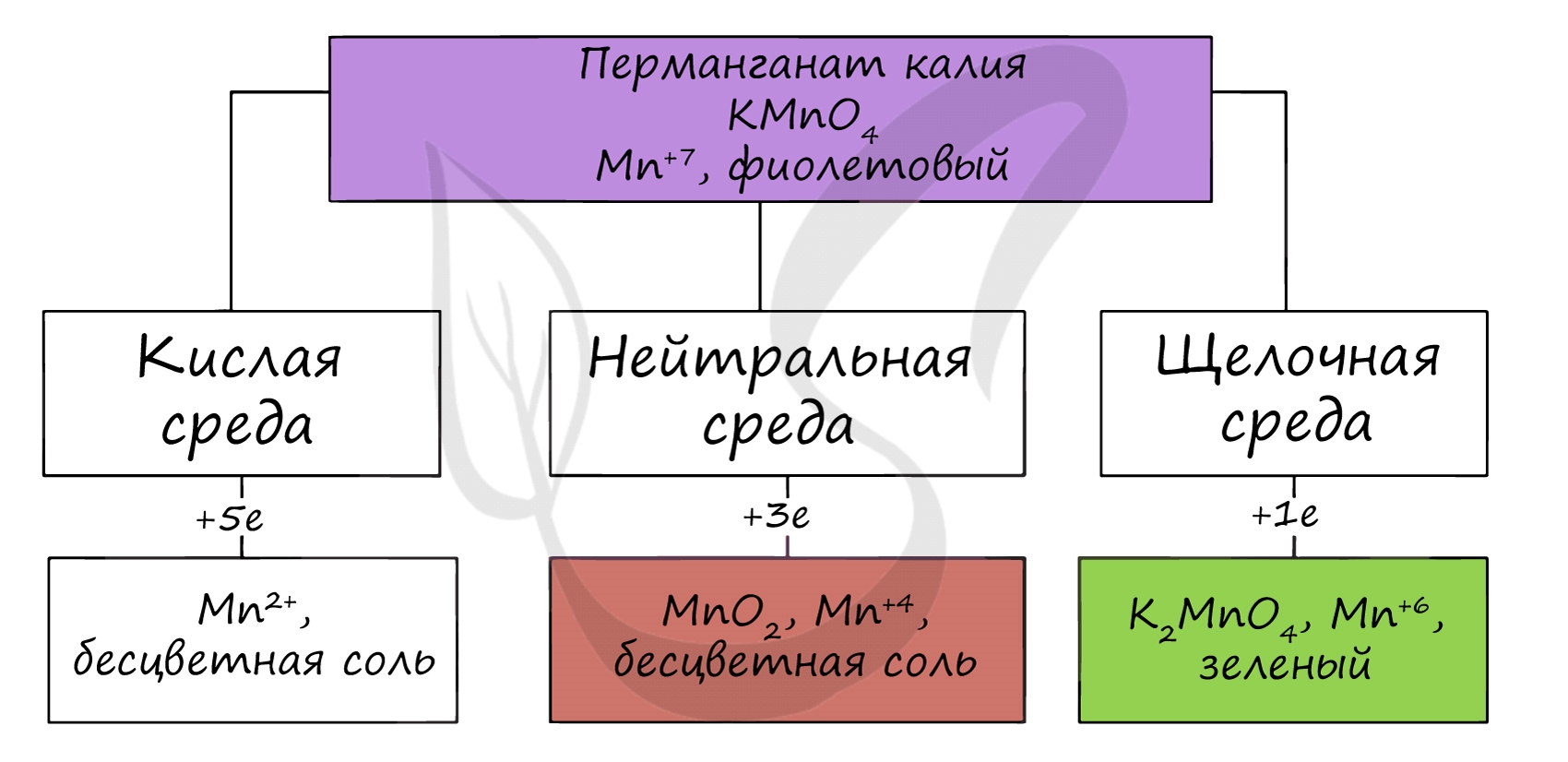
Соединения марганца (VI).Оксид шестивалентного марганца в свободном виде не выделен. Гидроксид марганца (VI) проявляет кислотный характер. свободная марганцевая (VI) кислота неустойчива и диспропорционирует в водном растворе по схеме:
Манганаты (VI) образуются при сплавлении диоксида марганца со щёлочью в присутствии окислителей и имеют изумрудно-зелёную окраску. В сильно щелочной среде манганаты (VI) довольно устойчивы. При разбавлении щелочных растворов происходит гидролиз, сопровождающийся диспропорционированием:
Манганаты (VI) – сильные окислители, восстанавливающиеся в кислой среде доMn(II), а в нейтральной и щелочной средах – доMnO2. Под действием сильных окислителей манганаты (VI) могут быть окислены доMn(VII):
При нагревании выше 500 о С манганат (VI) распадается на продукты:
манганат (IV) и кислород:
Соединения марганца (VII).Оксид марганца (VII) – Mn2O7 выделяется в виде темно-зеленой маслянистой жидкости при действии концентрированной серной кислоты на перманганат калия:
Оксид марганца (VII) устойчив до 10 о С и разлагается со взрывом по схеме:
При взаимодействии Mn2O7с водой образуется марганцовая кислотаHMnO4, которая имеет фиолетово-красную окраску:
Безводную марганцовую кислоту получить не удалось, в растворе она устойчива до концентрации 20 %. Это очень сильная кислота, кажущаяся степень диссоциации в растворе концентрации 0,1 моль/дм 3 равна 93 %.
Марганцовая кислота – сильный окислитель.Еще энергичнее взаимодействуетMn2O7, горючие вещества при соприкосновении с ним воспламеняются. Оксид марганца(VII) Mn2O7 – марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия:
1)Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
2) При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
3) Под действием сильных окислителей ион Mn 2+ переходит в ион MnO4 − :

4) Перманганат калия применяется как антисептическое средство. Водные растворы его различной концентрации от 0,01 до 0,5% применяются для дезинфекции ран, полоскания горла и других антивоспалительных процедурах. Успешно 2 – 5% растворы перманганата калия употребляются при ожогах кожи (кожа подсушивается, и пузырь не образуется). Для живых организмов перманганаты являются ядами (вызывают коагуляцию белков). Их обезвреживание производят 3 %-ным раствором Н2О2, подкисленным уксусной кислотой:
5)Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
7) Все соли марганца (II) в ОВР, протекающих в растворах, являются восстановителями:
8) Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
9) Mn(CN)2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN)2 = K4[Mn(CN)6] гексоцианоманганат калия
Применение цветов:
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Марганец, цинк и серебро
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит
Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
- Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды.
Реакции с кислотами
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.
Для цинка характерна постоянная степень окисления +2.
Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
- Реакции с неметаллами (и аммиаком 🙂
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Реакции с кислотами
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
- Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Реакции с кислотами
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
С органическими веществами
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
📺 Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать

Электролиз сульфата МАРГАНЦАСкачать

Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

72. Электролитическая диссоциацияСкачать

Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Теория электролитической диссоциацииСкачать

Красивые опыты с соединениями марганца. [ChemistryToday]Скачать
![Красивые опыты с соединениями марганца. [ChemistryToday]](https://i.ytimg.com/vi/E1R5QRg36Xw/0.jpg)
9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Химические свойства марганца. Часть 1.Скачать

ОВР с соединениями марганца, хрома железа и меди | Химия с Юлией ВишневскойСкачать

Химия 11 класс Теория электролитической диссоциацииСкачать