Видео:Коррозия металла. Химия – ПростоСкачать

Решение задач по химии на защиту металлов от коррозии
Задание 290.
Какое покрытие металла называется анодным и какое — катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытий железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
Решение:
По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий можно привести Cu, Ni, Ag. При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, катодные покрытия могут защищать металл от коррозии при отсутствии пор и повреждений покрытия. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия могут служить Zn, Cr.
При покрытии железа медью возникает коррозионная пара, в которой медь является катодом, а железо – анодом, так как железо имеет более отрицательный стандартный электродный потенциал (-0,44 В), чем медь (0,34 В). При этом будут протекать следующие электрохимические процессы:
а) Во влажном воздухе:
Анодный процесс: Fe 0 -2 
Катодный процесс: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
б) В хлороводородной (соляной) кислоте:
Анодный процесс: Fe 0 -2 
Катодный процесс: 2Н + + 2 
Водород будет выделяться во внешнюю среду, а ионы железа Fe 2+ с хлорид-ионами Cl – будут образовывать соль FeCl2 – сильного электролита, т. е. железо будет разрушаться с образованием ионов железа Fe 2+ .
Таким образом, при покрытии железа медью при повреждении или при образовании пор разрушается основной металл – железо. Это пример катодного покрытия металла.
Задание 291.
Железное изделие покрыли кадмием. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте, Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
При покрытии железа кадмием образуется гальваническая пара, в которой кадмий является катодом, а железо – анодом. Объясняется это тем, что стандартный электродный потенциал кадмия (-0,40 В) немного больше, чем стандартный электродный потенциал железа (-0,44 В). Поэтому при нарушении кадмиевого покрытия будут происходить следующие электрохимические процессы:
а) Во влажном воздухе:
Анодный процесс: Fe 0 -2 
Катодный процесс: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
б) В хлороводородной (соляной) кислоте:
Анодный процесс: Fe 0 -2 
Катодный процесс: 2Н + + 2 
Водород будет выделяться во внешнюю среду, а ионы железа Fe 2+ с хлорид-ионами Cl – будут образовывать соль FeCl2 – сильного электролита, т. е. железо будет разрушаться с образованием ионов железа Fe 2+ .
Таким образом, кадмий является катодом в гальванической паре Fe — Cd, значит, это катодное покрытие. При катодном покрытии во время коррозии разрушается основной металл .
Задание 292.
Железное изделие покрыли свинцом. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
При покрытии железного изделия свинцом образуется гальваническая пара Fe — Pb, в которой свинец является анодом, а железо – катодом. Объясняется это тем, что свинец имеет более электроотрицательный стандартный электродный потенциал (-0,126 В), чем железо (-0,44 В). Значит, это покрытие – анодное. При нарушении свинцового покрытия будут происходить следующие электрохимические процессы:
а) Во влажном воздухе:
Анодный процесс: Pb 0 -2 
Катодный процесс: 1/2O2 + H2O + 2 
Так как ионы Pb 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии свинца будет Pb(OH)2.
б) В хлороводородной (соляной) кислоте:
Анодный процесс: Pb 0 -2 
Катодный процесс: 2Н + + 2 
Водород будет выделяться во внешнюю среду, а ионы свинца Pb 2+ с хлорид-ионами Cl – будут образовывать соль PbCl2 – сильного электролита, т. е. свинец будет разрушаться с образованием ионов свинца Pb 2+ .
Таким образом, свинец является анодом в гальванической паре Fe — Pb, значит, это анодное покрытие. При анодном покрытии во время коррозии разрушается само покрытие, а основная конструкция не разрушается.
Видео:Электролиз. 10 класс.Скачать

Please wait.
Видео:Электрохимическая коррозия (алюминий — медь)Скачать

We are checking your browser. gomolog.ru
Видео:Химия 11 класс (Урок№9 - Коррозия металлов и её предупреждение.)Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Электрохимическая коррозияСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6dfc278b9dd13a5f • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:ЭлектролизСкачать

КОРРОЗИЯ МЕТАЛЛОВ И МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ
Коррозия – это самопроизвольное разрушение металлов под действием окружающей среды.
В большинстве случаев коррозия протекает по электрохимическому механизму. Электрохимическая коррозия возникает во влажных средах и
связана с возникновением коррозионного гальванического элемента. При электрохимической коррозии анодным процессом является окисление металла, а катодным – в большинстве случаев – восстановление ионов водорода или растворенного в воде кислорода.
Вследствие этого следует различать два вида электрохимической коррозии: с водородной (1) и кислородной деполяризацией (2):
1) анодный процесс: Ме – 2 ē = Ме 2+
катодный процесс: 2Н + + 2 ē = Н2 (медленная стадия)
2) анодный процесс: Ме – 2 ē = Ме 2+
катодный процесс: О2 + 2Н2О +4 ē = 4ОН — (медленная стадия)
Коррозия с водородной деполяризацией наблюдается в кислых средах, где содержание Н + велико (рН ≤ 6); при большем рН, коррозия протекает с кислородной деполяризацией.
Коррозии с водородной деполяризацией в кислой среде будут подвергаться металлы, стандартный электродный потенциал которых меньше +0,00 В (например, Fe, Ni, Zn,), в нейтральной — меньше – 0,41 В, а в щелочной- меньше – 0,82 В.
С кислородной деполяризацией в насыщенной кислородом кислой среде будут корродировать те металлы, стандартный электродный потенциал которых меньше +1,23 В, в нейтральной — меньше +0,81 В, а в щелочной — меньше + 0,4 В.
Рассмотрим процесс коррозии железа в атмосферных условиях, когда железо под действием воздуха и воды быстро покрывается ржавчиной.
Коррозионный процесс при этом можно записать следующим образом:



В результате вторичных процессов окисления Fe(OH)2 кислородом воздуха и дегидратации воды по уравнениям:
4Fe(OH)2 + O2 + 2H2O 
образуется смешанный гидратированный оксид xFeO∙yFe2O3∙nH2O, называемый ржавчиной.
Скорость коррозии металлов зависит от многих факторов. Наиболее распространенные из них:
1. Наличие на поверхности металла тонких пленок малорастворимых соединений — оксидов, гидроксидов, солей или их смесей. Эти пленки блокируют поверхность металла, приводя его в пассивное состояние.
Например, скорость коррозии алюминия (Е 0 =-1,66 В) в атмосферных условиях значительно меньше скорости коррозии железа (Е 0 =-0,44 В), хотя стандартный электродный потенциал алюминия более отрицателен, чем у железа. Это связано с тем, что на поверхности алюминия имеется плотная, хорошо сцепленная с поверхностью алюминия оксидная пленка Al2O3, препятствующая переносу электронов, а у железа оксидная пленка рыхлая и непрочная.
2.1. Наличие в коррозионной среде ионов галогенов (например, Cl — , Br — ), способствует коррозии за счет их адсорбции на поверхности металла и разрушения оксидной пленки.
2.2. Присутствие в растворе таких частиц, как NH3, CN — , способных образовывать с металлом комплексные соединения, резко увеличивает скорость коррозии металлов.
2.3. Растворенное в воде вещество может давать с металлом или продуктами его коррозии пленку малорастворимых соединений, тем самым делая пассивной его поверхность. Например, Е°Pb 2+ /Pb = — 0,126 В, т.е. свинец термодинамически неустойчив в кислых средах, однако при растворении в разбавленной серной кислоте на поверхности металла образуется труднорастворимая солевая пленка PbSO4, препятствующая коррозии.
3. Природа катодных участков. Анодный процесс окисления металла и катодный процесс восстановления окислителя являются сопряженными, то есть чем быстрее протекает катодная реакция, тем быстрее корродирует металл. Известно, что коррозия металла с водородной деполяризацией протекает
тем быстрее, чем меньше перенапряжение реакции выделения водорода
( 
Например, цинк (Е°(Zn 2+ /Zn) = -0,763 В) неустойчив в кислых средах. Однако, из-за большого перенапряжения водорода на нем ( 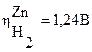

МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
Защитные покрытия. Защитные покрытия можно разделить на неметаллические (слои красок, лаков, резины, эмалей, пластмасс и др.) и металлические.
Металлические защитные покрытия подразделяют на анодные и катодные.
К анодным покрытиям относятся покрытия из тех металлов, которые имеют меньший стандартный электродный потенциал, чем потенциал защищаемого металла. В случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, а не защищаемый металл. Примером анодных покрытий могут служить хром или цинк, нанесенные на железо. В случае нарушения целостности, например, хромового покрытия при контакте с влажным воздухом образуется короткозамкнутый гальванический элемент
А (–) Cr | H2O, O2 | Fe (+) К в, котором протекают следующие реакции:
на аноде Cr – 2 ē = Cr 2+

Таким образом, в результате электрохимической коррозии разрушается анодное покрытие, а конструкция остается целой.
Катодные покрытия — это покрытия из металлов, имеющих более положительный стандартный электродный потенциал по сравнению с
потенциалом защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности покрытия оно перестает защищать металл от коррозии.
В качестве примера можно привести оловянное покрытие на железе (луженое железо).
Рассмотрим работу гальванического элемента, возникающего в этом случае:
на аноде Fe – 2 ē = Fe 2+

Таким образом, анодные покрытия наиболее эффективны, так как защищают основной металл даже в случае нарушения целостности, тогда как катодные покрытия защищают металл лишь механически.
Электрохимическая защита. Различают три вида электрохимической защиты: протекторная, катодная и анодная.
а)при протекторной защитек защищаемому от коррозии изделию присоединяют металл с более электроотрицательным потенциалом (протектор). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. В качестве протектора часто используют сплавы магния, цинк.
б)катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите, присоединяется к отрицательному полюсу внешнего источника тока. В ту же среду помещают металлолом, который подсоединяют к положительному полюсу внешнего источника тока. Металлический лом, являясь анодом, подвергается разрушению, предохраняя от разрушения защищаемую конструкцию.
в) анодная защита используется только для тех металлов, которые при анодной нагрузке способны образовывать на своей поверхности пассивные оксидные или солевые пленки, защищающие металл от коррозии, например, железо в серной кислоте. Анодная защита отличается от катодной тем,
что защищаемая конструкция присоединяется к положительному полюсу
внешнего источника тока. В ту же среду помещают металлолом, который соединяют с отрицательным полюсом внешнего источника тока.
Пример 15. Склепаны два металла: Mn – Al . Укажите, какой из металлов подвергается коррозии в атмосферных условиях?
Решение: Al имеет более отрицательное значение стандартного электродного потенциала (Е 0 (Al 3+ /Al) = -1,663 В), чем марганец (Е 0 (Mn 2+ /Mn) = =-1,179 В). Поэтому в имеющейся гальванопаре марганец будет выступать в роли катода, а алюминий — в роли анода и, следовательно, корродировать.
Схема коррозионного гальванического элемента будет выглядеть следующим образом: ( — ) Al | O2, H2O | Mn ( + ).
Процессы, протекающие при коррозии:

Пример 16. Какие из металлов Ag, Al, Cu, Ti являются для железа анодными и катодными покрытиями?
Решение.Стандартный электродный потенциал железа Е 0 (Fe 2+ /Fe) = -0,44В. Потенциалы металлов, выполняющих роль покрытия:
К анодным покрытиям относятся покрытия из металла, имеющего меньшее значение Е 0 относительно потенциала защищаемого металла, а к катодным – с наибольшим Е 0 . Сравнивая значения Е 0 указанных металлов с Е 0 (Fe 2+ /Fe), можно сделать вывод: покрытия из алюминия и титана являются анодными покрытиями, а покрытия из серебра и меди − катодными.
Пример 17.Хром в контакте с медью находится в кислой среде (НСl). Какой металл будет коррозировать? Составить схему коррозионного гальванического элемента и записать реакции, протекающие при его работе.
Решение. Коррозионные процессы аналогичны процессам в гальваническом элементе. Исходя из значений стандартных электродных потенциалов находим, что более активным является хром ( 

имеющий меньший электродный потенциал. Следовательно, в образующемся гальваническом элементе хром будет анодом, а медь – катодом:
На аноде пойдёт реакция окисления хрома Сr -2ē ®Cr 2+ .
Коррозия активных металлов в кислых средах протекает с водородной деполяризацией. Поэтому на меди (катоде) пойдёт реакция восстановления ионов водорода 2H + + 2ē ® H2.
Суммарный электродный процесс выразится следующим уравнением:
Cr + 2H + ® Cr 2+ + H2,
или в молекулярном виде: Cr + 2 HCl 
Пример 18.Как протекает коррозия стальных трубопроводов при использовании цинковых протекторов во влажном грунте?
Решение. Цинк, подсоединённый к трубопроводу, образует гальваническую пару, в которой он, как более активный металл ( 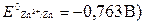
Окислителем при грунтовой коррозии, как и в большинстве случаев электрохимической коррозии, является растворенный во влажном грунте кислород. Процессы, протекающие при коррозии, можно записать следующим образом:




Пример 19.Цинковая и железная пластины помещены в водный раствор NaCl (аналог морской воды) и подсоединены к внешнему источнику постоянного тока: цинковая — к (-), а железная к (+) полюсу. Какая из пластин защищена от коррозии? Запишите уравнения коррозионного процесса.
Решение. Так как цинковая пластина подсоединена к отрицательному полюсу
источника тока, она будет являться катодом и не будет корродировать, а железная пластина, присоединенная к (+) − анодом. Под действием электрического тока в образованной системе будет протекать электролиз. Растворяться будет железная пластина, а на цинковой будут протекать процессы восстановления:
Aнод (+): Fe — 2ē = Fe 2+

Пример 20.В морской воде находятся две пластины из кадмия, одна из которых частично покрыта оловом. В каком случае кадмий будет корродировать с большей скоростью?
Решение. Коррозия кадмия в морской воде протекает с кислородной деполяризацией. Процессы, протекающие при коррозии, можно записать следующим образом:




Восстановление кислорода на кадмии происходит с перенапряжением h=0,45 В.
В контакте кадмия с оловом возникает гальванопара Cd|O2, H2O│Sn. Сравнивая 





Протекающие реакции аналогичны процессам в первом случае с той разницей, что восстановление кислорода происходит на олове с большим перенапряжением h=1,21 В.
Катодный процесс в обоих случаях является самым медленным и определяет скорость всего коррозионного процесса в целом. Перенапряжение восстановления кислорода на олове больше, следовательно, восстановление кислорода на олове протекает с затруднением. Таким образом, коррозия кадмия в контакте с оловом будет происходить с меньшей скоростью.
Пример 21. Железная пластина изолоченая железная пластина с нарушенным покрытием находятся в соляной кислоте (HCl). В каком случае скорость коррозии железа будет больше?
Решение. Коррозия железа в кислой среде протекает с водородной деполяризацией. Процессы, протекающие при коррозии, можно записать следующим образом:
А: Fe – 2ē 

Fe + 2Н + = Fe 2+ +Н2
Восстановление Н + на железе происходит с перенапряжением h=0,7В.
В случае золоченого железа с нарушенным покрытием возникает гальванопара Fe│H + │Au. Сравнивая 

А: Fe – 2ē 

Fe + 2Н + = Fe 2+ +Н2
Протекающие реакции аналогичны процессам в первом случае. Восстановление водорода происходит на золоте с перенапряжением h=0,4 В.
Катодный процесс в обоих случаях является самым медленным и определяет скорость всего коррозионного процесса в целом. Перенапряжение восстановления Н + на золоте меньше, следовательно, восстановление Н + на золоте протекает легче. Таким образом, коррозия железа с нарушенным покрытием из золота будет происходить с большей скоростью.
Пример 23.В каких из перечисленных ниже водных растворах:
а) NaCl; б) NH4OH; в) NaOH; г) HCl и H2SO4 никель будет коррозионно устойчив? Ответы обосновать.
Решение: а) в водном растворе NaCl оксидная пленка на поверхности
никеля будет растворяться. Это связано с тем, что ионы Cl — (также как и ионы Br — и I — ), адсорбируясь на поверхности оксидной пленки, вытесняют и замещают кислород, делая ее растворимой и пористой. Это увеличивает скорость анодного процесса, и коррозия никеля будет протекать по схеме

б) никель в водном растворе NH4OH будет корродировать, так как молекулы NH3, связывая ионы Ni 2+ в слабодиссоциированные комплексные ионы, смещают потенциал никеля (-0,25 В) в более отрицательную сторону до значений -0,49 В, т.е. металл становится активнее:


в) в растворе NaOH Ni не корродирует, так как оксидная пленка никеля, покрывающая металл, трудно растворима и обладает основными свойствами.
г) разбавленные растворы HCl и H2SO4 растворяют оксидную пленку, и никель, как имеющий более отрицательный потенциал, чем потенциал выделения водорода, растворяется с водородной деполяризацией по схеме:

Ni + 2H + = Ni 2+ + H2
Задания
6. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте уравнения анодного и катодного процессов.
7. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение и составьте уравнения анодного и катодного процессов. Напишите уравнения протекающих химических реакций.
8. Как происходит коррозия луженого железа в атмосферных условиях и кислой среде при нарушении покрытия? Составьте уравнения анодного и катодного процессов.
9. Если пластину из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив уравнения анодного и
катодного процессов. Напишите уравнение протекающей химической реакции.
10. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов.
11. Железное изделие покрыли никелем. Анодное или катодное это покрытие? Почему? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
12. Составьте уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и во втором случаях?
13. В раствор НС1 поместили цинковую пластину и цинковую пластину, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив уравнения соответствующих процессов.
14. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
15. Какое покрытие называется анодным, а какое – катодным? Назовите несколько металлов, которые могут служить анодными и катодными покрытиями для железа. Составьте уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
16. Железное изделие покрыли кадмием. Анодное или катодное такое покрытие? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
17. Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте уравнения анодного и катодного
процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
18. Две железные пластины, частично покрытые оловом и медью, находятся во влажном воздухе. На какой из этих пластин быстрее образуется ржавчина? Почему? Составьте уравнения анодного и катодного процессов коррозии этих пластин. Каков состав продуктов коррозии железа?
19. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром?
Составьте уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии?
20. Если в разбавленную серную кислоту опустить пластину из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Почему прекращается? Однако если цинковой палочкой прикоснуться к железной пластине, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте уравнения анодного и катодного процессов.
21. Цинковую и железную пластины опустили в раствор сульфата меди. Составьте уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинах, если наружные концы пластин соединить проводником?
22. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластину и цинковую пластину, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте уравнения анодного и катодного процессов.
23. Составьте уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях?
24. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте уравнения анодного и катодного процессов. Что изменится, если эту систему поместить в соляную кислоту?
25. Серебряную и цинковую пластины опустили в раствор сульфата меди. Составьте уравнения реакций, происходящих на этих пластинах. Какие процессы будут проходить на пластинах, если наружные концы пластин соединить проводником?
26. Одно железное изделие покрыли никелем, другое – оловом. Обосновать, к какому типу относятся покрытия. Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия в кислой среде. В каком случае коррозия будет происходить активнее?
27. Составьте уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары олово-медь. Какие продукты коррозии образуются в первом и во втором случаях?
28. Свинцовую и цинковую пластины опустили в раствор нитрата серебра. Составьте уравнения реакций, происходящих на этих пластинах. Какие процессы будут проходить на пластинах, если наружные концы их соединить проводником?
29. Почему в конструкциях, омываемых водой, не следует одновременно применять сочлененные детали из железа и алюминия? Приведите схему коррозии в случае небрежной эксплуатации таких деталей. Составьте уравнения анодного и катодного процессов.
30. В каком случае будет быстрее разрушаться цинковое покрытие, нанесенное на: а) железо; б) кобальт? В чем разница и почему? Напишите уравнения анодного и катодного процессов, происходящих при коррозии в кислой среде.
31. Трущиеся поверхности гребных валов защищают от коррозии, применяя облицовки из бронзы (сплава меди с оловом). Составьте схему коррозии стального вала в морской воде при появлении в облицовке трещин.
32. Приведите примеры катодного и анодного покрытия для кобальта. Составьте уравнения анодных и катодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
33. Учитывая величину перенапряжения реакции восстановления ионов водорода, объясните, почему амальгамирование цинка резко снижает его коррозию, а контакт с медью — увеличивает? Запишите коррозионные процессы.
34. Почему контакт с никелем усиливает коррозию цинка в кислой среде? На каком металле наблюдается выделение водорода? В контакте с каким металлом, никелем или платиной, цинк растворяется быстрее?
35. Как влияет контакт с никелем, свинцом и медью (раздельно) на скорость коррозии олова в кислых средах? Запишите схемы коррозионных процессов.
36. Никель очень медленно выделяет водород из кислот. Почему скорость выделения водорода на никеле резко возрастает, если он находится в контакте с цинком? Какой металл при этом окисляется? Почему выделение водорода идет преимущественно на никеле?
37. Корродирует ли медь в водных растворах HCl, NH4OH в присутствии кислорода? Запишите реакции. С какой деполяризацией возможна коррозия меди?
38. Как протекает коррозия меди в атмосферных условиях? Чем вызвано образование зеленого налета на медных изделиях после длительного пребывания на воздухе? Чем можно объяснить преобразование зеленого налета в черный после нагревания меди?
39. Почему в обескислороженной воде железо практически не корродирует, а в атмосферных условиях скорость коррозии железа значительна? Запишите возможные схемы коррозионных процессов.
40. Как и почему влияют на скорость коррозии цинка примеси Cu, Pb, Fe? Объяснить и написать соответствующие реакции.
41. Какие процессы протекают при коррозии оцинкованного железа с нарушенным покрытием в водном растворе NaCl и в атмосферных условиях? Составьте схемы коррозионных гальванических элементов. Какую роль играет присутствие в воде хлорида натрия?
42. Как протекает коррозия луженой меди с нарушенным покрытием в кислой среде и в атмосферных условиях? Какой металл подвергается коррозии?
43. Вода не действует на алюминий даже при повышенной температуре. Почему при попадании в воду NaCl алюминий начинает корродировать? Напишите схему коррозионных процессов.
44. Почему железо, менее активный металл, корродирует в атмосферных условиях быстрее алюминия? Сравните коррозионную устойчивость этих металлов в чистой воде и в водном растворе NaCl.
45. Железная пластинка в контакте с медной находится в водном растворе KCl. Запишите катодный и анодный процессы коррозии и уравнения реакций.
46. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии в атмосферных условиях? Составьте схему образующегося гальванического элемента и напишите реакции, протекающие на электродах.
47. Никелевая и кадмиевая пластинки находятся в водном растворе серной кислоты. Если соединить концы пластинок проводником, то на никелевой пластинке будет происходить выделение водорода. Дать объяснение этому явлению, привести схему коррозионного процесса.
48. Учитывая перенапряжение выделения водорода, объясните, как влияют на скорость коррозии алюминия в кислой среде (HCl) примеси Cu, Pb, Fe? Запишите схему коррозионного процесса.
49. Какие процессы протекают при коррозии оцинкованного и луженого железа с нарушенным покрытием в водном растворе СаCl2 и в атмосферных условиях? Составьте схемы коррозионных гальванических элементов. Какую роль играет присутствие в воде хлорида кальция?
50. Покрытые алюминием и медью железные пластины с нарушенными покрытиями находятся во влажном воздухе. На какой из пластин появится ржавчина? Составьте схемы коррозионных гальванических элементов и запишите уравнения протекающих реакций.
51. Магниевая пластина в контакте с железной находятся в морской воде. С какой деполяризацией протекает коррозия? Запишите уравнения реакций.
52. Как протекает коррозия освинцованной меди с нарушенным
покрытием и меди в контакте с марганцем в кислой среде и в атмосферных условиях? Какой из металлов подвергается коррозии? Составьте схемы коррозионных гальванических элементов и запишите реакции.
53. Объясните, почему хромовое защитное покрытие на стали может быть пористым, а оловянное должно быть сплошным? Составьте схемы
коррозионных процессов при нарушении покрытия для атмосферных условий.
54. Запишите уравнения коррозионных процессов стального изделия с нарушенным титановым покрытием в кислой и в нейтральной средах?
55. Какой из металлов подвергается коррозии, если оцинкованная и никелированная стальные детали с нарушенным покрытием находятся в кислой среде? Составьте схемы коррозионных гальванических элементов и запишите соответствующие электродные реакции.
56. Алюминий и никель в контакте с медью находится в кислой среде. Какой из металлов подвергается коррозии? Составьте схему коррозионных процессов.
57. В каком из растворов: сульфата или хлорида меди, кадмий более энергично вытесняет медь? Учитывая, что в результате гидролиза солей среда является слабокислой, составьте схемы коррозионных процессов.
58. Объясните, почему в местах контакта стали с алюминием возникает язвенная коррозия алюминия. Запишите коррозионные процессы для атмосферных условий.
59. Железо, покрытое свинцом и кадмием, находится во влажном грунте. Как будет протекать коррозия при нарушении целостности покрытий? В каком случае скорость коррозии будет выше?
60. В контакте с каким из металлов, Pb или Fe, цинк более коррозионно нестоек в морской воде? Ответ дайте на основании данных: hО2 Zn >hO2 Pb >hO2 Fe .
61. Алюминиевая и железная пластины, находящиеся в водном растворе NaCl, подсоединены к источнику постоянного тока: А1 к (-), а Fe к (+). Какая из пластин защищена от коррозии? Составьте схему коррозионных процессов.
62. Катодный метод защиты паровых котлов от коррозии заключается в том, что одним из электродов является сам котел, а другой электрод помещается внутри котла в виде металлолома. Подаваемый через такую систему слабый ток
подавляет коррозию. Какой из электродов и почему является катодом? Напишите уравнения протекающих реакций.
63. Алюминиевая пластина в контакте с железной находится в водном растворе NaCl. С какой деполяризацией протекает коррозия? Составьте схемы коррозионных гальванических элементов и запишите реакции.
64. Объясните, почему цинковое покрытие на стали может быть пористым и в то же время сохранять свои защитные свойства, а никелевое должно быть сплошным? Запишите уравнения соответствующих коррозийных процессов в атмосферных условиях.
65. Как протекает коррозия железа, покрытого марганцем: а) в кислой среде и б) в атмосферных условиях при нарушении целостности покрытия? Составьте схемы коррозионных гальванических элементов и запишите уравнения протекающих процессов.
66. Как протекает коррозия хромированного стального изделия: а) в кислой и б) нейтральной средах при нарушении целостности покрытия? Составьте схемы коррозионных гальванических элементов и запишите уравнения протекающих процессов.
67. Пластина никелированного цинка (пористое покрытие) находится во влажной атмосфере. Какой металл корродирует? С кислородной или водородной деполяризацией протекает коррозия? Запишите уравнения протекающих процессов.
68. Цинк в контакте с медью и свинцом подвергается атмосферной коррозии. Составьте уравнения коррозионных процессов. В каком случае коррозия идет быстрее?
69. На стальную пластину поставлена медная заклепка. Как протекает коррозия в атмосферных условиях? Запишите уравнения протекающих процессов.
70. Для защиты изделий из железа от коррозии используют, например цинкование или никелирование. В каком случае нарушение целостности покрытия в большей степени влияет на разрушение стали? Напишите уравнения процессов, протекающих при коррозии в морской воде.
71. В качестве защиты железных изделий от коррозии их покрывают оловом. Разберите процессы, протекающие при нарушении покрытия в кислой и нейтральной средах?
72. Стальная конструкция находится в морской воде. Как будет протекать коррозия с цинковым протектором? Запишите уравнения протекающих при этом процессов.
73. Конструкция из алюминия находится в морской воде. Для защиты конструкции применяют катодный метод, присоединив ее к отрицательному полюсу источника постоянного тока, а железную пластину − к положительному полюсу. Какие процессы при этом протекают?
74. Никелевая и железная пластины, погруженные в водный раствор соляной кислоты, подсоединены к источнику постоянного тока: никелевая к (-), железная к (+). Какая из пластин защищается от коррозии? Запишите уравнения протекающих процессов.
75. При протекторной защите стальных изделий в качестве протекторов могут быть использованы цинк, магний и алюминий. Напишите реакции на катодных и анодных участках, протекающие в морской воде для двух металлов.
76. Для защиты металлов от коррозии в ряде случаев применяется протекторная защита. В качестве протектора для стальных изделий можно применять сплавы на основе магния. Напишите уравнения реакций на протекторе и изделии при коррозии в морской воде.
77. Какие металлы могут быть использованы в качестве протектора при защите медных изделий в морской воде? Напишите уравнения реакций, протекающих на протекторе и защищаемом изделии.
78. Никелевая и алюминиевая пластины, погруженные в раствор H2SO4, подсоединены к источнику постоянного тока: никелевая к (+), алюминиевая к
(-). Какая из пластин защищается от коррозии? Какие процессы протекают на электродах?
79. Две оловянные пластины, одна из которых находится в контакте с медью, а другая с ртутью находятся в кислой среде. В каком случае скорость коррозии олова выше? Составьте уравнения соответствующих процессов.
Стандартные окислительно-восстановительные потенциалы
🔥 Видео
Гальванические элементы. 1 часть. 10 класс.Скачать

Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

Коррозия металловСкачать

Меднение Металлов DIY Copper PlatingСкачать

Как ПОКРЫТЬ ЗОЛОТОМ ЛЮБОЙ МЕТАЛЛ?Скачать

Покрасил Металл Электричеством! Цветное Анодирование!Скачать

Химия 9 Коррозия металловСкачать

8. Коррозия металловСкачать

Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Электрохимическая защита. Катодная защитаСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Электролитическое рафинирование медиСкачать

Лекция 6Скачать

Общая и неорганическая химия. Электролиз солей и коррозия металловСкачать
