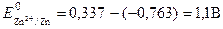В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg 0 -2e — = Mg 2+
К : Cu 2+ +2e — = Cu
Mg 0 + Cu 2+ = Mg 2+ + Cu
Вычислим ЭДС гальванического элемента:
ЭДС =0,337 + 2,37 = 2,71 В
ΔG 0 298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb 0 -2e — = Pb 2+
К: 2 H + +2 e — = H 2
Pb 0 + 2H + = Pb 2+ + H2
Определим электродный потенциал свинца:
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Ni2+/Ni и E 0 Cu2+/Cu
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg 2+ ] = 0,001 моль/л, [Pb 2+ ] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg и E 0 Pb2+/Pb
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg 0 -2e — = Mg 2+
К: Pb 2+ +2 e — = Pb 0
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Составим схему гальванического элемента:
(-) Mg 0 |Mg 2+ || Pb 2+ |Pb 0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
Рассчитаем стандартную ЭДС реакции
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg, E 0 Co2+/Co, E 0 Fe2+/Fe, E 0 Ag+/Ag
Протекание реакции возможно при условии, когда E 0 восст 0 ок.
В нашем случае восстановителем является кобальт и условие E 0 восст 0 ок соблюдается только для пары
Co 0 + Ag + = Co 2+ + Ag 0
Молекулярное уравнение, например:
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции
Видео:Электролиз. 10 класс.Скачать

ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА. ТОКООБРАЗУЮЩАЯ РЕАКЦИЯ. ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Самопроизвольно идущий окислительно-восстановительный процесс в определенных условиях может создавать электрическую энергию. Процессы превращения химической энергии в электрическую можно использовать для создания химических источников тока (ХИТ), простейший из которых гальванический элемент.
Гальванический элемент состоит из двух электродов, погруженных в электролиты, которые замыкаются электролитическим ключом.
Металлический электрод — это металл, погруженный в раствор собственной соли, не является инертным, а участвует в электродной реакции. Cхематично такой электрод записывают в виде Ме|Ме n + , где вертикальная черта обозначает границу между металлом и раствором. Уравнение Нернста для металлических электродов имеет вид

где 
Окислительно-восстановительный (редокс-) электрод – это инертный металл (токоподвод), погруженный в электролит, содержащий одновременно окисленную и восстановленную формы потенциалопределяющих частиц. В качестве инертного металла чаще всего используют платину Pt. Схематично такой электрод можно записать в виде Pt│Me n + , Me m + . На поверхности инертного металла протекает окислительно-восстановительная реакция. Например, для окислительно-восстановительного электрода Pt│Sn 4+ , Sn 2+ такими реакциями могут быть: Sn 2+ — 2 ē → Sn 4+ ; Sn 4+ + 2 ē → Sn 2+
Уравнение Нернста для редокс- систем включает концентрацию обоих катионов и имеет вид

где [окисл], [восст] – концентрации окисленной и восстановленной форм потенциалопределяющих частиц в полуреакции.
Газовыеэлектроды состоят из инертного металла, который находится в одновременном контакте с газом и раствором, содержащим ионы этого газа. Представителями газовых электродов являются водородный, кислородный, хлорный и другие электроды.
Водородный электрод состоит из платиновой пластинки, покрытой слоем мелкодисперсной платины («платиновой черни») и погруженной в раствор кислоты, содержащий ионы водорода. Через раствор непрерывно пропускается поток водорода, водород адсорбируется на поверхности платины, и на границе электрод/раствор устанавливается равновесие:
При давлении водорода, равном 101,3 кПа (1 атм), активности (концентрации) ионов водорода 1 моль/л и Т=298К водородный электрод называется стандартным водородным электродом. Потенциал такого электрода принимается за ноль.
Уравнение Нернста для водородного электрода имеет вид

где 


Рассмотрим работу гальванического элемента на примере элемента Даниэля-Якоби. Он представляет собой два сосуда с 1М растворами CuSO4 и ZnSO4, в которые погружены соответственно медная и цинковая пластинки, соединенные проводом. Сосуды соединены между собой трубкой, которая называется солевым мостиком, заполненной раствором электролита (например, KCl). Солевой мостик является электролитическим ключом.
Электрод с меньшим значением потенциала заряжается отрицательно, является анодом. Электрод с большим значением потенциала заряжается положительно, является катодом. На аноде протекает процесс окисления
(отдача электронов), на катоде – процесс восстановления (присоединение электронов).
Гальванические элементы принято записывать в виде схем. Анод со знаком (-) записывают слева, катод со знаком (+) записывают справа. Например, схема медно-цинкового гальванического элемента Даниэля-Якоби может быть представлена таким образом:






Одна вертикальная черта на схеме обозначает границу между металлом и раствором электролита, две черты – границу между растворами (солевой мостик).
При замыкании цепи электроны по внешней цепи пойдут от анода к катоду – от цинка к меди. При этом на электродах протекают следующие реакции:
(-) Анод: Zn – 2 ē → Zn 2+ реакция окисления
(+) Катод: Cu 2+ + 2 ē →Cu реакция восстановления
Суммируя процессы на катоде и аноде, получаем уравнение окислительно-восстановительной реакции, за счет которой в гальваническом элементе возникает электрический ток:
Zn + Cu 2+ = Zn 2+ + Cu
Такое уравнение называется уравнением токообразующей реакции.
ЭДС гальванического элемента рассчитывают как разность потенциалов катода и анода: Е = Ек– Еа.
Если концентрация ионов в растворе составляет 1 моль/л, то ЭДС называется стандартной. Стандартная ЭДС медно-цинкового элемента при 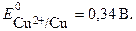


Пример 7. Рассчитайте ЭДС свинцово-цинкового гальванического элемента при Т = 298К, в котором [Zn 2+ ]=0,1моль/л и [Pb 2+ ]=0,01моль/л. Укажите знаки полюсов, напишите уравнения электродных процессов, составьте схему гальванического элемента. Укажите направление движения электронов при замыкании цепи.
Решение: ЭДС гальванического элемента рассчитывают как разность
равновесных потенциалов катода и анода: Е= Ек – Еа.
Поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л, рассчитаем по уравнению Нернста (ур. 4) значения электродных потенциалов цинка и свинца:

(-) А: Zn – 2 ē → Zn 2+
Электрод с большим значением потенциала является катодом (свинцовый электрод), на нем протекает реакция восстановления:
(+) К: Pb 2+ + 2 ē → Pb
Уравнение токообразующей реакции: Zn + Pb 2+ → Zn 2+ + Pb.
Схема гальванического элемента: (-) Zn│Zn 2+ (0,1M)║Pb 2+ (0,01M)│Pb (+).
Рассчитываем ЭДС гальванического элемента:
Е= Ек – Еа =
При замыкании цепи, электроны во внешней цепи пойдут от отрицательно заряженного электрода к положительно заряженному электроду, то есть — от цинка к свинцу.
Пример 8. Для гальванического элемента
Pt│Cr 3+ (0,1 моль/л), Cr 2+ (0,01 моль/л)║Н + (рН=2)│Н2, Pt
рассчитать ЭДС, написать уравнения электродных процессов, составить уравнение токообразующей реакции, указать знаки полюсов. Определить направление движения электронов во внешней цепи.
Решение: данный гальванический элемент составлен из окислительно-
восстановительного и водородного электродов.
Потенциал окислительно-восстановительного электрода рассчитываем по уравнению Нернста:
Стандартный потенциал пары Сr 3+ /Cr 2+ 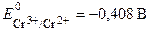

Второй электрод данного гальванического элемента является водородным электродом. Потенциал его, согласно уравнению Нернста:
Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет играть роль анода (отрицательный полюс), а водородный электрод – катода (положительный полюс). После замыкания цепи на первом электроде будет протекать анодный процесс окисления, на втором – катодный процесс восстановления:

Суммарная токообразующая реакция описывается уравнением
2 Cr 2+ + 2 Н + → 2 Cr 3+ + Н2
Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному: от хромового окислительно-восстановительного электрода к водородному.
ЭДС данного элемента
Пример 9. Какие процессы протекают на электродах в концентрационном гальваническом элементе, имеющем цинковые электроды, если у одного из электродов концентрация ионов цинка Zn 2+ равна 1 моль/л, а у другого –
0,0001 моль/л? Какова ЭДС этого элемента? Напишите схему данного ГЭ.
Решение: Концентрационный гальванический элемент состоит из одинаковых электродов, погруженных в растворы своих солей различной концентрации. Определим потенциалы обоих электродов. Так как концентрация ионов цинка
у первого электрода равна 1 моль/л, то потенциал его будет равен стандартному потенциалу цинкового электрода: 
Потенциал второго электрода рассчитаем по уравнению Нернста:

Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: (-) А: Zn — 2 ē →Zn 2+
Токообразующая реакция в гальваническом элементе будет иметь вид:
Zn + Zn 2+ → Zn + Zn 2+
Рассчитываем ЭДС элемента: Е = Ек — Еа = — 0,763 –(-0,881) = 0,122 В.
Данный гальванический элемент можно отобразить схемой:
(-) Zn│Zn 2+ (0,0001 моль/л)║Zn 2+ (1 моль/л)│Zn (+)
Задания
4.Написать катодный и анодный процессы, уравнение токообразующей реакции и вычислить ЭДС гальванического элемента. Указать полярность электродов.
1. Fe| Fe +2 (1моль/л) || Ag + (0,1моль/л) |Ag
2. Cr| Cr +3 (2 моль/л ) || Cd +2 (1 моль/л )|Cd
3. Be| Be +2 (0,1моль/л) || Ni +2 (0,01моль/л) |Ni
4. Mn| Mn +2 (0,1 моль/л ) || Sn +2 (0,01 моль/л )|Sn
5. Al| Al +3 (2 моль/л ) || Cd +2 (0,1 моль/л )|Cd
6. Ni| Ni +2 (0,1 моль/л ) || Cu +2 (0,01 моль/л )|Cu
7. Mg| Mg +2 (1 моль/л ) || Zn +2 (0,01 моль/л )|Zn
8. Cd| Cd +2 (0,1 моль/л ) || Pb +2 (0,01 моль/л )|Pb
9. Fe| Fe +2 (0,01 моль/л ) || Fe +2 (1 моль/л )|Fe
10. Co|Co +2 (0,5 моль/л ) || Ni +2 (0,5 моль/л )|Ni
11. Zn| Zn +2 (1 моль/л ) || Cu +2 (0,01 моль/л )|Cu
13. Al|Al +3 (1 моль/л ) ||Al +3 (2 моль/л )|Al
14. Mn|Mn +2 (1 моль/л ) || Ni +2 (0,01 моль/л )|Ni
15. Ca|Ca +2 (0,1 моль/л) || Fe +2 (0,01 моль/л )|Fe
16. Pb|Pb +2 (1 моль/л ) || Ag + (0,1 моль/л )|Ag
17. Be|Be +2 (0,001 моль/л ) || Fe +2 (0,001 моль/л )|Fe
18. Pt|Cr +3 (0,1 моль/л ),Cr +2 (0,1 моль/л) || Fe +3 (0,1 моль/л ), Fe +2 (0,1 моль/л)|Pt
19. Zn|Zn +2 (1 моль/л ) || Fe +2 (0,01 моль/л)|Fe
20. Al|Al +3 (2 моль/л ) || Cu +2 (0,01 моль/л)|Cu
21. Be|Be +2 (1 моль/л ) || Cd +2 (0,01 моль/л )|Cd
22. Mn|Mn +2 (0,01 моль/л ) || Fe +2 (0,01 моль/л )|Fe
23. Fe|Fe +2 (1 моль/л ) || Sn +2 (0,01 моль/л)|Sn
24. Mg|Mg +2 (0,1 моль/л ) || Ni +2 (0,01 моль/л )|Ni
25. Ag|Ag + (0,001 моль/л) || Ag + (0,1 моль/л )|Ag
26. Fe| Fe +2 (0,005 моль/л ) || Pb +2 (0,005 моль/л )|Pb
27. Ca|Ca +2 (1 моль/л ) || Mg +2 (0,01 моль/л)|Mg
28. Mn|Mn +2 (0,01 моль/л ) || Zn +2 (0,01 моль/л )|Zn
29. Pb|Pb +2 (0,1 моль/л ) ||Cu +2 (0,01 моль/л)|Cu
30. Zn|Zn +2 (10 -4 моль/л ) || Sn +2 (10 -2 моль/л )|Sn
31. Cd| Cd +2 (10 -4 моль/л ) || Cu +2 (10 -2 моль/л )|Cu
32. Ni| Ni +2 (0,01 моль/л ) || Ag + (1 моль/л )|Ag
33. Mg| Mg +2 (0,001 моль/л ) || Mg +2 (1 моль/л )|Mg
34. Ca| Ca +2 (1 моль/л )|| Cr +2 (0,01 моль/л )|Cr
35. Mn|Mn +2 (0,01 моль/л ) || Pb +2 (0,01 моль/л )|Pb
36. Al| Al +3 (2 моль/л ) || Cr +2 (0,01 моль/л )|Cr
37. Be| Be +2 (1 моль/л ) || Sn +2 (0,01 моль/л )|Sn
38. Ni| Ni +2 (1 моль/л )|| Fe +3 (2 моль/л )|Fe
39. Pt , H2|H + (pH=4) || Ag + (1 моль/л )|Ag
40. Mg| Mg +2 (10 -2 моль/л ) || Cu +2 (10 -2 моль/л )|Cu
41. Cu| Cu +2 (0,01 моль/л ) || Ag + (0,1 моль/л )|Ag
42. Ca| Ca +2 (0,01 моль/л ) || Be +2 (1 моль/л )|Be
43. Zn| Zn +2 (0,01 моль/л ) || Ni +2 (1 моль/л )|Ni
44. Al| Al +3 (2 моль/л ) || Fe +2 (0,01 моль/л )|Fe
45. Ca| Ca +2 (1 моль/л ) || Al +3 (0,5 моль/л )|Al
46. Fe| Fe +3 (2 моль/л ) || Cu +2 (0,01 моль/л )|Cu
47. Zn| Zn +2 (1 моль/л ) || Pb +2 (0,01 моль/л )|Pb
48. Sn| Sn +2 (0,01 моль/л ) || Ag + (0,1 моль/л )|Ag
49. Zn| Zn +2 (10 -2 моль/л ) || H + (pH=2)|H2,Pt
50. Pt| Sn +4 (0,1 моль/л ),Sn +2 (0,1 моль/л ) || Hg +2 (1 моль/л )|Hg
51. Al| Al +3 (2 моль/л ) || Cd +2 (0,01 моль/л )|Cd
52. Pt|Cr +3 (10 -2 моль/л ),Cr +2 (0,1 моль/л ) || Sn +4 (10 -3 моль/л ),Sn +2 (0,1 моль/л )|Pt
53. Ni| Ni +2 (0,01 моль/л ) || Pb +2 (0,01 моль/л )|Pb
54. Mg| Mg +2 (10 -4 моль/л ) || H + (pH=2)|H2,Pt
55. Cd| Cd +2 (10 -2 моль/л ) || Cd +2 (1 моль/л )|Cd
56. Be| Be +2 (10 -4 моль/л ) || Zn +2 (10 -2 моль/л )|Zn
57. Mn| Mn +2 (1 моль/л ) || Cu +2 (0,1 моль/л)|Cu
58. Ca| Ca +2 (0,01 моль/л ) || Pb +2 (0,01 моль/л )|Pb
59. Sn| Sn +2 (0,01 моль/л ) || Cu +2 (1 моль/л )|Cu
60. Cd| Cd +2 (10 -1 моль/л ) || Sn +2 (10 -1 моль/л )|Sn
61.Pt|Fe +3 (10 -2 моль/л ),Fe +2 (0,1 моль/л ) || Sn +4 (10 -2 моль/л ),Sn +2 (0,1 моль/л )|Pt
62.Pt|Co +3 (10 -2 моль/л ), Co +2 (0,1 моль/л ) ||Sn +4 (0,1 моль/л ),Sn +2 (10 -2 моль/л )|Pt
63. Pt|Fe +3 (0,1 моль/л ), Fe +2 (10 -2 моль/л ) ||Au + (10 -2 моль/л ), Au +3 (0,1 моль/л )|Pt
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

П 14. Гальванический элемент.
Написание уравнений электродных процессов, токообразующей реакции в гальваническом элементе. Расчет энергии Гиббса токообразующей реакции, расчет электродвижущей силы гальванических элементов. Построение поляризационных кривых электродов в гальваническом элементе.
Пример 1.Работагальванического элемента при стандартном состоянии. Расчет стандартной ЭДС гальванического элемента. Поляризационные кривые.
Рассмотрите работу серебряно-цинкового гальванического элемента. Напишите катодные и анодные процессы, рассчитайте стандартную ЭДС элемента при 298 К двумя способами.
Решение.Выпишем из таблицы приложения 6 [1] значения стандартных электродных потенциалов цинка и серебра:


Т.к. 
Электродные реакции для серебряно-цинкового элемента записываются следующим образом:
Суммируя анодную и катодную реакции, получаем уравнение токообразующей реакции (ТОР):
Zn + 2Ag + → 2Ag + Zn 2+ .
Рассчитаем стандартную ЭДС гальванического элемента Е 0 Э .
1 способ: рассчитаем 

2 способ: Электродвижущая сила элемента связана с энергией Гиббса ТОР 

где п — количество моль-эквивалентов вещества.
В общем случае, для ТОР реакции:
протекающей в ГЭ при стандартных состояниях веществ при Т = 298 К, энергия Гиббса 

В соответствии с этим рассчитываем стандартную энергию Гиббса ТОР 
Рассчитаем стандартную ЭДС по известной энергии Гиббса: 
Значения 
В работающем ГЭ при прохождении тока I напряжение U меньше ЭДС из-за явления поляризации катода (DEК) и анода (DЕА) и омического падения напряжения на сопротивлении r1 в проводниках с электронной проводимостью (проводниках первого рода) и на сопротивлении r2 в электролите (проводнике второго рода)

Поляризацией называется изменение потенциала электрода при прохождении электрического тока: 
В гальваническом элементе при прохождении электрического тока потенциал анода становится более положительным, а потенциал катода – более отрицательным, что приводит к уменьшению напряжения U.
Ход поляризационных кривых ГЭ: 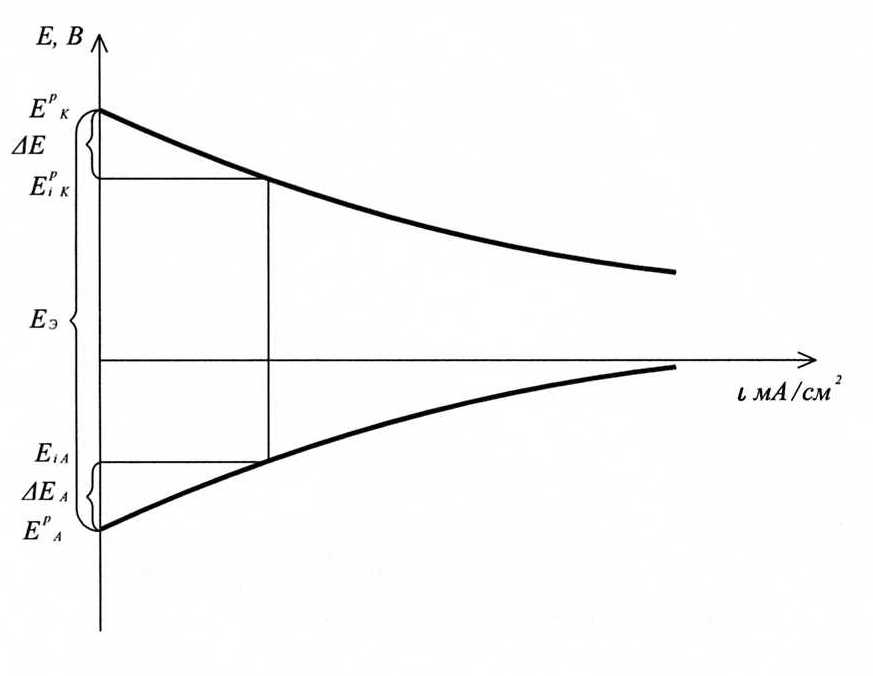
Пример 2.Расчет ЭДСгальванического элемента при нестандартном состоянии.
Рассчитать ЭДС серебряно – цинкового ГЭ при Т = 298 К, если активность Zn 2+ и Ag + равны по 0,01 моль/л.
Решение. Процессы, протекающие в ГЭ, и стандартная ЭДС элемента те же, что в примере 1.
Равновесные потенциалы электродов рассчитываем по уравнению Нернста для металлических электродов при 298 К



ЭДС заданного ГЭ:

Пример 3.Расчет величины максимально вырабатываемой электроэнергии в гальваническом элементе.
Рассчитайте величину максимальной электроэнергии, которая может быть выработана серебряно – цинковым ГЭ при уменьшении массы анода на 1 г в результате протекания электрохимической реакции при условиях заданных в примере 1.
Решение. Количество электричества Q, прошедшего через электродную поверхность, рассчитывается из объединенного закона Фарадея:

где F – число Фарадея F = 96500Кл или F =26,8 А . час;
М – молярнаямасса вещества, г/моль;
n – число электронов, принимающих участие в электрохимическом процессе;
Q – количество электричества, израсходованное на превращение вещества, Кл;

Анодом в заданном ГЭ является цинковый электрод, молярная масса
Рассчитаем 

Максимально вырабатываемая электроэнергия (электрическая работа Wэл max ) в гальваническом элементе связана с ЭДС о энергией Гиббса ТОР:


Тогда 
Пример 4.Расчет ЭДСгальванического элемента при нестандартном состоянии. Способы увеличения ЭДС.
Рассчитайте ЭДС цинк-хлорного ГЭ, если 


Решение.Согласно табл. приложения 6 [1] значения стандартных электродных потенциалов:


Рассчитаем значения равновесных электродных потенциалов для соответствующих электродов по уравнению Нернста.
Для потенциалопределяющей реакции Zn 2+ + 2 


Для потенциалопределяющей реакции Cl2(газ) + 2 


Так как 


А — : Zn – 2 
К + : Cl2 + 2 
ТОР: Zn + Cl2 → Zn 2+ + 2Cl –
Вычислим значение ЭДС ГЭ: 
В общем случае, для ТОР реакции:
ЭДС гальванического элемента для ТОР при активности ионов отличных от 1 моль/л можно рассчитать из выражения:

где аВ, аD, аL , aM, – активности веществ; b, d, l, m – стехиометрические коэффициенты ТОР. Для твердых веществ активности принимают равными единице, для газов используют относительное парциальное давление.
ЭДС цинк-хлорного гальванического элемента при 298 К:

Увеличить ЭДС данного ГЭ можно, если:
– уменьшить активность ионов Zn 2+ ;
– уменьшить активность ионов Cl – ;
– увеличить парциальное давление Cl2 .
Пример 5. Концентрационный гальванический элемент.
Рассчитайте ЭДС концентрационного ГЭ:
H2,Pt | НCl || СН3СООН| H2,Pt , работающего при одинаковых давлениях 
Решение.Для кислой среды уравнения электродных реакций в концентрационном элементе:
А — : H2 → 2H + + 2
К + : 2H + + 2 
Величина равновесного потенциала этих электродов определяется по уравнению


Рассчитаем активность ионов водорода 
а) в растворе уксусной кислоты: СН3СООН 
т.к. уксусная кислота является слабым электролитом, то коэффициент активности γ 





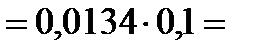


б) в растворе соляной кислоты: HCl → H + + Cl – , т.к. НСl является сильным электролитом, то сначала рассчитываем ионную силу раствора :

затем по таблице находим коэффициент активности γ 


Т.к. 

📽️ Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

Химия | Молекулярные и ионные уравненияСкачать

Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Электрохимическая коррозия (алюминий — медь)Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Основы электрохимииСкачать

Задача №34 на электролиз и объем газов | ЕГЭ по химии 2024Скачать

уравнения электролизаСкачать

Классификация реакций: ионные и радикальные реакцииСкачать

Гальванические элементыСкачать
Гальванические элементы. Практическая часть. 10 класс.Скачать