- Блог об энергетике
- энергетика простыми словами
- Основные термодинамические процессы
- Изохорный процесс
- Изобарный процесс
- Изотермический процесс
- Адиабатный процесс
- Политропный процесс
- Адиабатический процесс | Все его важные концепции и графические кривые
- Тема обсуждения: адиабатический процесс.
- Определение адиабатического процесса
- Адиабатический процесс Пример
- Формула адиабатического процесса
- Идеальный газ
- Вывод адиабатического процесса
- Адиабатический процесс Работа выполнена.
- Адиабатический график
- Адиабатическая энтропия, адиабатическое сжатие и расширение
- Обратимый адиабатический процесс
- Необратимый адиабатический процесс
- 💡 Видео
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На этом уроке мы будем работать с уже известными нам физическими понятиями, но в несколько иной области применения. А именно с изопроцессами в термодинамике. Мы рассмотрим, какие изменения в первый закон термодинамики (закон сохранения энергии в тепловых процессах) внесут протекания этих самых процессов при неизменном макроскопическом параметре газа. Также мы рассмотрим новый, ранее неизвестный процесс – адиабатный.
Видео:Адиабатный процесс. 10 класс.Скачать

Блог об энергетике
Видео:29. Адиабатический процесс. Уравнение ПуассонаСкачать

энергетика простыми словами
Видео:Урок 172. Применение 1 закона термодинамики для различных процессовСкачать

Основные термодинамические процессы
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
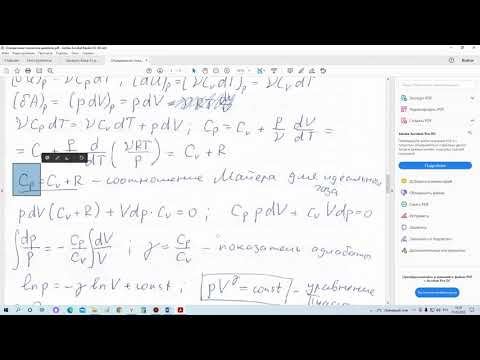
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Видео:Приемы решения термодинамических задач. Политропа и адиабата. Логарифмические координаты.Скачать

Адиабатический процесс | Все его важные концепции и графические кривые
Видео:Уравнение касательной в точке. Практическая часть. 1ч. 10 класс.Скачать

Тема обсуждения: адиабатический процесс.
- Определение адиабатического процесса
- Примеры адиабатических процессов
- Формула адиабатического процесса
- Вывод адиабатического процесса
- Выполненная работа адиабатического процесса
- Обратимый адиабатический процесс и Необратимыйадиабатический процесс
- Адиабатический график
Видео:Физика. Термодинамика: Адиабатный процесс. Центр онлайн-обучения «Фоксфорд»Скачать

Определение адиабатического процесса
Соблюдая первый закон термодинамики, процесс, происходящий при расширении или сжатии, когда нет теплообмена от системы к окружающей среде, может быть известен как адиабатический процесс. В отличие от изотермического процесса, адиабатический процесс передает энергию окружающей среде в виде работы. Это может быть как обратимый, так и необратимый процесс.
В действительности, идеально адиабатический процесс никогда не может быть получен, поскольку ни один физический процесс не может происходить самопроизвольно, а система не может быть идеально изолирована.
Следуя первому закону термодинамики, который гласит, что когда энергия (как работа, тепло или материя) переходит в систему или из нее, внутренняя энергия системы изменяется в соответствии с законом сохранения энергии, где E можно обозначить как внутренняя энергия, а Q — это тепло, добавленное к системе, а W — проделанная работа.
ΔE=Q—W
Для адиабатического процесса, в котором нет теплообмена,
ΔE= —W
Условия, необходимые для протекания адиабатического процесса:
- Система должна быть полностью изолирована от окружающей среды.
- Чтобы передача тепла происходила за достаточное время, процесс должен выполняться быстро.
Видео:мкт ИЗОТЕРМИЧЕСКИЙ процесс ИЗОХОРНЫЙ процесс ИЗОБАРНЫЙ процессСкачать

Адиабатический процесс Пример
- Процесс расширения в двигателе внутреннего сгорания среди горячих газов.
- Квантово-механический аналог осциллятора, классически известного как квантовый гармонический осциллятор.
- Сжиженные газы в системе охлаждения.
- Воздух, выпущенный из пневматической шины, является наиболее важным и частым случаем адиабатического процесса.
- Лед, хранящийся в морозильной камере, следует принципам, согласно которым тепло не передается в окружающую среду и обратно.
- Турбины, использующие тепло в качестве среды для создания работы, считаются отличным примером, поскольку они снижают эффективность системы, поскольку тепло теряется в окружающую среду.
Видео:Физика 10 класс. Адиабатный процесс.Скачать

Формула адиабатического процесса
Выражение адиабатического процесса в математических терминах может быть дано следующим образом:
ΔQ = 0
ΔU = -W, (так как в системе отсутствует тепловой поток)
Рассмотрим систему, в которой выполняется исключение теплового и рабочего взаимодействий в стационарном адиабатическом процессе. Единственные энергетические взаимодействия — это граничная работа системы в ее окружении.
Идеальный газ
Количество тепловой энергии на единицу температуры, недоступной для выполнения определенной работы, можно определить как энтропию системы. Спекулятивный газ, который представляет собой беспорядочное движение точечных частиц, подверженных межчастичным молекулярным взаимодействиям, идеален.
Молярная форма формулы идеального газа определяется следующим образом:
Уравнение адиабатического процесса можно обозначить как:
PVY = постоянный
Для обратимого адиабатического процесса
- P 1-Y T Y = постоянная,
- VT F / 2 = постоянная,
- TV Y-1 = константа. (T = абсолютная температура)
Этот процесс также известен как изэнтропический процесс, идеализированный термодинамический процесс, включающий передачу работы без трения и адиабатический. В этом обратимом процессе нет передачи тепла или работы.
Видео:9 класс. Геометрия. Декартовы координаты. Уравнение окружности. Уравнение прямой. Урок #6Скачать

Вывод адиабатического процесса
Изменение внутренней энергии dU в системе сделать работу dВт плюс добавленное тепло dQ с ним можно связать первый закон термодинамики, с помощью которого можно вывести адиабатический процесс.
Добавление тепла увеличивает количество энергии U определение удельной теплоемкости как количества тепла, добавляемого на единицу повышения температуры на 1 моль вещества.
(n — количество молей), Следовательно:
Получено из закон идеального газа,
Уравнение слияния 1 и 2,
Для постоянного давления Cp, добавляется тепло и,
γ — это удельная теплоемкость
Используя концепции интеграции и дифференциации, мы пришли к следующему:
Это уравнение, приведенное выше, становится реальным для данного идеального газа, который содержит адиабатический процесс.
Видео:Определение показателя адиабатыСкачать
Адиабатический процесс Работа выполнена.
Для давления P и площадь поперечного сечения A перемещение на небольшое расстояние dx, действующая сила будет определяться следующим образом:
А проделанную работу в системе можно записать так:
Чистая работа, произведенная для расширения газа из объема газа Vi к Vf (от начального до финального) будут представлены как
W = площадь ABDC от графика, построенного как имеет место адиабатический процесс. Условия, которые необходимо соблюдать, связаны с примером совершенно непроводящего поршневого цилиндра с одной граммовой молекулой идеального газа. Емкость баллона должна быть изготовлена из изоляционного материала, а кривая на графике должна быть более резкой.
Принимая во внимание, что в аналитическом методе для вывода работы, выполненной в системе, будет следующее:
Изначально для адиабатического изменения можно предположить:
Который может быть,
Из (1),
Принимая T1 и т2 как начальная и конечная температуры газа соответственно,
Используя это в уравнении (2),
Тепло, необходимое в процессе расширения для выполнения работы:
Поскольку R — универсальная газовая постоянная, и во время адиабатического расширения совершаемая работа прямо пропорциональна снижению температуры, в то время как работа, совершаемая во время адиабатического сжатия, отрицательна.
Это можно представить как работа, выполненная в адиабатическом процессе.
И тепло, выделяемое во время процесса:
Видео:Основы теплотехники. Термодинамические процессы. Изохорный, изобарный, изотермический, адиабатный.Скачать

Адиабатический график
Математическое представление кривой адиабатического расширения представлено следующим образом:
P, V, T — давление, объем и температура процесса. Рассматривая начальные условия системы как P1, V1, и т1, также определяя финальную стадию как P2, V2, и т2 соответственно, графическая диаграмма PV построена по существу для движения поршневого цилиндра, адиабатически нагретого от начального до конечного состояния для XNUMX кг воздуха.
Видео:Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Адиабатическая энтропия, адиабатическое сжатие и расширение
Газ, которому позволено свободно расширяться без передачи ему внешней энергии от более высокого давления к более низкому, будет по существу охлаждаться по закону адиабатического расширения и сжатия. Точно так же газ нагреется, если его сжать с более низкой температуры до более значительной температуры без передачи энергии веществу.
- Посылка воздуха расширится, если давление окружающего воздуха уменьшится.
- На больших высотах наблюдается снижение температуры из-за уменьшения давления, поскольку они прямо пропорциональны в случае этого процесса.
- Энергия может использоваться либо для работы по расширению, либо для поддержания температуры процесса, но не для того и другого одновременно.
Видео:Решение графических задач на тему Газовые законыСкачать

Обратимый адиабатический процесс
Процесс без трения, в котором энтропия системы остается постоянной, получил название обратимого или обратимого. изоэнтропический процесс. Это означает, что изменение энтропии постоянно. Внутренняя энергия эквивалентна работе, совершаемой в процессе расширения.
Поскольку нет теплопередачи,
Которое значит что,
Примеры обратимого изоэнтропического процесса можно найти в газовые турбины.
Видео:Лекция по физике №8. Распределение Больцмана. Теплоёмкость, Уравнение адиабатического процесса.Скачать

Необратимый адиабатический процесс
Как следует из названия, процесс рассеяния внутреннего трения, приводящий к изменению энтропии системы во время расширения газов, является необратимым адиабатическим процессом.
Обычно это означает, что энтропия увеличивается по мере развития процесса, который не может быть выполнен в равновесии и не может быть отслежен до исходного состояния.
💡 Видео
Изопроцессы, Адиабатный процесс.Скачать

Урок 163. Задачи на графики процессов в газахСкачать

Адиабатическое охлаждение.Скачать

ОЛИМПИАДНАЯ ФИЗИКА. Термодинамика - 1. Вебинар №20Скачать

Урок 157. Изопроцессы и их графики. Частные газовые законыСкачать
















