Среди 18 миллионов известных на сегодняшний день органических соединений немного найдется таких, которые повлияли бы на развитие органической химии сильнее, чем бензол. Полученный впервые в 1825 г., он более века был постоянной головной болью химиков. Сначала не могли понять, как выглядит молекула бензола. Потом десятилетиями пытались объяснить его уникальные свойства. Только за сто лет, прошедших после открытия этого соединения, опубликовано около 1 300 посвященных ему статей. Для объяснения его строения и свойств было выдвинуто множество теорий, большинство из которых не выдержали испытания временем и известны лишь историкам химии. Ожесточённые споры вокруг бензола оставили след в теории строения органических соединений, в немалой степени способствуя ее развитию. Бензол необходим не только теоретикам, но и практикам: из него делают красители, лекарственные препараты, взрывчатые вещества. И хотя непрофессионалам практически не приходится иметь дело с этим знаменитым соединением в чистом виде, его производные — аспирин, ванилин, эфедрин и многие другие — прочно вошли в нашу повседневную жизнь.
Открытие Майкла Фарадея
Открыть бензол, как это нередко бывает, помог случай. Начиная с 10-х гг. ХIХ в. в Лондоне для освещения улиц в фонарях стали использовать светильный газ. Его получали сухой перегонкой каменного угля и хранили под давлением в герметических ёмкостях. При этом в сосудах накапливалась неизвестная жидкость, особенно обильно — в холодную погоду. Фарадей начал изучать её и 18 мая 1825 г. выделил соединение, которое кипело при 80 о С. Учёный очистил его вымораживанием: при температуре 7 о С вещество превращалось в белую кристаллическую массу, тогда как все примеси оставались жидкими. К началу июня Фарадей провел элементный анализ нового соединения и определил, что оно содержит углерод и водород в соотношении 11,4:1. Полученные Фарадеем данные практически соответствуют установленным современными учёными характеристикам бензола: он кипит при 80,1 о С, затвердевает при 5,53 о С и имеет соотношение С:Н = 11,9:1. Пользуясь относительными атомными массами Дальтона (Н = 1, С = 6), Фарадей приписал полученному им соединению неверную формулу С2Н, назвав его «bicarburet of hydrogen», т. е. «двууглеродистым водородом». Однако вскоре шведский химик Якоб Берцелиус опубликовал уточненную таблицу атомных масс элементов (Н = 1, С = 12,26), в соответствии с которой открытый Фарадеем углеводород должен был иметь простейшую формулу СН. Истинную формулу этого соединения С6Н6 установили уже после того, как удалось определить его молекулярную массу.
Бензол получает имя
В названиях «бензол», «бензойная кислота», «бензальдегид» один и тот же корень «бенз». История его происхождения очень интересна. В Юго-Восточной Азии, на островах Ява и Суматра растёт дерево, которое выделяет красно-коричневую смолу. Её горение сопровождается приятным запахом. В Средние века арабские торговцы стали вывозить эту смолу для продажи в Европу. Сами купцы называли её яванским ладаном; по-арабски это звучало как «лубан джави» — ладан из Явы.
Европейцам первый слог «ЛУ» напоминал артикли «la» и «le» в итальянском и французском языках. Поэтому они стали называть это вещество «лу банджави», а потом, отбросив мнимый «артикль», «банджави». Позднее слово произносили и как «бенджами», и как «бенджоин», а примерно с середины XVII в. — как «бензоин».
В то время как группа атомов С6Н5СО была названа бензоилом, остатку С6Н5 досталось имя фенила (оба названия используются и сейчас). Слово «фенил» ведёт происхождение от ещё одной попытки «переименовать» либиховский бензол. В 1835 г. французский химик Огюст Лоран (1807—1853) предложил для углеводорода С6Н6 название «фен» (от греч. «фено» — «освещаю»). И хотя бензол действительно горит ярким пламенем, это название не прижилось. Однако оно «прилипло» ко многим органическим соединениям — фенолу, фенантрену, фенилаланину, а также ко множеству других соединений, содержащих группу С6Н5.
В 1832 г. Юстус Либих заинтересовался химическими свойствами «горькоминдального масла» (бензальдегида, С6Н5СНО). Это было сравнительно доступное органическое вещество, а в то время химики изучали только такие соединения, которые легко можно выделить из природных источников. При действии галогенов на миндальное масло Либих получил бензоилхлорид C6H5COCl и бензоилбромид C6H5COBr. Реакция любого из этих соединений с водой давала хорошо известную бензойную кислоту. Либих выделил и другие производные бензальдегида. И во всех превращениях сохранялась неизменной группировка атомов состава С7Н5О. Эту группировку — радикал бензойной кислоты Либих назвал бензоилом.

Вскоре немецкий химик Эйльхард Мичерлих (1794— 1863), нагревая бензойную кислоту с негашёной известью (СаО), получил жидкость со специфическим неприятным запахом, которая оказалась тождественной «двууглеродистому водороду» Фарадея. При нагревании бензойная кислота подверглась декарбоксилированию (от лат. приставки de-, означающей «отделение», «удаление», carbo [carbonis] — «уголь» и oxygenium «кислород»), т. е. произошло отщепление диоксида углерода: С6Н5СООН → С6Н6 + СО2, который в ходе реакции связывался известью. Мичерлих правильно определил формулу углеводорода — С6Н6 и окрестил его бензином (benzin). Либих счёл это название неудачным, так как суффикс «-ин» имелся в названиях многих азотсодержащих соединений — органических (среди них много алкалоидов, например стрихнин, кофеин, хинин) и неорганических (гидразин). Исходя из маслянистого характера жидкости, Либих предложил своё название, с суффиксом -ол (от лат. oleum — «масло»). Вряд ли оно было удачнее: этот суффикс обычно указывает на принадлежность соединения к спиртам. Однако слово «бензол» прижилось – правда, только в немецком и русском языках. Англичане и американцы, например, называют этот углеводород «бензин» (benzene).
Судя по формуле, бензол – сильно ненасыщенное соединение: по сравнению с насыщенным углеводородом гексаном С6Н14, ему «не хватает» восьми атомов водорода! Однако, несмотря на это, для бензола и родственных ему ароматических соединений реакции присоединения («насыщения» атомов углерода) нехарактерны. Так, он не обесцвечивает бромную воду, тогда как соединения С6Н6, со структурой СН2=СН — С≡С – СН=СН2 и подобные им реагируют с ней мгновенно. «Насытить» молекулу бензола атомами водорода или галогена удается с большим трудом. Например, реакция с хлором С6Н6 + 3Cl2 → C6H6Cl6 идет только при интенсивном ультрафиолетовом облучении смеси, а водород присоединяется под давлением и при нагревании в присутствии катализаторов, образуя циклогексан C6H12.
В то же время, в бензоле и других ароматических соединениях атомы водорода сравнительно легко замещаются на различные атомы и группы. Так, при нитровании атомы водорода замещаются на нитрогруппы NО2, при сульфировании — на группы SО3H, при галогенировании в присутствии катализаторов — на атомы галогенов, при алкилировании (также в присутствии катализаторов) — на алкильные группы (реакция Фриделя — Крафтса, например С6Н6 + C2H5Cl → С6Н5 – С2Н5 + НСl).
Основываясь на этих и других экспериментальных данных, многие исследователи в середине XIX в. высказывали самые разные предположения о структуре молекулы бензола. Наибольшего успеха достиг немецкий химик Фридрих Август Кекуле. Он пришёл к выводу, что любой атом углерода в органических соединениях обладает четырьмя «единицами сродства» (т. е. четырёхвалентен), а каждый атом водорода одной. В 1865 г. Кекуле представил Парижскому химическому обществу формулу бензола в виде циклической структуры. Кружками он обозначил атомы углерода, а черточками — валентные связи между ними.
В том же году Кекуле предложил молекулу бензола в виде шестиугольника, назвав его бензольным кольцом (или ядром). В итоге эмпирическая формула С6Н6 превратилась в графическую, а химическая наука обогатилась важнейшим открытием. С его помощью удалось выяснить строение большого класса органических соединений, а также возможности их химических превращений.
Открытие во сне
Сам Кекуле уверял, что структура бензольного кольца приснилась ему, когда он отдыхал в кресле перед камином. Ровно через 25 лет после этого открытия, когда немецкие химики отмечали «Праздник бензола», учёный так описывал рождение знаменитой формулы:
«…Моя лаборатория находилась в переулочке и даже днём в ней царил полумрак. для химика, который проводит целые дни в лаборатории, это не было помехой. Я занимался работой нал своим „Учебником», но что-то мне мешало, и мои мысли где-то витали. Я повернул кресло к камину и задремал. Атомы принялись танцевать перед моими глазами. На этот раз маленькие группы держались скромно на втором плане. Мой взор, обострённый от повторения одних и тех же образов, обратился скоро к более крупным фигурам различной формы. Длинные нити очень часто сближались и свёртывались в трубку, напоминая двух змей. Но что это? Одна из них вцепившись в собственный хвост, продолжая насмешливо кружиться перед моими глазами. Я внезапно пробудился и на этот раз провёл остаток ночи, чтобы изучить следствия из моей гипотезы».
Вроде бы всё просто. Однако это лишь кажущаяся простота. Кому ещё могут присниться атомы, кружащиеся в танце, как не человеку, длительное время упорно и мучительно размышляющему над связанной с ними проблемой. Открытию Кекуле предшествовала изнурительная научная работа; многие годы он спал по три-четыре часа в сутки. (Он вспоминал: «Одна ночь, проведённая без сна, была не в счёт. Только две или три ночи подряд без сна я считал своей заслугой».) Неудивительно, что именно во время краткого отдыха и произошло важное открытие.
Видео:Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

Получение бензола и его
Мы рассмотрим «классические» методы получения бензола — те, которые описаны в каждом учебнике по химии, и рассмотрим получение из разных классов органических соединений, т.к. цепочки реакций, которые предлагаются в ЕГЭ, подразумевают умение получать бензол «из всего» 🙂
«Классические» реакции
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

получения бензола
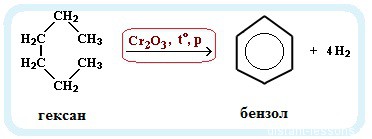
- Ароматизация нефти. Точнее, это реакция циклизации гексана. Называется метод «ароматизация нефти», т.к. из нее получают гексан:
С6H14 → C6H6 + 4H2
Обратите внимание на условия реакции — давление, температуру и катализатор. Они означают, что при обычных условиях гексан не вступит в такую реакцию. Алканы вообще довольно нереакционноспособные вещества.
С6H12 → C6H6 + 3H2
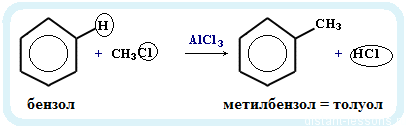
- Получение гомологов бензола: алкилирование бензола:
реакция проводится в присутствии катализатора — галогенидов алюминия, например, AlCl3:
C6H6 + CH3Cl → C6H5CH3 + HCl
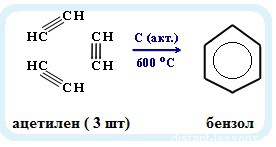
Именная реакция — реакция Зелинского. Получение бензола из ацетилена:
3С2H2 → C6H6
1. Получение бензола из неорганических веществ:
- 1 вариант:
Исходное вещество — карбид кальция СaC2:
CaC2 + 2H2O → Ca(OH)2 + C2H2 — ацетилен
дальше — реакция Зелинского : 3С2H2 → C6H6 Это самый короткий путь получения. - 2 вариант:
Исходное вещество — карбид алюминия Al4C3:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 — метан
2СH4 (1500 °C) → C2H2 + 3H2
дальше — реакция Зелинского
2. Получение бензола и его гомологов из других неорганических веществ:
1) получение бензола из алканов:
СH4 (1500 °C) → C2H2 (С, 600ºС) → С6H6
2) получение бензола и его гомологов из алкенов:
С2H4 → C2H2 →C6H6
Схема: алкен → дибромалкан → циклоалкан → гомолог бензола
CH2=CH-(CH2)4-CH3 + HBr → CH3-CH( Br )-(CH2)4-CH3
CH3-CH(Br)-(CH2)4-CH3 + Br2 → CH3-CH( Br )-(CH2)4-CH2 Br
CH3-CH( Br )-(CH2)4-CH2 Br + Zn → C6H13-СH3 — метилциклогексан + ZnBr2
C6H13-СH3 → С6H5-CH3 + 4H2
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Бензол получает имя
В названиях «бензол», «бензойная кислота», «бензальдегид» один и тот же корень «бенз». История его происхождения очень интересна. В Юго-Восточной Азии, на островах Ява и Суматра растёт дерево, которое выделяет красно-коричневую смолу. Её горение сопровождается приятным запахом. В Средние века арабские торговцы стали вывозить эту смолу для продажи в Европу. Сами купцы называли её яванским ладаном; по-арабски это звучало как «лубан джави» — ладан из Явы.
Европейцам первый слог «ЛУ» напоминал артикли «la» и «le» в итальянском и французском языках. Поэтому они стали называть это вещество «лу банджави», а потом, отбросив мнимый «артикль», «банджави». Позднее слово произносили и как «бенджами», и как «бенджоин», а примерно с середины XVII в. — как «бензоин». В то время как группа атомов С6Н5СО была названа бензоилом, остатку С6Н5 досталось имя фенила.
В 1935 году французский химик Огюст Лоран (1807 — 1853) предложил для углеводорода С 6 Н 6 название «фен» ( от греч. «фено» — «освещаю»). И хотя бензол действительно горит ярким пламенем, это название не прижилось. Однако оно «прилипло» ко многим органическим соединениям — фенолу, фенантрену, фенилаланину, а также к множеству других соединений, содержащих группу С 6 Н 5.
В 1832 г. Юстус фон Либих заинтересовался химическими свойствами «горькоминдального масла» (бензальдегида, С6Н5СНО). Это было сравнительно доступное органическое вещество, а в то время химики изучали только такие соединения, которые легко можно выделить из природных источников. При действии галогенов на миндальное масло Либих получил бензоилхлорид ( C 6 H 5 COC l ) и бензоилбромид ( C 6 H 5 COBr ). Реакция любого из этих соединений с водой давала хорошо известную бензойную кислоту. Либих выделил и другие производные бензальдегида. И во всех превращениях сохранялась неизменной группировка атомов состава С7Н5О. Эту группировку — радикал бензойной кислоты Либих назвал бензоилом.
Вскоре немецкий химик Эйльхард Мичерлих (1794— 1863), нагревая бензойную кислоту с негашёной известью (СаО), получил жидкость со специфическим неприятным запахом, которая оказалась тождественной «двууглеродистому водороду» Фарадея. При нагревании бензойная кислота подверглась декарбоксилированию (от лат. приставки de — , означающей «отделение», «удаление», carbo [ carbonis ] — «уголь» и oxygenium — « кислород» ), т. е. произошло отщепление диоксида углерод а : С6Н5СООН → С6Н6 + СО2, который в ходе реакции связывался известью. Мичерлих правильно определил формулу углеводорода — С6Н6 и окрестил его бензином ( benzin ). Либих счёл это название неудачным, так как суффикс «-ин» имелся в названиях многих азотсодержащих соединений — органических (среди них много алкалоидов, например стрихнин, кофеин, хинин) и неорганических (гидразин). Исходя из маслянистого характера жидкости, Либих предложил своё название, с суффиксом -ол (от лат. oleum — «масло»). Вряд ли оно было удачнее: этот суффикс обычно указывает на принадлежность соединения к спиртам. Однако слово «бензол» прижилось – правда, только в немецком и русском языках. Англичане и американцы, например, называют этот углеводород «бензин» ( benzene ).
Основываясь экспериментальных данных, многие исследователи в середине XIX в. высказывали самые разные предположения о структуре молекулы бензола. Наибольшего успеха достиг немецкий химик Фридрих Август Кекуле. Он пришёл к выводу, что любой атом углерода в органических соединениях обладает четырьмя «единицами сродства» (т. е. четырёхвалентен), а каждый атом водорода одной. В 1865 г. Кекуле представил Парижскому химическому обществу формулу бензола в виде циклической структуры. Кружками он обозначил атомы углерода, а черточками — валентные связи между ними.
В том же году Кекуле предложил молекулу бензола в виде шестиугольника, назвав его бензольным кольцом (или ядром). В итоге эмпирическая формула С6Н6 превратилась в графическую, а химическая наука обогатилась важнейшим открытием. С его помощью удалось выяснить строение большого класса органических соединений, а также возможности их химических превращений.
🌟 Видео
Механизм электрофильного ароматического замещенияСкачать
Бромирование БензолаСкачать

Замещение в бензольном кольце | Химия ЕГЭ | УмскулСкачать

Механизм реакции электрофильного замещенияСкачать

Реакции замещенияСкачать

Реакции присоединения и полимеризации в органике | Химия ЕГЭ | УмскулСкачать

Занятие 4. "Энергетический профиль химической реакции".Скачать
89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Реакция ионного обмена. Полное и сокращенное ионное уравнение. Практика. Видеоурок 39. Химия 9 классСкачать

Реакция сульфонированияСкачать
Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

бензол вычислительные задачи 1 частьСкачать

Обратимые и необратимые реакции | Химическое равновесие и условия его смещенияСкачать

Качественная реакция на соединения церияСкачать