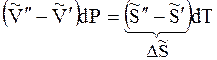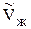Простейшим типом гетерогенного равновесия является равновесие чистого вещества со своим насыщенным паром, т.е. равновесие
Такое равновесие можно изобразить графически:
давление насыщенного пара — температура
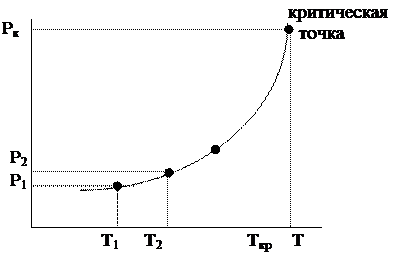 |
Рис. 6.20. Зависимость давления от температуры
Давление насыщенного пара – это равновесное давление, которое создается при Т = const некоторым количеством вещества в закрытом сосуде, не содержащем посторонних газов.
Давления насыщенного пара при разных температурах дают кривую испарения.
Давления насыщенного пара над твердым веществом при разных температурах дают кривую возгонки (сублимации).
Верхняя точка кривой испарения – критическая точка.
Верхняя граница кривой возгонки – точка плавления.
Направление кривых испарения и возгонки определяется уравнением Клаузиуса – Клапейрона. Получим его.
Когда две фазы чистого вещества находятся в равновесии, их изобарные потенциалы
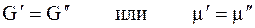
т.к. химический потенциал — это изобарный потенциал 1 моль вещества
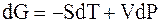
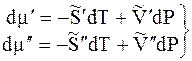
величины 
При равновесии 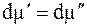
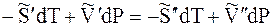
Отсюда 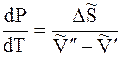
где DS – изменение энтропии при переходе 1 моль вещества из фазы 1 в фазу 2.
Из второго закона термодинамики известно, что для обратимых изотермических процессов
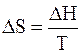
Подставим 6.244 в 6.243, получим уравнение Клапейрона –Клаузиуса (1850 г.)
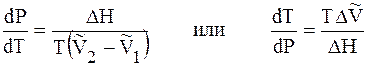
которое характеризует зависимость температуры фазового перехода от внешнего давления.
Уравнение Клапейрона – Клаузиуса описывает фазовые переходы I рода, к которым относятся переходы вещества из одного агрегатного состояния в другое, переходы из одной кристаллической модификации в другую. Среди них плавление, испарение, конденсация, возгонка,
DH – теплота фазового перехода 1 моль вещества.
При фазовых переходах скачком изменяются молярная энтропия 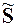
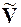
Рассмотрим некоторые конкретные случаи применения уравнения Клапейрона – Клаузиуса:
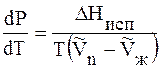
DH > 0, т.к. рассматривается переход жидкости в пар, энергия
T > 0 и 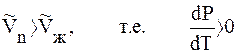
Это значит, что давление насыщенного пара растет с увеличением температуры.
Предположим, что пар подчиняется уравнению состояния идеального газа, т.е. 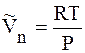
И если система далека от критической температуры, то 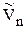
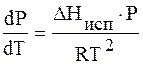
Разделим переменные и интегрируем, предполагая, что DHисп не зависит от Т.
или 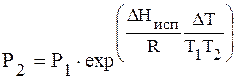
По этому уравнению можно рассчитать давление насыщенного пара Р2, зная Р1 и DHисп. Можно также рассчитать DHисп.
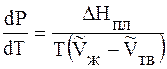
Разность DV мала, поэтому кривая плавления идет круто вверх.
Когда плотность твердого вещества больше плотности жидкого
DV > 0 и 
Когда плотность твердого вещества меньше плотности жидко-
У льда с повышением давления Тплав понижается, что объясняет скользкость льда (под давлением конька образуется вода, играющая роль смазки).
К = 1 S = 1 – ф + 2 ® S = 3 – ф
При равновесии в системе не может быть больше трех фаз, иначе число степеней свободы будет отрицательным числом, что не имеет физического смысла.
Т.е. в однокомпонентной системе одновременно могут существовать максимально три фазы: например, паровая, жидкая, твердая.
Диаграмму однокомпонентной системы (H2O) можно изобразить следующим образом.
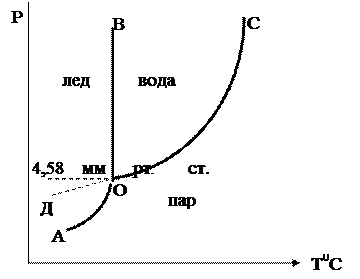 |
Рис. 6.21. Диаграмма состояния воды
В большинстве случаев за независимые переменные выбирают Р и Т.
Фазовой точкой называется точка на диаграмме, изображающая состояние одной фазы.
Совокупность фазовых точек, изображающих состояние одной фазы, называется фазовым полем
I – фазовое поле пара,
II – фазовое поле жидкости, III – твердая фаза.
Фазовые поля разделены фазовыми линиями:
ОС – соответствует равновесию двух фаз пар – жидкость,
ОА – пар – твердая фаза, ОВ – жидкость – твердая фаза.
В точке О в равновесии находятся все три фазы.
Число степеней свободы:
на фаз. поле S = 3 – 1 = 2 (два параметра можем менять),
на фаз. линии S = 3 – 2 = 1 ( один параметр можем менять),
в точке О S = 3 – 3 = 0 (параметры менять нельзя).
Если продлить ОС до Д, то ОД соответствует равновесию пар – переохлажденная жидкость.
Давление насыщенного пара над переохлажденной жидкостью больше, чем надо льдом, т.е. переохлажденная жидкость является неустойчивой (метастабильной) фазой относительно льда.
Диаграмма состояния с несколькими твердыми фазами. В однокомпонентной системе может быть только 1 паровая и 1 жидкая фаза, а твердых фаз может быть несколько. Например, сера в твердом состоянии существует в двух модификациях S(ромб) и S(монокл) с различной кристаллической решеткой, для Fe известны 4 модификации a-, b-, g- и d-, для воды известны более 5 твердых форм и т.д.
Каждая из этих модификаций выступает как отдельная самостоятельная фаза и на диаграмме ей соответствует отдельное фазовое поле.
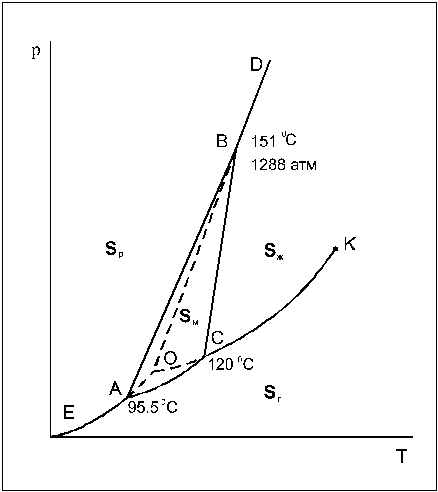
Рассмотрим диаграмму состояния серы.
Рис. 6.22. Диаграмма состояния серы
В данном случае 4 фазовых поля, 6 фазовых линий и три тройных точки А, В и С.


Равновесие всех четырех фаз не может быть осуществлено, т.к. число степеней свободы в этом случае S = 1 – 4 + 2 = –1, что противоречит действительности.
Энантиотропные и монотропные превращения.Многие вещества способны существовать в различных кристаллических модификациях, каждая из которых обладает определенными границами устойчивости. При этом существует некоторая температура перехода, выше которой устойчивой является одна из модификаций, а ниже – вторая.
Если превращение в точке перехода может самопроизвольно протекать как в прямом, так и в обратном направлениях, то такой переход называется энантиотропным (рис. 6.23). В этом случае между модификациями существует равновесие
Примером энантиотропного фазового перехода может служить процесс взаимного перехода серы ромбической и серы моноклинической. Энантиотропные превращения наблюдаются только в таких системах, в которых температура взаимного перехода (точка О) обеих полиморфных модификаций ниже температуры плавления этих модификаций (точки О3, О4 на рис. 6.23).
 |
Рис. 6.23. Диаграмма состояния однокомпонентной системы
с энантиотропными фазовыми превращениями
Кривая равновесия жидкость – пар СС / расположена выше точки О пересечения кривых АА / и ВВ / равновесия соответственно a- и b-полиморфных модификаций с паром. В интервале температур, соответствующих точкам А и О, более устойчива a-модификация, т.к. давление пара на участке АО ниже, чем на участке ВО. В интервале температур между точками О и О4 более устойчивой является b-модификация, которой соответствует кривая ВВ / . Между точками О4 и С / устойчивой является жидкая фаза (кривая СС / ). Участки кривых, расположенные выше кривой АОО4С / , соответствуют неустойчивым метастабильным равновесным состоянием (отрезки ВО, ОА / , СО4, О4В / ). При повышении температуры выше Т0 более устойчивой будет b-модификация и a-модификация переходит в b-модификацию. При понижении температуры ниже Т0 происходит обратный переход.
Если при любых условиях одна из модификаций более устойчива, чем вторая, то возможен переход только второй модификации в первую, но не обратно.

т.е. вторая модификация образуется из жидкости, но не из первой модификации.
Превращение модификаций, которые могут протекать только в одном направлении, называются монотропными.
В таких системах переход от модификации, устойчивой при более высоких температурах, к модификации, устойчивой при более низких температурах, невозможен. Обратный переход осуществляется и протекает тем быстрее, чем выше температура. Примерами монотропных фазовых переходов являются: превращения a-бензофенона в b-бензофенон, белого фосфора в красный, неустойчивых модификаций мышьяка и сурьмы в устойчивые модификации и др.
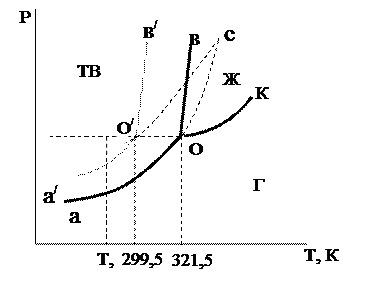 |
Рис. 6.24. Диаграмма состояния бензофенона
Рассмотрим диаграмму состояния бензофенона (С6Н5)2СО с монотропными превращения твердых фаз (рис. 6.24).
На этой диаграмме кривые аО, вО и КО изображают устойчивые двухфазные равновесия b — бензофенона. a — бензофенон является неустойчивой модификацией и может самопроизвольно превращаться в b-(C6Н5)2CО, тогда как обратный переход невозможен.
Линии аО и а¢О¢ отображают равновесия кристаллических b- и a-(C6Н5)2CО с паром, они должны пересечься в точке с, т.е. при температуре более высокой, чем температуры плавления этих модификаций (точки О и О¢). Так как перегреть кристаллическое вещество выше его температуры плавления невозможно, то линии сО и сО¢ продолжающие линии аО и аО¢, отражают физически нереальные состояния.
Рассмотренные закономерности фазовых равновесий и фазовых переходов имеют большое значение для химиков-технологов, т.к. позволяют установить оптимальный режим протекания химических и физико-химических процессов.
Видео:Физическая химия # 2. Вывод уравнения Клаузиуса-КлапейронаСкачать

Уравнением клаузиуса клапейрона для равновесия жидкость пар в однокомпонентной системе
Для однокомпонентной системы (К=1) правило фаз записывается в виде
Если Ф = 1, то С =2 , говорят, что система бивариантна;
Ф = 2, то С =1 , система моновариантна;
Ф = 3, то С =0 , система нонвариантна.
Соотношение между давлением (р), температурой (Т) и объемом (V) фазы можно представить трехмерной фазовой диаграммой. Каждая точка (ее называют фигуративной точкой) на такой диаграмме изображает некоторое равновесное состояние. Обычно удобнее работать с сечениями этой диаграммы плоскостью р — Т (при V=const) или плоскостью р -V (при T=const). Разберем более детально случай сечения плоскостью р — Т (при V=const).
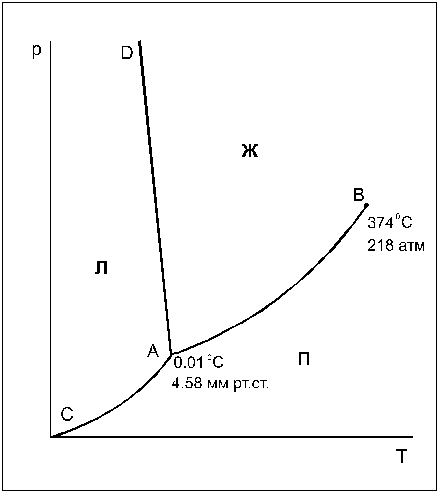
2.1. Фазовая диаграмма воды
Фазовая диаграмма воды в координатах р — Т представлена на рис.1. Она составлена из 3 фазовых полей — областей различных (р,Т)-значений, при которых вода существует в виде определенной фазы — льда, жидкой воды или пара ( обозначены на рис.1 буквами Л, Ж и П, соответственно). Эти фазовые поля разделены 3 граничными кривыми.
Кривая АВ — кривая испарения, выражает зависимость давления пара жидкой воды от температуры (или, наоборот, представляет зависимость температуры кипения воды от давления). Другими словами, эта линия отвечает двухфазному равновесию (жидкая вода) D (пар), и число степеней свободы, рассчитанное по правилу фаз, составляет С = 3 — 2 = 1. Такое равновесие называют моновариантным. Это означает, что для полного описания системы достаточно определить только одну переменную — либо температуру, либо давление, т.к. для данной температуры существует только одно равновесное давление и для данного давления — только одна равновесная температура.
При давлениях и температурах, соответствующих точкам ниже линии АВ, жидкость будет полностью испаряться, и эта область является областью пара. Для описания системы в данной однофазной области необходимы две независимые переменные (С = 3 — 1 = 2): температура и давление.
При давлениях и температурах, соответствующих точкам выше линии АВ, пар полностью сконденсирован в жидкость (С = 2). Верхний предел кривой испарения AB находится в точке В, которая называется критической точкой (для воды 374 o С и 218 атм). Выше этой температуры фазы жидкости и пара становятся неразличимыми (исчезает четкая межфазная граница жидкость/пар), поэтому Ф=1.
Линия АС — эта кривая возгонки льда (иногда ее называют линией сублимации), отражающая зависимость давления водяного пара надо льдом от температуры. Эта линия соответствует моновариантному равновесию (лед) D (пар) (С=1). Выше линии АС лежит область льда, ниже — область пара.
Линия АD -кривая плавления, выражает зависимость температуры плавления льда от давления и соответствует моновариантному равновесию (лед) D (жидкая вода). Для большинства веществ линия АD отклоняется от вертикали вправо, но поведение воды
Рис.1. Фазовая диаграмма воды
аномально: жидкая вода занимает меньший объем, чем лед. На основании принципа Ле Шателье можно предсказать, что повышение давления будет вызывать сдвиг равновесия в сторону образования жидкости, т.е. точка замерзания будет понижаться.
Исследования, проведенные Бриджменом для определения хода кривой плавления льда при высоких давлениях, показали, что существует семь различных кристаллических модификаций льда, каждая из которых, за исключением первой, плотнее воды. Таким образом, верхний предел линии AD — точка D, где в равновесии находятся лед I (обычный лед), лед III и жидкая вода. Эта точка находится при -22 0 С и 2450 атм (см.задачу 11).
Тройная точка воды (точка , отражающая равновесие трех фаз — жидкости, льда и пара) в отсутствие воздуха находится при 0,0100 o С и 4,58 мм рт.ст. Число степеней свободы С=3-3=0 и такое равновесие называют нонвариантным.
В присутствии воздуха три фазы находятся в равновесии при 1 атм и при 0 o С. Понижение тройной точки на воздухе вызвано следующим причинами:
1. растворимостью воздуха в жидкой воде при 1 атм, что приводит к снижению тройной точки на 0,0024 o С;
2. увеличением давления от 4,58 мм рт.ст. до 1 атм, которое снижает тройную точку еще на 0.0075 o С.
2.2. Фазовая диаграмма серы
Кристаллическая сера существует в виде двух модификаций – ромбической (Sр) и моноклинной (Sм). Поэтому возможно существование четырех фаз: ромбической, моноклинной, жидкой и газообразной (рис.2). Сплошные линии ограничивают четыре области: пара, жидкости и двух кристаллических модификаций. Сами линии отвечают моновариантным равновесиям двух соответствующих фаз. Заметьте, что линия равновесия моноклинная сера — расплав отклонена от вертикали вправо ( сравните с фазовой диаграммой воды ). Это означает, что при кристаллизации серы из расплава происходит уменьшение объема. В точках А, В и С в равновесии сосуществуют 3 фазы (точка А – ромбическая, моноклинная и пар, точка В – ромбическая, моноклинная и жидкость, точка С – моноклинная, жидкость и пар). Легко заметить, что есть еще одна точка О,
Рис.2. Фазовая диаграмма серы
в которой существует равновесие трех фаз – перегретой ромбической серы, переохлажденной жидкой серы и пара, пересыщенного относительно пара, равновесного с моноклинной серой. Эти три фазы образуют метастабильную систему, т.е. систему, находящуюся в состоянии относительной устойчивости. Кинетика превращения метастабильных фаз в термодинамически стабильную модификацию крайне медленна, однако при длительной выдержке или внесении кристаллов-затравок моноклинной серы все три фазы все же переходят в моноклинную серу, которая является термодинамически устойчивой в условиях, отвечающих точке О. Равновесия, которым соответствуют кривые ОА, ОВ и ОС (кривые – возгонки, плавления и испарения, соответственно) являются метастабильными.
В случае диаграммы серы мы сталкиваемся с самопроизвольным взаимным превращением двух кристаллических модификаций, которые могут протекать в прямом и обратном направлении в зависимости от условий. Такого типа превращения называются энантиотропными (обратимыми).
Взаимные превращения кристаллических фаз, которые могут протекать лишь в одном направлении, называются монотропными (необратимыми). Примером монотропного превращения является переход белого фосфора в фиолетовый.
2.3. Уравнение Клаузиуса — Клапейрона
Движение вдоль линий двухфазного равновесия на фазовой диаграмме ( С=1 ) означает согласованное изменение давления и температуры, т.е. р=f(Т). Общий вид такой функции для однокомпонентных систем был установлен Клапейроном.
Допустим, мы имеем моновариантное равновесие (вода) D (лед) (линия AD на рис.1 ). Условие равновесия будет выглядеть так : для любой точки с координатами (р,Т), принадлежащей линии AD, воды(р,Т) = льда(р,Т). Для однокомпонентной системы =G/n, где G — свободная энергия Гиббса, а n — число молей (=const). Нужно выразить G=f(p,T). Формула G= H-T S для этой цели не годится, т.к. выведена для р,Т=const. В общем виде, Gє H-TS=U+pV-TS. Найдем дифференциал dG, используя правила для дифференциала суммы и произведения: dG=dU+p . dV+V . dp-T . dS-S . dT. Согласно 1-му закону термодинамики dU=dQ — dA, причем dQ=T . dS,a dA= p . dV. Тогда dG=V . dp — S . dT. Очевидно, что в равновесии dGводы/n=dGльда/n (n=nводы=nльда=сonst). Тогда vводы . dp-sводы . dT=vльда . dp-sльда . dT, где vводы, vльда — мольные (т.е. деленные на количество молей) объемы воды и льда, sводы, sльда — мольные энтропии воды и льда. Преобразуем полученное выражение в (vводы — vльда) . dp = (sводы — sльда) . dT, (10)
или: dp/dT= sфп/ vфп , (11)
где sфп, vфп — изменения мольных энтропии и объема при фазовом переходе ((лед) (вода) в данном случае).
Поскольку sфп = H фп/Тфп, то чаще применяют следующий вид уравнения:
где Hфп — изменения энтальпии при фазовом переходе,
vфп — изменение мольного объема при переходе,
Тфп — температура при которой происходит переход.
Уравнение Клапейрона позволяет, в частности, ответить на следующий вопрос: какова зависимость температуры фазового перехода от давления? Давление может быть внешним или создаваться за счет испарения вещества.
Пример 6. Известно, что лед имеет больший мольный объем, чем жидкая вода. Тогда при замерзании воды vфп = vльда — vводы > 0, в то же время Hфп = Hкрист . vфп) 0 С. Основываясь на этой закономерности, английские физики Тиндаль и Рейнольдс около 100 лет назад предположили, что известная легкость скольжения по льду на коньках связана с плавлением льда под острием конька; образующаяся при этом жидкая вода действует как смазка. Проверим, так ли это, используя уравнение Клапейрона.
Плотность воды — в = 1 г/см 3 , плотность льда — л = 1.091 г/см 3 , молекулярная масса воды — М = 18 г/моль. Тогда:
vфп = М/ в-М/ л = 18/1.091-18/1= -1.501 см 3 /моль = -1.501 . 10 -6 м 3 /моль,
энтальпия плавления льда — Нфп = 6.009 кДж/моль,
По уравнению Клапейрона:
dp/dT= — (6.009 . 10 3 Дж/моль)/(273К . 1.501 . 10 -6 м 3 /моль)=
= — 146.6 . 10 5 Па/К= -146 атм/К.
Значит, для плавления льда при температуре, скажем, -10 0 С необходимо приложить давление 1460 атм. Но такой нагрузки лед не выдержит! Следовательно, изложенная выше идея не соответствует действительности. Реальная же причина плавления льда под коньком — теплота, выделяемая при трении.
Клаузиус упростил уравнение Клапейрона в случае испарения и возгонки, предположив, что:
- пар подчиняется закону идеального газа,
- мольный объем жидкости vж (или vтв) . Hисп)/(R . T 2 ), (12)
разделяя переменные получим:
dp/p=( Hисп/R) . (dT/T 2 ). (13)
Проинтегрируем левую часть в пределах от р1 до р2, а правую — от Т1 до Т2 (т.е. от одной точки (р1,Т1), лежащей на линии равновесия (жидкость) D (пар), до другой — (р2,Т2)):
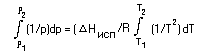
Результат интгерирования запишем в виде:
ln р2 — ln р1 = Hисп/R . (1/T1 — 1/T2) , (15)
называемым иногда уравнением Клаузиуса-Клапейрона. Оно может быть использовано для расчета теплоты испарения или возгонки, если известны значения давлений пара при двух различных температурах.
2.4. Энтропия испарения
Мольная энтропия испарения Sисп = Hисп/Ткип равна разности Sпара — Sжидк. Поскольку Sпара >> Sжидк, то можно полагать Sисп Sпара. Следующее допущение состоит в том, что пар считают идеальным газом. Отсюда вытекает приблизительное постоянство мольной энтропии испарения жидкости при температуре кипения, называемое правилом Трутона.
Правило Трутона. Мольная энтропия испарения любой
жидкости составляет величину порядка 88 Дж/(моль . К).
Если при испарении разных жидкостей не происходит ассоциации или диссоциации молекул, то энтропия испарения будет приблизительно одинакова. Для соединений, образующих водородные связи (вода, спирты), энтропия испарения больше 88 Дж/(моль . К).
Правило Трутона позволяет определить энтальпию испарения жидкости по известной температуре кипения, а затем по уравнению Клаузиуса-Клапейрона определить положение линии моновариантного равновесия жидкость-пар на фазовой диаграмме.
Задача 2. Оцените давление пара над диэтиловым эфиром при 25 0 С, зная его температуру кипения ( 35.6 0 С ).
Решение: Согласно правилу Трутона Sисп = 88 Дж/(моль . К), с другой стороны Sисп= Hисп/Tкип; отсюда Нисп=88 . (35.6+273)=27.16 кДж/моль ( по справочнику Нисп=26.6 кДж/моль ).
Применим уравнение Клаузиуса-Клапейрона, учитывая, что при кипении (Т=308.6К) давление паров эфира р=1 атм. Тогда имеем ln p — ln 1 = 27.16 . 10 3 /8.31(1/308.6-1/T), или ln p = -3268/T + 10.59 ( и это является уравнением линии моновариантного равновесия (жидкость) (пар) на фазовой диаграмме эфира). Отсюда, при Т=298К (25 0 С) р=0.25 атм.
Энтропия плавления не так постоянна для разных веществ, как энтропия испарения. Это связано с тем, что беспорядок ( мерой которого является энтропия ) возрастает при переходе от твердого к жидкому состоянию не столь сильно, как при переходе в газообразное состояние.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:Коробов М. В. - Физическая химия. Часть 1 - Фазовое равновесиеСкачать

КЛАПЕЙРО́НА – КЛА́УЗИУСА УРАВНЕ́НИЕ
В книжной версии
Том 14. Москва, 2009, стр. 215
Скопировать библиографическую ссылку:
КЛАПЕЙРО́ НА – КЛ А́УЗИУСА УРАВНЕ́ НИЕ, уравнение, характеризующее фазовые переходы 1-го рода (плавление, испарение, сублимацию, полиморфные превращения); устанавливает связь между равновесными значениями абсолютной темп-ры $T$ и давления $p $ при фазовых переходах 1-го рода однокомпонентной системы с теплотой фазового перехода и изменением фазового объёма. К. – К. у. имеет вид: $$frac
🔥 Видео
Фазовые диаграммы. Тройная точка. Критическое состояние вещества. 10 класс.Скачать

Фазовые равновесия | ФизхимияСкачать
Коробов М. В. - Физическая химия. Часть 1 - Основные понятия, свойства системыСкачать
Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

09 Фаз диагр двухкомп сист 1 принципы и мех смесьСкачать
Уравнения состояния. Фазовое равновесиеСкачать

Успеть за 300 секунд, #3: Уравнение Клапейрона-МенделееваСкачать

Румянцева М.Н.- Общая и неорганическая химия. Лекции - 4.Фазовые равновесияСкачать

Коробов М. В. - Физическая химия. Часть 1 - Фазовое равновесие. Уравнения Гиббса-Дюгема-МаргулесаСкачать

Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Коробов М. В. - Физическая химия. Часть 1 - Фазовые диаграммы. Фазовые переходыСкачать

Успенская И. А. - Химическая термодинамика и кинетика - Фазовые диаграммыСкачать

Лекция 8Скачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Фазовые диаграммыСкачать

Урок 2.Уравнение Менделеева-Клапейрона. Решение задач. База. ЕГЭСкачать

Коробов М. В. - Физическая химия. Часть 1 - Фазовая диаграмма воды. Закон Рауля. Закон ГенриСкачать

Уравнение Менделеева - Клапейрона за 10 минут | Физика с Никитой АрхиповымСкачать