По этой ссылке вы найдёте полный курс лекций по математике:
В практике тепловых расчетов широкое применение получила следующая приближенная зависимость истинной удельной теплоемкости от температуры: где а — экспериментальное значение истинной теплоемкости при температуре О °С; b> d> е — постоянные коэффициенты, зависящие от природы рабочего тела, определяемые на основании экспериментальных данных.
Для менее точных расчетов зависимости истинной удельной теплоемкости от температуры применяется уравнение второй степени: Для двухатомных газов часто ограничиваются первыми двумя членами уравнения (3.13): В табл. 3.1 приведены температурные зависимости истинных мольных теплоемкостей при постоянном давлении для некоторых газов. Зная зависимость с = /(f), можно аналитически определить теплоту или удельную теплоту, исходя из определений «»Я?. Q = JCdt, g-Jcdt. Таблица 3.1 Газ „ х кДж
Мольная теплоемкость С„, ——=т Р кмоль•К Азот 28,97 + 0,002566* Водород 28,78 + 0,001117* Кислород 29,56 + 0,003404* Окись углерода 29,06 + 0,002818* Воздух 29,09 + 0,002412* Водяной пар 32,85 + 0,00544* Углекислота 36,05 + 0,0203* — 0,00000642*2 Однако в практических расчетах используется более простой способ, при котором удельная теплота определяется через среднюю удельную теплоемкость процесса ст: В справочной литературе в основном приводятся коэффициенты для истинной удельной или мольной теплоемкости.
Зная их, можно самостоятельно получить выражение для средних теплоемкостей.
Зависимость истинной удельной теплоемкости от абсолютной температуры с = f(T) можно получить на примере формулы (3.15). Так как t = Т — 273,15, то с = а + b • (Т — 273,15). Обозначив через а’ — а — Ь* 273,15, получим с = а’ + ЬТ. Тогда в процессе нагрева от Тх до Т2 количество сообщенной ТРТ удельной теплоты может быть подсчитано по уравнению д=[а’+|(Г2 + Т1)](Т2-Т1), а средняя удельная теплоемкость запишется в виде Ряд экспериментальных исследований показал, что с понижением температуры теплоемкость водорода быстро уменьшается и уже при Т = 60 К его мольная теплоемкость становится равной теплоемкости идеального одноатомного газа.
| Явление падения теплоемкости с понижением |
температуры находится в полном соответствии с положениями молекулярно-кинети-ческой теории теплоемкости. При низких абсолютных температурах прекращаются и вращательные движения молекул, и колебательные движения атомов внутри молекул, а остаются лишь три степени свободы поступательного движения, свойственные молекуле идеального одноатомного газа.
Результатом этого и является приближение теплоемкости всех газов при низких температурах к значению теплоемкости идеального одноатомного газа. В 1906 г. Нернст высказал предположение о том, что при последующем понижении температуры и приближении ее к абсолютному нулю должно прекратиться и поступательное движение молекул и тогда любой газ приобретает свойства твердых тел. Проводя опыты над рядом твердых тел вблизи абсолютного нуля, Нернст показал, что теплоемкости твердых тел стремятся к нулю при Т 0 К, а для всех твердых тел при температуре Т — 0 К теплоемкости равны нулю.
Возможно вам будут полезны данные страницы:
Иными словами, при Т = 0 К частицы вещества (молекулы) превращаются в жесткую систему, лишенную тепловых движений. Из этого следует, что эмпирическая зависимость теплоемкости от температуры в виде уравнения (3.18) является справедливой только в области высоких температур и совершенно недействительна в области низких абсолютных температур. Истинный характер изменения теплоемкости от температуры показан на рис. 3.2.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Влияние температуры на скорость химических реакций. 10 класс.Скачать

Уравнение зависимости теплоемкости от температуры для органических веществ

webkonspect.com — сайт, с элементами социальной сети, создан в помощь студентам в их непростой учебной жизни.
Здесь вы сможете создать свой конспект который поможет вам в учёбе.
Чем может быть полезен webkonspect.com:
- простота создания и редактирования конспекта (200 вопросов в 3 клика).
- просмотр конспекта без выхода в интернет.
- удобный текстовый редактор позволит Вам форматировать текст, рисовать таблицы, вставлять математические формулы и фотографии.
- конструирование одного конспекта совместно с другом, одногрупником.
- webkonspect.com — надёжное место для хранения небольших файлов.
Видео:Количество теплоты, удельная теплоемкость вещества. 8 класс.Скачать

Интерполяционные уравнения, описывающие температурную зависимость теплоемкости
Модуль 2 Лекция 5
Понятие о теплоёмкости. Теории теплоёмкости газа и конденсированных тел. Методы её оценки на основе экспериментальных данных. Зависимость теплоёмкости от температуры. Зависимость теплового эффекта от температуры и давления. Формула Кирхгофа. Квантовая теория теплоемкости Эйнштейна и Дебая. Понятие о характеристической температуре и методы её оценки на основе экспериментальных данных. Экспериментальные методы исследования теплоёмкости.
Зависимость теплового эффекта реакции от температуры.
Закон Кирхгоффа
В общем случае тепловой эффект химической реакции зависит от температуры и давления, при которых проводится реакция. Влиянием давления на ΔН и ΔU реакции обычно пренебрегают. Влияние температуры на величины тепловых эффектов описывает закон Кирхгоффа:
· Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции, т.е. равен разности сумм теплоемкостей продуктов реакции и сумм теплоемкостей исходных веществ..
Продифференцируем ΔН и ΔU по температуре при постоянных давлении и температуре соответственно:
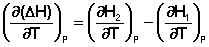
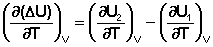
Производные энтальпии и внутренней энергии системы по температуре есть теплоемкости системы в изобарных и изохорных условиях Cp и Cv соответственно:
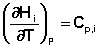
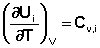
Подставив выражения (5.3, 5.4) в (5.1, 5.2), получаем математическую запись закона Кирхгоффа:
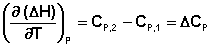
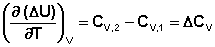
Для химического процесса изменение теплоемкости задается изменением состава системы и рассчитывается следующим образом:


Если проинтегрировать выражения (5.5, 5.6) от Т = Т1 до Т = Т2, считая ΔСp (ΔСv) не зависящим от температуры, получим интегральную форму закона Кирхгоффа:
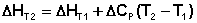
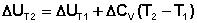
Поскольку обычно известны табличные значения стандартных тепловых эффектов ΔН°298 и ΔU°298, преобразуем выражения (5.9, 5.10):
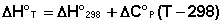
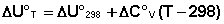
При расчете изменения теплового эффекта реакции в большом интервале температур необходимо учитывать зависимость теплоёмкости от температуры, которая выражается степенным рядом
C°p = a + bT + c׳ T -2 (для неорганических соединений);
C°p = a + bT + cT 2 (для органических соединений);
коэффициенты a, b, c приведены в справочниках. Следует отметить, что если ΔCp > 0, то с увеличением температуры растет также и тепловой эффект, а если ΔCp
При расчете теплоемкости следует учитывать, что молекулы одноатомного газа имеют три степени свободы движения атомов в трехмерном пространстве, а двухатомного газа – пять степеней свободы: 3 степени поступательного движения и 2 – вращательного.
Это остается верным для любых линейных многоатомных молекул. Для нелинейных молекул трехатомного газа, а также для молекул более сложного строения, т.е. многоатомных, появляется еще одна степень свободы вращательного движения. Следует отметить, что на каждую степень свободы молекулы при поступательном и вращательном движениях приходится в пересчете на 1 моль газа энергия, равная ½ RT. Отсюда, принимая во внимание известное соотношение (5.15), можем найти теплоемкость при постоянном давлении Cp: для одноатомного газа она равна 5/2R или 20,8 Дж/моль К, а суммы поступательного и вращательного вкладов двухатомных и многоатомных линейных молекул в пересчете на моль идеального газа соответственно равны:
Cp = Cv + R = 5/2R + R = 29,1 Дж/моль К. (5.18)
Cp = Cv + R = 3R + R = 33,26 Дж/моль К. (5.19)
Однако, экспериментальные значения теплоемкости двухатомных и многоатомных газов отличаются от расчетных значений (5.18) и (5.19), т.к. имеют еще дополнительную колебательную составляющую; полное значение изобарной теплоемкости идеальных газов указанного типа выражается соотношением:
Природа колебательного вклада в теплоемкость в отличие от поступательного и вращательного значительно сложнее. (см. стр. 18 Пашинкин)
Правило Дюлонга-Пти Согласно этомк правилу атомная теплоемкость простых веществ в твердом состоянии (произведение атомной массы на его удельную теплоемкость) приблизительно одинакова для большинства элементов при комнатной температуре и равна (25,9 – 26,8) Дж/моль К. Однако, правило Дюлонга-Пти строго выполняется для каждого простого вещества лишь при температуре Дебая. Cp ≈ Cv ≈ 26,3 Дж/моль К.
Правило Неймана и Коппа По этому правилу мольная теплоемкость соединений в твердом состоянии приблизительно равна сумме атомных теплоемкостей элементов, входящих в состав данного соединения, если последние не слишком отличаются по своей химической природе.
Интерполяционные уравнения, описывающие температурную зависимость теплоемкости
Экспериментальные значения теплоемкостей индивидуальных веществ при температурах выше 200 К удобно выражать следующими эмпирическими формулами:
Ср = a + bT + cT 2 (5.22)
Ср = a + bT + cT -2 (5.23)
Коэффициенты, входящие в указанные уравнения, различны по значениям. При T = О коэффициент «а» не имеет смысла теплоемкости, а является лишь экстраполяционной постоянной. Уравнение (5.23) лучше передает зависимость Ср от Т при высоких температурах в связи с тем, что вклад третьего члена в общую сумму уменьшается. При этом зависимость Ср от Т становится почти линейной, а при сравнительно низких температурах (сТ -2 ) возрастает, и данная зависимость становится криволинейной, что согласуется с опытными данными. Поэтому небольшая экстраполяция в области высоких и низких температур не связана с большой погрешностью. А небольшая экстраполяция в случае уравнения (5.22 ) может привести к значительным отклонениям, так как при высоких температурах вклад члена сТ 2 в общую теплоемкость большая, что приводит к преувеличенным результатам, или (если С .
🌟 Видео
Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Физика 10 класс (Урок№19 - Температура. Энергия теплового движения молекул.)Скачать

8 класс урок №6 Количество теплоты Удельная теплоемкость вещества Практическая работа №1Скачать
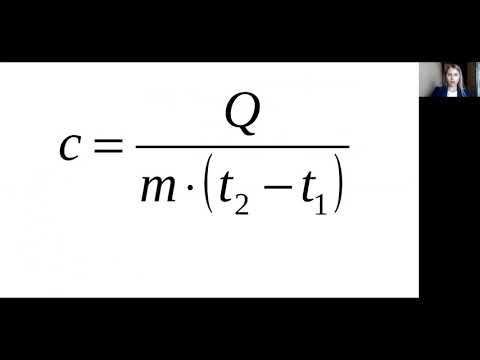
Решение задач на зависимость энтальпии от температурыСкачать

Количество теплоты, удельная теплоемкость вещества. Практическая часть - решение задачи. 8 класс.Скачать

Физика 8 кл(2019г)Пер §15 Упр 12 № 1 . На рисунке 19 приведены графики зависимости температуры от врСкачать

Урок 109 (осн). Задачи на вычисление количества теплотыСкачать

Температура и тепловое равновесие. Определение температуры | Физика 10 класс #30 | ИнфоурокСкачать

Урок 148. Тепловое равновесие. Температура.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Урок 8. Решение задач на расчет теплового эффекта с зависимостью от температурыСкачать

Урок 108 (осн). Теплоемкость тела. Удельная теплоемкость веществаСкачать

Зависимость электрического сопротивления металлов от температуры. Сверхпроводимость. 8 класс.Скачать

Задача на Тепловой обмен. физика 8 классСкачать

Урок 112 (осн). Уравнение теплового балансаСкачать

Фх лекция 2 Зависимость теплоемкости от температурыСкачать

Урок 172. Применение 1 закона термодинамики для различных процессовСкачать





