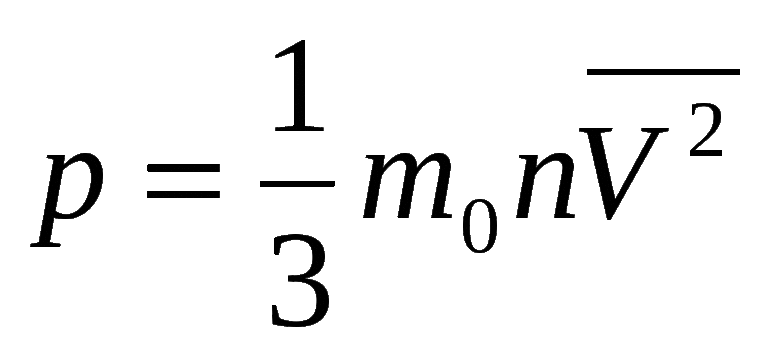Калькулятор определяет парциальное давления водяного пара в зависимости от температуры.
- Определение парциального давления водяного пара.
- Примечание.
- Парциальное давление газов — определение, формулы и законы
- Трактовка закона
- Второстепенные значения
- Уравнения Дальтона и Бойля
- Свойства веществ
- Точки и функции
- Теория парообразования и увлажнения воздуха
- 1. Понятие воздуха с точки зрения термодинамики.
- 2. Влагосодержание, или абсолютная влажность.
- 3. Парциальное давление.
- 4. Относительная влажность.
- 5. Удельная теплоемкость и энтальпия воздуха.
- 6. Удельная теплоемкость и энтальпия воды.
- 7. Процесс парообразования.
- 8. Процесс парообразования. Испарение воды.
- 9. Процесс парообразования. Кипение воды.
- 10. Скрытая теплота парообразования.
- 11. Насыщенный пар.
- 12. Адиабатическое испарение воды.
- 13. Методы процесса увлажнения воздуха.
- 14. Изотермическое увлажнение воздуха.
- 15. Адиабатическое увлажнение воздуха.
- 16. Принципиальные различия изотермического и адиабатического увлажнения воздуха
- 17. Увлажнители испарительного типа
- 18. Увлажнители распылительного типа: воздушно-водяные
- 19. Увлажнители распылительного типа: водяные
- 20. Сравнение системы испарительного типа и высоконапорной системы увлажнения воздуха
- 21. Пример расчета производительности системы увлажнения воздуха.
- 22. Адиабатическое охлаждение воздуха с помощью системы увлажнения.
- 📸 Видео
Видео:Насыщенный пар. Зависимость давления пара от температуры | Физика 10 класс #35 | ИнфоурокСкачать

Определение парциального давления водяного пара.
Формула расчета парциального давления насыщенного водяного пара:
Видео:Введение в парциальное давление | Газы.Молекулярно-кинетическая теория | ХимияСкачать

Примечание.
Расчет выполнен на основании п.8.6. СП 50.13330.2012 «Тепловая защита зданий». Парциальное давление насыщенного водяного пара по данной формуле определяется в пределах температур от минус 40 °С до плюс 45 °С.
Для внутреннего воздух помещения парциальное давления рассчитывается с учетом относительной влажности:
Для наружного воздух парциальное давление определяется согласно таблицы 7 СП 131.13330.2018 «Строительная климатология. Актуализированная редакция СНиП 23-01-99*»:
В комментарии приветствуются пожелания, замечания и рекомендации по улучшению программы.
Видео:Урок 188. Температурная зависимость давления пара. Точка росыСкачать

Парциальное давление газов — определение, формулы и законы
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Трактовка закона
Учёный Дальтон в 1801 году сформировал закон парциальных давлений: Па смеси из идеальных газов равняется сумме рi её компонентов. Уравнение имеет следующий вид: Рсм=n (сумма pi), где n — число долей смеси.
Для определения парциального давления в химии используется отдельный компонент из атмосферного воздуха. При расчете учитывается значение каждого отдельного вещества, их число, температуры с объёмами. При необходимости можно найти общий показатель, сложив давление каждого компонента в отдельности.
Каждый газ в сосуде должен обозначаться как «идеальный». При нормальных условиях они взаимодействуют с углекислым газом, водородом, водой, азотом, водяным паром, кислородом, компонентами крови и прочими компонентами из таблицы Менделеева. При этом не образуются соединения. Отдельные молекулы способны сталкиваться между собой, отталкиваясь, но не деформируясь.
Физические и химические задачи решаются с помощью формулы парциального давления (закон открыли учёные Бойль и Мариотт): (k = P x V). Кроме полного варианта, уравнение записывается сокращённо k = PV, где:
- k равно постоянной величине;
- Р — давление;
- V — объем.
Видео:Урок 124 (осн). Зависимость температуры кипения жидкости от давленияСкачать

Второстепенные значения
Давление может измеряться в разных величинах: процент, паскаль (Па). Смысл последнего: сила в 1 ньютон приложена к площади в 1 кв. м. Если результат такой зависимости записывается в атмосферах, тогда для его нахождения потребуется учесть, что одна атмосфера равняется 101,325 Па.
Температура идеального газа повышается, если увеличивается объём, а снижается, если уменьшается последний показатель. Такое соотношение может называться законом Чарльза, который имеет следующий математический вид: k = V / T. Значение температуры в уравнении измеряется в градусах Кельвина. Оно зависит от градусов Цельсия. Чтобы его найти, прибавляется 273.
Уравнение используется в химии для определения мольной доли (концентрация, которая выражается через отношение количества молей 1 компонента к суммарному числу молей пары веществ, входящих в смесь). Кроме объёма, для газа характерна молярная масса (вес одной доли компонента) и объём. Существуют легкие способы её подсчёта:
- Стандартная. Измеряется в граммах и килограммах.
- Молекулярная. Так как газы весят мало, их вес вычисляется в специальной единице измерения — молярная масса. Для её определения суммируется вес составных атомов. Каждый компонент сравнивается с массой карбона, равной 12.
Видео:Физика. 8 класс. Зависимость температуры кипения от внешнего давления /03.11.2020/Скачать

Уравнения Дальтона и Бойля
Физик и химик Дальтон считается первым учёным, предположившим структуру атомных элементов, их свойства. Общее давление вычисляется следующим образом: Р= P1 + P2 + P3. Пример: в колбе содержится по 10 г оксигена и нитрогена. Их общее Р будет равно 20 (10+10). Для вычисления pi используется температура, равная 37 градусам Цельсия.
Чтобы перевести её в градусы Кельвина, значение по Цельсию, равное 37, добавляется к 273. Результат — 310. Для вычисления количества молей газов используется масса, поделённая на молярную. Если уравнение касается нитрогена, вес каждого компонента соответствует цифре 14.
Так как вещество содержит в себе 2 атома, то 14х2, что равно 28. Масса в граммах делится на полученный результат. Таким способом вычисляется количество молей, приблизительно равное 0,4 моль. Чтобы найти аналогичное значение у оксигена, применяется масса 16. Вещество относится к двухатомным газам, поэтому 16х2 равняется 32. По результатам получается, что 0,3 моль оксигена содержится в составе газовой смеси.
Если в задаче указывается общее давление и pi в атмосферах, тогда используется в качестве константы R (0.0821 л атм/K моль). При подстановке данных в уравнение можно узнать Pобщее. Чтобы вычислить ПД нитрогена, 0,4 моль умножается на константу и температуру. Результат делится на 2 литра, что приблизительно равно 5.09 атм. Аналогичные шаги выполняются для вычисления ПД оксигена. Конечный результат равен 3.82 атм.
Свойства веществ
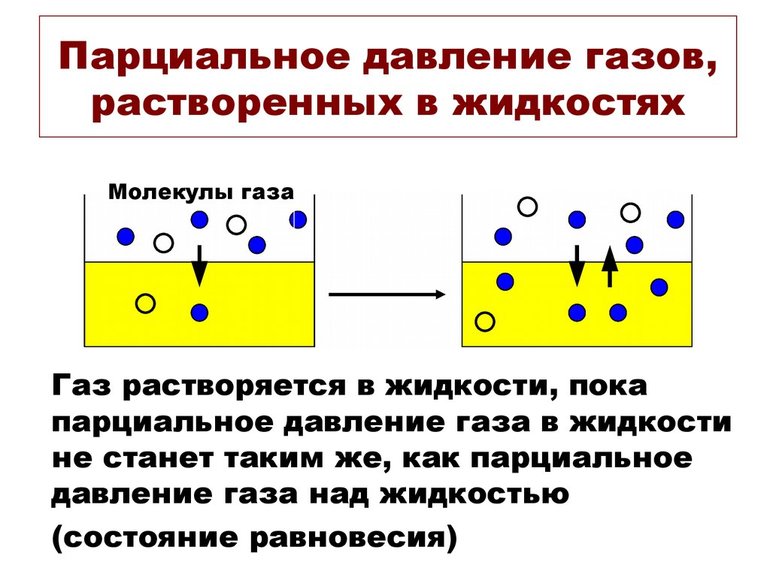
Значение pi газа, растворённого в жидкости, равняется pi того вещества, который образовался бы в фазе газообразования в случае равновесия с жидкостью при аналогичной температуре. Парциальное давление (ПД) измеряется в качестве термодинамической активности молекул вещества.
Газы постоянно вытекают из сферы с высоким ПД в область с низким давлением. Чем больше такая разница, тем быстрее поток. Газам свойственно растворяться, диффундировать, реагировать на ПД. В некоторых случаях показатель не зависит от концентрации газовой смеси.
При решении задач в области химии и физики учитываются свойства газов: сжимаемость и способность расширяться. Они не имеют своей формы, поэтому расширяются до заполнения сосуда, принимая его форму. По аналогичной причине они не имеют объёма. Газ давит на стенки ёмкости по всем направлениям одинаково. Характерное свойство компонентов — способность смешиваться между собой в разных соотношениях.
Так как объём зависит от температуры и давления, поэтому в норме должно быть 0 °C и 760 мм рт. ст. При этом нет места влаги. Если объём считается нормальным, его обозначают стоящей впереди буквой. Подобная зависимость отображается в термодинамике с помощью графика. Если доказана зависимость объема от давления, при этом температура постоянная, используются изотермы (линии, которые изображают на диаграмме процесс с неизменной температурой).
Точки и функции
В законе Бойля чётко указана зависимость объёма от давления при одинаковой температуре. Если данные нанести на график в функцию давления, через точки можно будет провести кривую. Точный эксперимент и незначительный разброс точек позволяют описать объёмное поведение системы с небольшой погрешностью.
Несколько подобных кривых для разных температур во всём диапазоне изученных условий позволяет описать объёмное поведение газа. Одновременно отображаются кривые постоянного давления, которые описывают изменения основных показателей. Чтобы получить окончательные результаты, кривые требуют незначительного сглаживания. Подобные графики сделать самостоятельно менее сложно.
Объём газа при неизменной температуре сильно изменяется с колебаниями давления. Но графически представить такую зависимость в широком диапазоне изменения давлений трудно. Если охвачена широкая область изменения, используются крупные масштабы.
Для упрощения процесса построения на график наносится зависимость произведения Р от давления при одной температуре, что существенно уменьшает область выявления функции. Наибольший эффект получается от применения 1−2 специальных функций объёма, которые называются коэффициентом сжимаемости и остаточным объёмом.
Каждое понятие характеризуется объёмным поведением газа с учётом его отклонений от нормального состояния вещества и созданных идеальных условий. Чтобы упростить поставленную задачу, график отображается на специальной бумаге либо при помощи компьютерных программ. Во втором случае достаточно ввести данные. Сервис самостоятельно строит прямые, кривые и прочие элементы графика.
Простые зависимости лучше отображать в стандартных программах Word. Графические сложные задачи в химии и физике решаются с помощью «Agrafer» — известная компьютерная программа, которая используется не только студентами, но и школьниками.
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Теория парообразования и увлажнения воздуха
1. Понятие воздуха с точки зрения термодинамики.
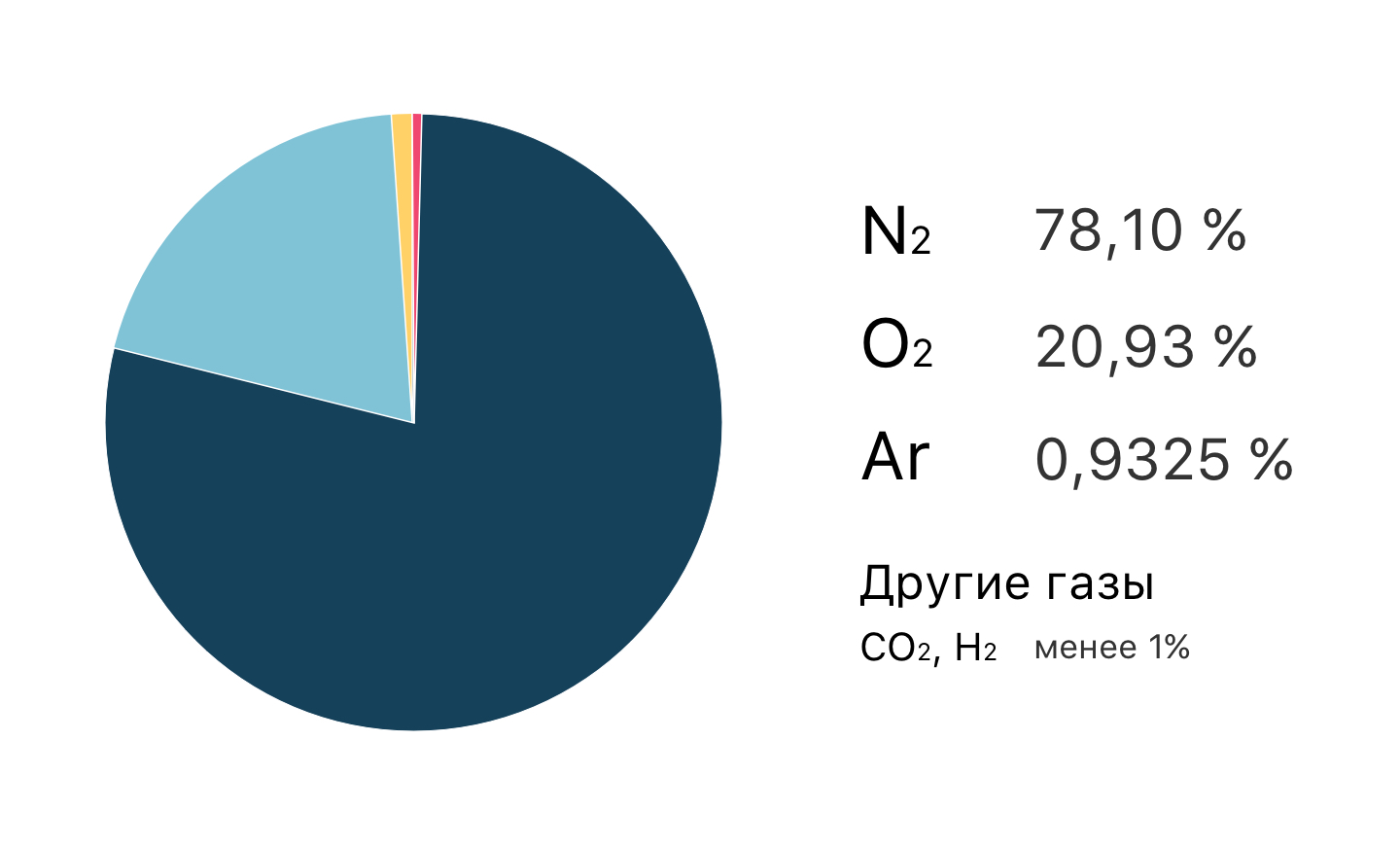
Воздух, которым мы дышим, представляет собой смесь газообразных элементов и соединений и водяной пар, доля которого зависит от температуры воздуха и соответствующей влажности.
Понятие «влажный воздух» с точки зрения термодинамики определяют, как двухкомпонентную смесь.
Компонент 1: сухой воздух, состоящий из смеси газов
Компонент 2: водяной пар
Водяной пар легче воздуха. Например, плотность насыщенного пара при нормальном атмосферном давлении и температуре 0°С 0,00493 кг/м 3 , а воздуха 1,293 кг/м 3 .
2. Влагосодержание, или абсолютная влажность.
Абсолютная влажность это количество водяного пара x (г или кг), содержащееся в 1 кг сухого воздуха.
x = mD / mL, в кг водяного пара/кг сухого воздуха (1)
3. Парциальное давление.
В технике кондиционирования воздуха работают с таким параметром, как абсолютная влажность x.
В метеорологических же таблицах используют в качестве характеристической величины парциальное давление pD.
Выведем зависимость абсолютной влажности от парциального давления.
Если допустить, что компоненты смеси «влажного воздуха» ведут себя как идеальные газы, то для смеси, как и для отдельных ее компонентов, имеет силу уравнение состояния для идеальных газов:
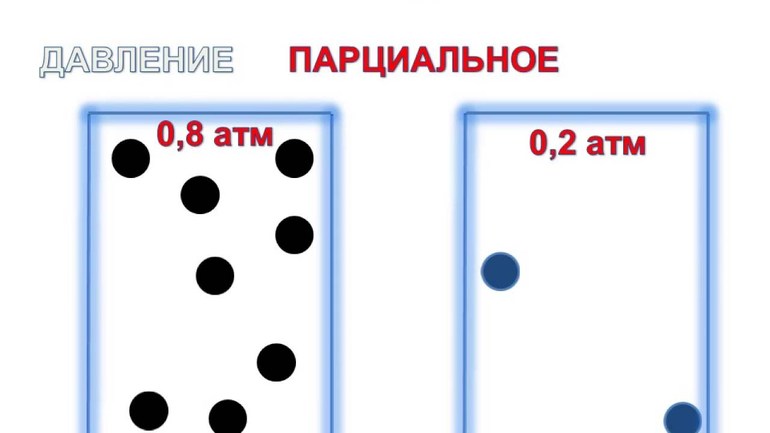
Парциальное давление – давление газа (пара) в смеси, которое он оказывал бы при данной температуре, если бы он один занимал объем смеси.
Сумма парциальных давлений от p1 до pn компонентов от 1 до n равна полному давлению смеси.
Для влажного воздуха, согласно закона Дальтона (3) имеем:
pL – парциальное давление сухого воздуха;
pD – парциальное давление водяного пара.
При использовании уравнения (2) для сухого воздуха и водяного пара с учетом высказывания Дальтона получаем для компонентов водяного пара:
для компонентов сухого воздуха
Соотношение масс компонентов согласно формуле (1) может быть описано через выражение:
Значения газовых постоянных равны RD = 461,5 Дж/кг·К и RL = 287,1 Дж/кг·К
Получаем следующее уравнение зависимости абсолютной влажности от парциального давления:
где pD – парциальное давление водяного пара.
4. Относительная влажность.
Сухой воздух и водяной пар не подлежат безграничному смешиванию. Каждому значению температуры соответствует максимальное количество водяных паров, которое может содержаться в воздухе, и определенное парциальное давление этих паров.
Относительная влажность это отношение существующего парциального давления водяного пара к давлению насыщения при равной температуре.
Температура, при которой начинается конденсация избыточного количества водяных паров, называется температурой «точки росы», а воздух, в котором начинается конденсация, называется насыщенным.
При понижении температуры ниже «точки росы» воды из воздуха выделяется в виде конденсата или тумана, т.е. абсолютная влажность x становится меньше.
5. Удельная теплоемкость и энтальпия воздуха.
Удельная теплоемкость показывает какое количество теплоты, необходимо для повышения температуры вещества массой 1 кг на 1 К.
в уравнении (8) с (кДж/кг·К) есть зависимая от температуры средняя удельная теплоемкость вещества.
Для сухого воздуха сL ≈ 1,005 кДж/кг·К
Для водяного пара сD ≈ 1,858 кДж/кг·К
Полная энтальпия влажного воздуха рассчитывается как:
Поскольку x = mD / mL, энтальпия воздуха равняется:
Для расчета энтальпии водяного пара имеет силу упрощенная формула: hD ≈ сD·t + r0
где: сD – средняя удельная теплоемкость водяного пара в пересчете на 0ºС (кДж/кг·К)
r0 – теплота парообразования воды в пересчете на 0ºС (2500 кДж/кг)
Для расчета энтальпии сухого воздуха: hL = сL·t
Подставляя значения, в уравнение расчета полной энтальпии воздуха, получаем формулу:
h = 1,005·t + x·(1,858·t + 2500) или в приближенном варианте:
h ≈ t + x·(1,86·t + 2500) кДж/кг сухого воздуха
6. Удельная теплоемкость и энтальпия воды.
Энтальпия (теплосодержание) воды определяется количеством тепла, которое нужно затратить для нагрева 1 кг воды от 0ºС до заданной температуры.
Энтальпия – функция термодинамической системы, равная сумме внутренней энергии и произведения объема на давление.
Для воды удельную теплоемкость с достаточной для практических расчетов точностью принимают равной с=4,2 кДж/кг·К или 1 ккал/кг·Сº, т.к. удельная теплоемкость воды слабо зависит от температуры.
Количество теплоты (Q, ккал), которое необходимо сообщить телу (например, нагреваемой в котле воде) для повышения его температуры от t1 до t2, равно произведению массы тела (m, кг), его удельной теплоемкости (с, ккал/кг·Сº), разности конечной t2 и начальной t1 температуры тела (Сº).
Пример: Циркуляция воды через водогрейный котел составляет 300 т/ч. Температура воды на входе в котел 70Сº, а температура воды на выходе из котла 100 Сº. Найти часовую производительность котла.
Q = m·c·(t2 — t1) = 300·10 3 · 1000 · (100 – 70) = 9·10 9 = 9 Гкал/час
7. Процесс парообразования.
Парообразованием называется процесс превращения жидкости в пар.
Жидкость может превращаться в пар при испарении и кипении.
8. Процесс парообразования. Испарение воды.
При испарении образование пара происходит только с поверхности воды, и этот процесс имеет место быть при любой температуре.
Испарение воды может быть полным, если над водой находится неограниченное пространство.
В природе процесс испарения воды осуществляется в гигантских масштабах в любое время года: испарение в реках, морях и океанах.
При нагревании воды повышается ее температура и возрастает интенсивность испарения.
9. Процесс парообразования. Кипение воды.
При некоторой вполне определенной температуре, зависящей от давления, под которым находится вода начинается парообразование по всей массе воды. При этом внутри объема воды образуются пузырьки пара. Это явление называется кипением жидкости. Давление получающегося при этом пара такое же, как и среды, в которой происходит кипение.
Во время кипения воды, находящейся в открытом сосуде, температура ее остается неизменной, а вся вода при достаточном подводе тепла превращается в пар.
При достижении водой температуры кипения образуются небольшие паровые пузырьки, которые всплывают к поверхности воды, преодолевают силы поверхностного натяжения и вырываются в паровое пространство.
Объем пара при этом больше испарившейся воды примерно в 1700 раз.
10. Скрытая теплота парообразования.
Тепло, расходуемое на превращение кипящей воды в пар, называется скрытой теплотой парообразования, а это тепло, отнесенное к 1 кг воды, называется удельной теплотой парообразования.
Чтобы нагреть 1 кг воды при барометрическом давлении от 0ºС до 100ºС, требуется затратить примерно 100 ккал тепла, а скрытая теплота парообразования при этом равна примерно 500 ккал, т.е. в 5 раз больше.
Энтальпия насыщенного пара равна сумме энтальпии воды при температуре кипения и скрытой теплоты парообразования.
11. Насыщенный пар.
Пар, образующийся в присутствии кипящей воды, содержит капельки жидкости, и его называют влажным насыщенным паром. Удаление частиц воды из пара называется сепарацией.
Если продолжать нагревать сухой насыщенный пар, то температура его будет расти и станет выше температуры насыщения при том же давлении. Такой пар называют перегретым. Получают перегретый пар в специальном устройстве котла – пароперегревателе.
Перегретый пар при снижении температуры не конденсируется до момента достижения температуры насыщенного пара при том же давлении. С дальнейшим понижением температуры происходит конденсация водяных паров.
12. Адиабатическое испарение воды.
Переход воды из жидкого состояния в газообразное (пар) сопровождается поглощением теплоты испарения Qи.
Удельная теплота испарения воды Lи — это количество теплоты, необходимое, чтобы перевести 1 кг воды в парообразное состояние при постоянной температуре.
Удельная теплота испарения воды зависит от температуры, при которой испаряется вода. Эта зависимость определяется следующей эмпирической формулой:
где 25·10 5 Дж/кг — удельная теплота испарения при температуре поверхности воды, равной 0°С; tв — температура испаряющейся воды.
Источником ее обычно служит внутренняя энергия самой жидкости, поэтому при испарении она охлаждается.
Тепловые показатели воды аномальны по сравнению с аналогичными характеристиками других веществ.
Это обстоятельство обязано ее структуре, обусловленной водородными связями между молекулами, характеризующимися большей прочностью, чем межмолекулярные взаимодействия. Например, большая теплоемкость воды может быть объяснена только распадом ассоциированных молекул при нагревании. Так как распад этих молекул сопровождается поглощением энергии, то при нагревании воды теплота расходуется не только на повышение температуры, но и на распад ассоциированных молекул.
13. Методы процесса увлажнения воздуха.
Наибольшее практическое применение увлажнения воздуха получили два основных метода увлажнения:
| Увлажнение воздуха | |
| Изотермическое | Адиабатическое |
| при постоянной температуре ΔТ = 0 | при постоянной энтальпии ΔQ = 0 |
14. Изотермическое увлажнение воздуха.
Способы изотермического увлажнения:
Изотермическое увлажнение происходит при постоянной температуре.
В воздух непосредственно поступает насыщенный пар.
Фазовый переход воды из жидкого в парообразное состояние осуществляется за счет внешних источников тепла.
Например, выделяемого тепла за счет прохождения электрического тока через воду (содержащую определенное количество минеральных солей).
С увеличением абсолютного влагосодержания энтальпия образуемой при этом водо-воздушной смеси растет путем увеличения скрытой составляющей тепла. При этом температура, характеризуемая явной составляющей тепла, остается неизменной.
15. Адиабатическое увлажнение воздуха.
Способы адиабатического увлажнения:
— распылительного типа (воздушно-водяной)
— распылительного типа (водяной)
Адиабатическое увлажнение воздуха происходит при постоянной энтальпии.
Фазовый переход из жидкого в парообразное состояние осуществляется путем свободного испарения воды.
При этом имеет место внутренний переход части явного тепла в скрытое тепло.
16. Принципиальные различия изотермического и адиабатического увлажнения воздуха
Большее энергопотребление, за счет компенсации скрытой теплоты испарения воды в ходе парообразования за счет внешних источников энергии.
Процесс парообразования происходит за счет внутреннего перераспределения энергии.
| Изотермическое | Адиабатическое |
| Проще реализуется аппаратно | Требуется подготовленная вода |
| Генерация 10кг влаги требует 7,5 кВт*ч потребляемой энергии. | Генерация 10кг влаги требует 0,04 кВт*ч потребляемой энергии. |
В связи с тем, что адиабатическое увлажнение является более экономичным, как минимум на 1-2 порядка, изотермическое увлажнение чаще используется для создания комфортных условий в быту, где дефицит влаги, как правило, не превышает 100 кг/ч.
Компания ЕС Инжиниринг охватываем множество индустриальных направлений по созданию микроклимата в помещениях путем увлажнения воздуха. Решить все задачи увлажнения воздуха однотипной системой невозможно, поэтому мы предлагаем несколько типов адиабатических систем увлажнения воздуха:
- Система увлажнения внутри вентиляции
- Система увлажнения открытым способом в помещении
- Локальное увлажнение воздуха
- Увлажнение «сухой туман»
- Адиабатическое охлаждение воздуха
17. Увлажнители испарительного типа
Система реализуется в системах вентиляции.
В увлажнителях испарительного типа воздух прокачивается через панели, заполненные смачиваемой водой насадкой, в результате чего за счет пленочного испарения происходит насыщение воздуха парами воды.
Есть два варианта конструктивного исполнения увлажнителей данного типа:
— с рециркуляцией воды
— без рециркуляции воды
Основные принципиальные недостатки увлажнителей испарительного типа:
— отсутствие возможности регулирования количества испаряемой влаги с приемлемой точностью
— с рециркуляцией воды возникает опасность размножения бактерий в системе
— без рециркуляции воды только 15-30% воды используется по прямому назначению, т.е. испаряется и увлажняет обрабатываемый воздух, остальная часть воды идет в канализацию
— с рециркуляцией воды — 30-90% воды идет на промывку мембран увлажнителей для очистки их от соли и примесей
Производителями указываются в спецификации коэффициенты эффективности испарителей:
под этим подразумевается коэффициент эффективности мембраны, т.е. сколько теоретически испариться в воздух влаги в сравнении с количеством подаваемой воды.
Этот коэффициент не показывает долю обеспечения относительной влажности в помещении от количества используемой воды.
Компания ЕС Инжиниринг не рекомендует применение испарительных увлажнителей по причине опасности размножения бактерий и проблем с гигиеной внутри вентиляции.
18. Увлажнители распылительного типа: воздушно-водяные
Увлажнители распылительного типа (воздушно-водяные) осуществляют распыление воды через форсунки, к которым подводятся по отдельным трубопроводам вода и сжатый воздух.
Принцип работы: в увлажнитель поступает сжатый воздух и вода; методом инжекции вместе со сжатым воздухом она выходит через форсунку наружу. За счет резкого перепада давления смесь воздуха и воды расширяется, и вода мгновенно превращается в пар.
Установка данных увлажнителей целесообразна при производительности до 200 л/ч.
Для работы данной системы увлажнения необходим компрессор. Такие увлажнители создают шум при работе.
Компания ЕС Инжиниринг предлагает разновидность увлажнителя на сжатом воздухе «сухой туман», который совсем не дает конденсации. Это единственная система представленных на рынке, в которой вода от форсунок может попадать на трубопроводы, материалы и конденсации не будет.
19. Увлажнители распылительного типа: водяные
Увлажнители распылительного типа (водяные) осуществляют распыление воды высокого давления (70 бар) через форсунки. Такие системы называются высоконапорные системы увлажнения воздуха.
Благодаря минимальному энергопотреблению систем — 5 Вт на 1 л воды — высоконапорные системы являются наиболее подходящей технологией увлажнения больших (>10.000 м 3 /ч) и очень больших объемов воздуха (>500.000 м 3 /ч) помещений.
Принцип работы: насос создает давление воды 70 бар, вода выходит в пространство через отверстие форсунки Ø 0,1-0,2 мм, из-за резкого перепада давления, вода дробится на мелкую дисперсию и превращается в пар.
Широкий диапазон производительности оборудования, от 60 л/ч до 50000 л/ч, решает любые задачи увлажнения на производстве.
Системы безопасны с точки зрения санитарии, т.к. вода находится в замкнутом пространстве и не имеет контакта с воздухом. Для форсунок требуется очищенная вода.
Компания ООО «ЕС Инжиниринг» изготавливает, монтирует системы увлажнения воздуха высокого давления из комплектующих Danfoss. Насосы высокого давления компании Danfoss серии PAHT это единственные насосы, представленные на рынке, которые работают без смазки маслом, поэтому требуют минимального обслуживания и работают минимум 8000 часов! без обслуживания.
20. Сравнение системы испарительного типа и высоконапорной системы увлажнения воздуха
Увлажнители устанавливаются в внутри вентмашины системы вентиляции, т.е. требуется наличие вентмашины.
Кроме того, процесс увлажнения воздуха будет происходить только при работающей вентмашине в отличие от увлажнителей, распыляющих влагу непосредственно в помещении, которым не нужна вентмашина. При применении увлажнения в вентмашине требуется подогрев воздуха перед секцией увлажнения для того, чтобы водяной пар мог полностью испариться и не конденсировал ниже точки росы.
Для испарительных увлажнителей обычно требуется два калорифера, основной до секции увлажнения и калорифер доводчик требуемых параметров воздуха, после секции увлажнения.
Основные недостатки систем испарительного типа:
— нельзя регулировать количества испаряемой влаги с приемлемой точностью
— с рециркуляцией воды возникает опасность размножения бактерий в системе
— без рециркуляции воды только 15-30% воды используется по прямому назначению, т.е. испаряется и увлажняет обрабатываемый воздух, остальная часть воды идет в канализацию
— с рециркуляцией воды — 30-90% воды идет на промывку мембран увлажнителей для очистки их от соли и примесей
Реализуется как в составе вентустановки так и для объемного увлажнения непосредственно внутри помещения.
Единственный недостаток системы: для эксплуатации требуется подготовленная вода.
Позволяет с большой точностью поддерживать относительную влажность в помещении.
Вода в системе увлажнения не застаивается, т.е. нет опасности размножения бактерий.
21. Пример расчета производительности системы увлажнения воздуха.
Подаваемый воздух снаружи: tнар = 0 ºС; φнар = 60%
Vвент = 6000 м 3 /час
Воздух в помщении: tвнутр = 22 ºС; φвнутр = 60%
Находим, что xнар = 2,29 г/кг; xвнутр = 10,1 г/кг
mводы = 6000 м 3 /час · 1,2 к/м 3 · (10,1 – 2,29) г/кг · 10 -3 = 56 л/час
22. Адиабатическое охлаждение воздуха с помощью системы увлажнения.
Используется в летний период времени для понижения «пиковых» температур уличного воздуха выше 25°С, который идет на охлаждение теплообменных аппаратов.
- Наружные блоки кондиционеров
- Рекуператоры вентмашин
- Аппараты воздушного охлаждения (АВО)
- Открытое воздушное пространство бытовых и промышленных помещений
В теплый период времени адиабатическое охлаждение позволяет понизить температуру приточного воздуха до 10 °C.
Можно использовать, как дополнительный эффект охлаждения воздуха взамен традиционного, что позволяет значительно экономить энергоресурсы.
📸 Видео
Связь между давлением, объёмом и температурой газаСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

Физика 10 класс (Урок№21 - Взаимные превращения жидкостей и газов.)Скачать

Парциальное давление, пример | Газы.Молекулярно-кинетическая теория | ХимияСкачать

Давление водяных паровСкачать

Парциальное давлениеСкачать

TM-3.4 Парциальное давление водяного параСкачать

Задачи на правило Вант-Гоффа. Зависимость скорости реакции от температуры.Скачать

Урок 45 (осн). Давление газаСкачать

Давление насыщенного параСкачать

Насыщенный и ненасыщенный пар. Влажность воздуха. 10 класс.Скачать

Влажность воздухаСкачать

Связь между давлением и объёмом газаСкачать