Молекулярная абсорбционная спектроскопия. Основной закон светопоглощения. Практическое применение метода.
Абсорбционная спектроскопия. Основной закон светопоглощения (закон Б-Л-Б).
Атом, ион или молекула, поглощая квант света, переходит в более высокое энергетическое состояние. Обычно это бывает переход с основного, невозбужденного уровня на один из более высоких, чаще всего на первый возбужденный уровень. Вследствие поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается и тем больше, чем выше концентрация светопоглощающего вещества.
Закон Бугера — Ламберта — Бера связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя. Чтобы учесть потери света на отражение и рассеяние, сравнивают интенсивности света, прошедшего через исследуемый раствор и растворитель При одинаковой толщине слоя в кюветах из одинакового материала, содержащих один и тот же растворитель, потери на отражение и рассеяние света будет зависеть от концентрации вещества.
Уменьшение интенсивности света, прошедшего через раствор, характеризуется коэффициентом пропускания (или просто пропусканием) T: T= I / I0, где I и I0 — соответственно интенсивности света, прошедшего через раствор и растворитель.
Взятый с обратным знаком логарифм T называется оптической плотностью A :
Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера-Ламберта-Бера: I=I0 10 — e lc , или I / I0=10 — e lc ,или -lg T=A= e l c (1)
где e – молярный коэффициент поглощения; l – толщина светопоглощающего слоя;c – концентрация раствора.
Физический смысл e становится ясным, если принять I=1 см и c=1 моль/л, тогда A= e . Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора при толщине слоя 1 см.
Оптическая плотность раствора, содержащего несколько окрашенных веществ, обладает, свойством аддитивности, которое иногда называют законом аддитивности светопоглощения. В соответствии с этим законом поглощение света каким-либо веществом не зависит от присутствия в растворе других веществ. При наличии в растворе нескольких окрашенных веществ каждое из них будет давать свой аддитивный вклад в
Ограничения и условия применимости закона Бугера-Ламберта–Бера:
1. Закон справедлив для монохроматического света. Чтобы отметить это ограничение, в уравнение (1) вводят индексы и записывают его в виде: A l = e l l c. (2)
Индекс l указывает, что величины A и e относятся к монохроматическому излучению с длиной волны l .
2. Коэффициент e в уравнении (1) зависит от показаеля преломления среды. Если концентрация раствора сравнительно невелика, его показатель преломления остается таким же, каким он был у чистого растворителя, и отклонений от закона по этой причине не наблюдается.
3. Температура при измерениях должна оставаться постоянной хотя бы в пределах нескольких градусов.
4. Пучок света должен быть параллельным.
5. Уравнение (1) соблюдается только для систем, в которых светопоглощающими центрами являются частицы лишь одного сорта. Если при изменении концентрации будет изменяться природа этих частиц вследствие, например, кислотно-основного взаимодействия, полимеризации, диссоциации и т. д., то зависимость A от с не будет оставаться линейной, так как молярный коэффициент поглощения вновь образующихся и исходных частиц не будет в общем случае одинаковым.
Например, при разбавлении раствора дихромата калия происходит не просто уменьшение концентрации иона дихромата, а протекают процессы химического взаимодействия:
Вместо дихромат-ионов в растворе появляются гидрохромат- и хромат-ионы. Зависимость оптической плотности от общей концентрации хрома в растворе не будет линейной.
Свет поглощается раствором избирательно: при некоторых длинах волн светопоглощение происходит интенсивно, а при некоторых свет не поглощается. Интенсивно поглощаются кванты света, энергия которых hv равна энергии возбуждения частицы и вероятность их поглощения больше нуля. Молярный коэффициент поглощения при этих частотах (или длинах волн) достигает больших значений. Распределение по частотам (или по длинам волн) значений молярного коэффициента поглощения называется спектром поглощения.
Обычно спектр поглощения выражают в виде графической зависимости оптической плотности A или молярного коэффициента поглощения e от частоты n или длины волны l падающего света. Вместо A или e нередко откладывают их логарифмы.
Кривые в координатах Ig A — l , как показывает рис. 1, при изменении концентрации или толщины слоя перемещаются по ординате вверх или вниз параллельно самим себе, в то время как кривые в координатах A- l (рис. 2) этим свойством не обладают. Существенное значение имеет эта особенность для качественного анализа. При изучении инфракрасных спектров на графике обычно откладывают процент светопропускания как функцию n ‘ или n .
Рис.1. Зависимость Ig A от l .
1 — раствор концентрации с в кювете толщиной l, см; 2 — раствор концентрации 1/4 с или в кювете толщиной l,см
Происхождение спектров поглощения.
Появление полос поглощения обусловлено дискретностью энергетических состояний поглощающих частиц и квантовой природой электромагнитного излучения. При поглощении квантов света происходит увеличение внутренней энергии частицы, которая складывается из энергии вращения частицы как целого, энергии колебания атомов и движения электронов:
где Eвр -вращательная, Eкол -колебательная, Eэл -электронная энергия.
Уравнение (5) должно включать также слагаемые энергии тонкой и сверхтонкой структуры, связанные с электронным и ядерным спином, поправку на приближенность аддитивной схемы и некоторые другие слагаемые, которыми в первом приближении можно пренебречь.
По энергии вращательное, колебательное и электронное движение различаются весьма существенно, причем Eвр 2 : 10 3 . Каждый вид внутренней энергии молекулы, как уже отмечалось, имеет квантовый характер и может быть охарактеризован определенным набором энергетических уровней или термов и соответствующих квантовых чисел.
1. Вращательные спектры.
Вращательную энергию молекул обычно рассматривают с помощью модели жесткого ротатора, который представляет собой две массы, находящиеся одна от другой, на фиксированном расстоянии.
Возбуждение вращательных уровней энергии происходит уже при поглощении далекого инфракрасного (ИК) и микроволнового излучения, имеющего длину волны l >=10 2 мкм или волновое число n ‘ >=10 2 см -1 . Энергия квантов в этой области спектра равна: Eвр= 2,8 10 -3 n ‘= 1,2 кДж/моль и меньше. Это значение соизмеримо с энергией теплового движения kT, поэтому уже при комнатной температуре часть вращательных уровней заселена.
Чисто вращательные спектры в аналитических целях не используют. Их применяют для исследования строения молекул, определения межъядерных расстояний и т. д.
2. Колебательные спектры.
Полосы, связанные с возбуждением колебательных уровней энергии, расположены в области спектра примерно от 200. 300 до 4000. 5000 см -1 , что соответствует энергии квантов от 3 до 60 кДж/моль. Поэтому при обычных температурах энергетическое состояние молекул, как правило, характеризуется основным колебательным уровнем. Простейшей моделью, которая используется при рассмотрении колебаний двухатомной молекулы, является модель гармонического осциллятора. Это система из двух масс, связанных упругой силой. Кривая потенциальной энергии гармонического осциллятора обычно аппроксимируется параболой (рис. 3, кривая 1).
Следует отметить лишь, что колебательными инфракрасными спектрами обладают не все молекулы, а только те, у которых при колебании происходит изменение их электрического дипольного момента.
ИК-спектрами обладают, например, молекулы НС1, НВг и т. д., но не Н2, О2 и др.
Колебательные спектры многоатомных молекул интерпретируют на основе учения о симметрии молекул и теории групп. Математический аппарат теории групп позволяет вычислить число частот и правила отбора для молекул различной симметрии ( для определения молекулярных констант, изучения строения молекул). Для решения химико-аналитических задач используются так называемые характеристические частоты (чаще для качественного анализа). Анализ ИК-спектров показал, что некоторые из наблюдаемых частот можно привести в соответствие с колебаниями отдельных атомов или групп атомов. Так, например, было найдено, что в спектрах всех молекул, содержащих связи С-Н, имеются частоты в области 2800. 3000 см -1 , тройная связь С — С характеризуется частотой 1650 см -1 , а тройная связь C-C- частотой 2100 см -1 .
3. Электронные спектры.
Верхней энергетической границей колебательного спектра обычно считают энергию фотонов примерно в 5000 см -1 , или около 60 кДж/моль. Дальнейшее увеличение энергии облучающих квантов чаще всего будет приводить к возбуждению электронов и появлению в спектре полос, характеризующих электронные переходы. Интерпретация электронных спектров может быть сделана на основе квантово-механических представлений, например метода молекулярных орбиталей (МО).
Электронные переходы являются наиболее сложными в связи с наложением колебательных, а при определенных условиях и вращательных переходов. Наложение большого числа колебательных переходов часто приводит к существенному уширению полос электронных спектров, так как колебательная структура не всегда разрешается.
Для аналитической характеристики соединений имеет значение не столько интегральное поглощение, сколько светопоглощение при определенной длине волны . Важными аналитическими характеристиками являются молярный коэффициент поглощения в точке максимума e max и полуширина полосы поглощения 
Наибольшей интенсивностью в спектрах поглощения обладают полосы, обусловленные переносом электрона от одного атома к другому (полосы переноса заряда). Часто эти полосы связаны с переносом электрона с р-орбитали лиганда на d-орбиталь центрального иона и наоборот ( молярный коэффициент поглощения порядка 10 4 ). Переносом заряда объясняют, например, интенсивную окраску ионов MnO — 4, CrO 2- 4, окраску тиоцианатных комплексов железа, кобальта, молибдена, сульфосалицилатных комплексов железа и других.
Рис. 6. Полоса поглощения.
Значительно менее интенсивны полосы, связанные с внутриатомными d—d- или f—f -переходами. Спектры окрашенных соединений в растворе обычно характеризуются довольно широкими полосами поглощения. Уширение полос связано с сильным влиянием молекул растворителя на энергетические уровни электронов, ответственных за светопоглощение, и наложением колебательных переходов на электронный переход.
Очевидно, чем выше молярный коэффициент поглощения и меньше ширина полосы, тем более ценными химико-аналитическими свойствами обладает соединение, так как эти характеристики полосы определяют также важные показатели, как предел обнаружения и селективность.
Основные узлы приборов адсорбционной спектроскопии.
Основными узлами являются: источник света, монохроматизатор света, кювета с исследуемым веществом, рецептор (приемник света), оптическая система (состоящая из линз, призм и зеркал, которая служит для создания параллельного пучка света, изменения направления и фокусировки света), а также система для уравнивания интенсивности световых потоков (диафрагмы, оптические клинья и т. д.).
В приборах абсорбционной спектроскопии свет от источника освещения проходит через монохроматизатор и падает на кювету с исследуемым веществом. Интенсивность монохроматического света, прошедшего через кювету, измеряется приемником света (рецептором). Практически обычно определяют отношение интенсивностей монохроматического света, прошедшего через исследуемый раствор и через растворитель или специально выбранный раствор сравнения.
1.Вольфрамовые лампы накаливания.Вольфрамовая спираль дает свет в широком спектральном интервале. Однако стекло пропускает свет лишь в интервале длин волн 350. 1000 нм, т. е. в видимой части спектра и самых ближних ультрафиолетовой и инфракрасной областях.
2.Газонаполненные лампы (водородная, ртутная). В водородной лампе происходит свечение водорода при разряде. Условия возбуждения подбирают так, что возникает практически сплошное излучение в области 200. 400 нм. В ртутной лампе разряд происходит в парах ртути. Возбужденные атомы ртути испускают линейчатый спектр, в котором преобладает излучение с длиной волны 254, 302, 334 нм.
3.Штифт Нернста представляет собой столбик, спрессованный из оксидов редкоземельных элементов. При накаливании путем пропускания электрического тока он дает ИК-излучение в области 1,6. 2,0 или 5,6. 6,0 мкм.
4.Глобар-штифт из карборунда SiC дает излучение в интервале 2. 16 мкм также при пропускании электрического тока.
5.В простейших приборах в качестве источника освещения используется дневной свет.
Монохроматизаторами или монохроматорами называют устройства для получения света с заданной длиной волны. При конструировании монохроматизаторов используют разные оптические явления: поглощение света, интерференцию, дисперсию и т. д. Наибольшее распространение в практике абсорбционной спектроскопии имеют приборы, в которых в качестве монохроматизаторов применяются светофильтры (абсорбционные, интерференционные или интерференционно-поляризационные) и призмы.
Действие абсорбционных светофильтров основано на том, что при прохождении света через тонкий слой вследствие поглощения происходит изменение величины и спектрального состава проходящего светового потока. Абсорбционные светофильтры имеют небольшую прозрачность (T = 0,1) и довольно широкую полосу пропускания ( D l = 30 нм и более). Характеристики интерференционных светофильтров значительно лучше. Светофильтр состоит из двух тончайших полупрозрачных слоев серебра, между которыми находится слой диэлектрика. В результате интерференции света в проходящем пучке остаются лучи с длиной волны, равной удвоенной толщине диэлектрического слоя. Прозрачность интерференционных светофильтров составляет Т = 0,3. 0,8. Эффективная ширина пропускания обычно не превышает 5. 10 нм. Для еще большего сужения полос пропускания иногда пользуются системой двух последовательных интерференционных светофильтров.
Наиболее универсальными монохроматизаторами являются призмы, изготовленные из кварца, стекла и некоторых других материалов. Для инфракрасной спектроскопии используют призмы из LiF, NaCI, KBr и других галогенидов щелочных и щелочноземельных металлов. Эти же материалы применяют для изготовления кювет. Призмы позволяют получать свет высокой монохроматичности в широкой области длин волн.
Приемники света (рецепторы).
В качестве рецепторов в приборах абсорбционной спектроскопии используют главным образом фотоэлементы, фотоумножители, а иногда интенсивность света оценивается на глаз. Для измерения интенсивности инфракрасного излучения применяют фотоэлементы, термоэлементы и болометры. Приемники света характеризуются спектральной чувствительностью – способностью воспринимать излучение различной длины волны – и интегральной чувствительностью, которая измеряется по действию на рецептор не разложенного в спектр излучения.
В термоэлементах используется термо ЭДС, возникающая при изменении температуры спая между металлами или сплавами под действием инфракрасного излучения. Термочувствительный элемент, представляющий собой зачерненную платиновую, сурьмяную или другую тонкую металлическую пластинку, включают в мостовую схему. Принцип действия болометра основан на изменении электросопротивления материала при нагревании.
Промышленностью выпускаются различные приборы абсорбционной спектроскопии: колориметры, фотометры, фотоэлектро-колориметры, спектрофотометры и т. д., в которых используют различные комбинации осветителей, монохроматизаторов и приемников света.
Наибольший интерес с точки зрения качественного анализа представляют колебательные (вернее колебательно-вращательные) спектры. Экспериментальные исследования колебательно-вращательных спектров показали, что полосы при некоторых частотах можно привести в соответствие с колебаниями определенных групп атомов или отдельных атомов в молекуле. Такие частоты назвали характеристическими. Различные молекулы, содержащие одну и ту же связь или одну и ту же атомную группировку, будут давать в ИК-спектре полосы поглощения в области одной и той же характеристической частоты. Это и является основой качественного анализа по инфракрасным спектрам. Например, полосы в области 3000. 3600 см -1 могут быть приписаны только О—Н- или N—Н-связям.
К настоящему времени изучены и сведены в соответствующие атласы и таблицы инфракрасные спектры более чем 20000 соединений, что существенно облегчает практическое проведение анализа. Для получения первых ориентировочных данных часто пользуются так называемой картой Колтупа, на которой указаны спектральные области появления многих характеристических частот и их возможное отнесение. Инфракрасная спектроскопия с успехом используется и в анализе неорганических веществ. Например, характеристическая частота CO 2- 3 составляет 1450 см -1 , SO 2- 4—1130, NO — 3 — 1380, NH + 4 — 3300 см -1 и т. д. Электронные спектры поглощения для целей качественного анализа используются значительно реже, чем колебательные, так как они обычно бывают представлены небольшим числом широких полос поглощения, которые часто накладываются одна на другую и полностью или частично перекрываются.
Методы количественного анализа основаны на законе Бугера-Ламберта-Бера. Основными параметрами фотометрического определения являются длина волны, при которой производится измерение, оптическая плотность, толщина кюветы и концентрация окрашенного раствора. Существенное влияние оказывают различные химические факторы, связанные с полнотой и условиями протекания фотометрической реакции, концентрацией окрашенных и других реактивов, их устойчивостью и т. д. В зависимости от свойств анализируемой системы и характеристик применяемого фотометрического прибора выбирают те или иные условия анализа.
Оптимальные условия фотометрического определения.
Длина волны. При определении в растворе одного светопоглощающего вещества аналитическую длину волны, как правило, выбирают на максимуме полосы поглощения. Если в спектре имеется несколько полос, выбор обычно останавливают на наиболее интенсивной, так как работа в области максимума светопоглощения обеспечивает наиболее высокую чувствительность определения. Плоские максимумы более предпочтительны, так как при этом меньше сказывается погрешность в установлении длины волны, чем в случае острых максимумов или крутоспадающих участков кривой. Желательно также, чтобы чувствительность приемника излучения в области аналитической длины волны была максимальна.
Светопропускание (оптическая плотность). Измерительное устройство фотометрического прибора обычно имеет постоянную ошибку D T в величине коэффициента пропускания Т во всем интервале его значений. Ошибка в единицах оптической плотности D A в связи с этим во всем интервале не будет одинакова. Поэтому при решении некоторых задач удобнее оперировать с коэффициентом пропускания, а не с оптической плотностью. Относительная погрешность резко возрастает при очень малых и очень больших значениях Т. В области средних значений Т кривая проходит через минимум (рис.7). Наибольшая точность измерения. будет достигаться. при lnT+1=0,т.е.при значении оптической плотности А =0,435.
Рис.7. Зависимость относительной погрешности от пропускания раствора
При расчете не учитывалась погрешность за счет других источников, как, например, погрешность при установлении прибора на нулевое и полное пропускание. Более строгое теоретическое рассмотрение и опыт показали, что оптимальная оптическая плотность находится при 0,6. 0,7.
Толщина светопоглощающего слоя. Уравнение закона Бугера-Ламберта-Бера показывает, что чем больше толщина слоя, тем больше оптическая плотность и, следовательно, тем более чувствительным будет определение при прочих равных условиях. Однако с увеличением толщины слоя (длины оптического пути) возрастают потери на рассеяние света, особенно при работе с растворами. Кюветы с толщиной слоя большей чем 5 см для фотометрии растворов обычно не применяются.
Концентрационные условия проведения фотометрической реакции. В уравнение основного закона светопоглощения входит концентрация окрашенного (светопоглощающего) соединения, поэтому превращение определяемого компонента в такое соединение является одной из важнейших операций, в значительной степени определяющей точность анализа. Окрашенные соединения в растворе получают в результате, главным образом, реакций окисления — восстановления и комплексообразования. Окислительно-восстановительные реакции, применяемые в фотометрии, например окисление марганца до MnO — 4, протекают, как правило, практически полностью до конца.
Значительно более сложным является вопрос о концентрационных условиях протекания в растворе реакций комплексообразования. Осложняющее влияние здесь могут оказать процессы ступенчатого комплексообразования, протолитические равновесия, недостаточная устойчивость образующегося комплекса, собственная окраска реагента и т. д. Действие большинства этих факторов можно предвидеть, если равновесия в интересующей системе достаточно подробно изучены и константы соответствующих равновесии известны (константы устойчивости координационных соединений, диссоциации реагентов и т, д.). Используя эти данные, можно рассчитать, например, при каких значениях рН и концентрации реагента будет достигнута необходимая полнота реакции, как будут влиять сопутствующие элементы и т. д.
Чувствительность и точность метода. Минимальную концентрацию, которую можно определить фотометрическим методом, обычно рассчитывают по соотношению
Если для ориентировочных расчетов принять, что Amin = 0,01 , l=1 см и e =10 3 , то
cmin=0,01/10 3 =1*10 -5 моль/л.
Это не минимальная концентрация фотометрического метода, так как e может быть на несколько порядков больше. Точность фотометрических методов зависит от индивидуальных особенностей фотометрической реакции, характеристик применяемого прибора и других факторов и изменяется в довольно широких пределах. Обычная погрешность фотометрических методов составляет примерно 1. 2 % (относительных).
Основные приемы фотометрических измерений
Метод градуировочного графика. В соответствии с законом Бугера-Ламберта-Бера график в координатах оптическая плотность – концентрация должен быть линеен и прямая должна проходить через начало координат. Градуировочный график обычно строят не менее чем по трем точкам, что повышает точность и надежность определений. При отклонениях от закона Бугера-Ламберта-Бера, т.е. при нарушении линейной зависимости А от с, число точек на графике должно быть увеличено. Основные ограничения метода связаны с трудностями приготовления эталонных растворов и учетом влияния так называемых третьих компонентов, т. е. компонентов, которые находятся в пробе, сами не определяются, но на результат влияют.
Метод молярного коэффициента поглощения. При работе по этому методу определяют оптическую плотность нескольких стандартных растворов Aст, для каждого раствора рассчитывают e = Aст /(1/ cст) и полученное значение e усредняют. Затем измеряют оптическую плотность анализируемого раствора Ax и рассчитывают концентрацию cx по формуле: cx= Ax /( e l).
Ограничением метода является обязательное подчинение анализируемой системы закону Бугера-Ламберта-Бера, по крайней мере, в области исследуемых концентраций.
Метод добавок. Этот метод применяют при анализе растворов сложного состава, так как он позволяет автоматически учесть влияние “третьих” компонентов. Сущность его заключается в следующем. Сначала определяют оптическую плотность Ax анализируемого раствора, содержащего определяемый компонент неизвестной концентрации cx, а затем в анализируемый раствор добавляют известное количество определяемого компонента (cст) и вновь измеряют оптическую плотность Ax+ст .
Оптическая плотность Ax анализируемого раствора равна: Ax = e l cx
а оптическая плотность анализируемого раствора с добавкой стандартного:
Отсюда находим концентрацию анализируемого раствора:
Концентрацию анализируемого вещества в методе добавок можно найти также по графику в координатах Ax+ст =f(cст.) .Если откладывать Ax+ст как функцию cст, то получится прямая, экстраполяция которой до пересечения с осью абсцисс даст отрезок, равный – cx
Метод дифференциальной фотометрии. Фотометрирование интенсивно окрашенных растворов успешно осуществляется методом дифференциальной фотометрии. В обычной фотометрии сравнивается интенсивность света Ix, прошедшего через анализируемый раствор неизвестной концентрации, с интенсивностью света I0, прошедшего через растворитель. Коэффициент пропускания такого раствора будет равен отношению интенсивностей :
Количественный анализ по инфракрасным спектрам. Анализ по ИК-спектрам также основан на применении закона Бугера— Ламберта—Бера. Чаще всего здесь используется метод градуировочного графика. Существенно затрудняется применение метода молярного коэффициента поглощения в ИК-спектроскопии тем, что из-за рассеяния, сплошного поглощения и других эффектов часто бывает невозможно определить положение линии 100%-ного пропускания, т.е. определить интенсивность света, прошедшего через образец без анализируемого компонента (I0).
Многие трудности количественной ИК-спектроскопии успешно преодолеваются с помощью метода базовой линии, который получил большое распространение в практике. Сущность его легко понять из рис. 11, на котором приведен участок ИК-спектра с двумя полосами поглощения (их волновые числа n A и n B). Базовая линия проводится в основании полосы поглощения (она изображена пунктиром). Коэффициент пропускания определяется в этом методе как отношение TA= IA/I0(A) или TB= IB/I0(B) По полученным данным вычерчивают градуировочный график и производят определения.
Определение смеси светопоглощающих веществ. Спектрофо-тометрический метод, в принципе, позволяет определить несколько светопоглощающих веществ в одном растворе без предварительного разделения. Большое практическое значение имеет частный случай такой системы—анализ смеси двух окрашенных веществ. В соответствии с законом аддитивности светопоглощения для такой смеси веществ, например А и
Довольно распространенным примером такого анализа является также определение с помощью реагента, имеющего собственную окраску. Этот метод может быть распространен и на более сложные многокомпонентные смеси. При подчинении светопоглощения отдельных компонентов закону Бугера-Ламберта-Бера и соблюдении закона аддитивности светопоглощения число слагаемых в уравнениях типа (3.21) увеличивается пропорционально числу определяемых компонентов и соответственно возрастает число уравнений. Для решения систем таких уравнений с успехом используются вычислительные машины.
Определение состава и устойчивости комплексных соединений в растворе. Простота и достаточная точность фотометрических измерений привели к широкому использованию фотометрических методов для исследования реакций в растворе и особенно цветных реакций, имеющих химико-аналитическое значение. Для определения состава соединений часто применяется метод изомолярных серий. При использовании этого метода готовят серию растворов, в которых отношение концентрации центрального иона к концентрации лиганда (cM:cL) изменяется от 9:1 до 1:9, а суммарная концентрация (cM+cL) остается одинаковой во всех растворах (изомолярные серии). Затем измеряют оптическую плотность растворов и строят график зависимости оптической плотности от концентрационного отношения cM:cL. Максимум на этом графике указывает состав комплекса. Метод изомолярных серий имеет ограничения и недостатки, однако, является одним из наиболее широко применяемых в практике.
Фотометрические и спектрофотометрические методы анализа применяются для определения многих (более 50) элементов периодической системы, главным образом металлов. Методами абсорбционной спектроскопии анализируются руды, минералы и иные природные объекты, продукты переработки обогатительных и гидрометаллургических предприятий. Эффективно используются эти методы в металлургической, электронной, химической и других отраслях промышленности, в медицине, биологии и т. д. Большое значение они имеют в аналитическом контроле загрязнений окружающей среды и решении экологических проблем. Значительно расширились области практического применения методов абсорбционной спектроскопии благодаря более широкому использованию инфракрасной области спектра и приборов со встроенной ЭВМ. Это позволило разработать методы анализа сложных многокомпонентных систем без их химического разделения. Методы абсорбционной спектроскопии продолжают успешно развиваться и совершенствоваться.
Общая характеристика метода.
1. Высокая чувствительность (низкий предел обнаружения).
2. Точность. Погрешность фотометрических методов обычно составляет 3. 5%, уменьшаясь в благоприятных случаях до 1. 2% и нередко до 0,5. ..1,0%.
3. Методы могут быть применены для анализа больших и малых содержаний.
4. Возможность определения примесей (до 10 -5 . 10 -6 %).
5. Высокая избирательность многих фотометрических методов, позволяющая проводить определения элементов в сложных пробах без химического разделения компонентов.
Видео:Закон Бугера-Ламберта-Бера и определение показателя поглощенияСкачать

БУГЕ́РА – ЛА́МБЕРТА – БЕ́РА ЗАКО́Н
В книжной версии
Том 4. Москва, 2006, стр. 287-288
Скопировать библиографическую ссылку:
БУГЕ́ РА – Л А́ МБЕРТА – Б Е́РА ЗАКО́Н, определяет ослабление интенсивности пучка монохроматического света при его прохождении через поглощающую среду (часто называют законом Бугера). Пучок света интенсивностью $I_0$ при прохождении через слой поглощающего вещества толщиной $l$ ослабляется до интенсивности $I = I_0 exp(-k_l),:k_$ – показатель поглощения, различный для разных длин волн. Закон экспериментально установлен в 1729 П. Бугером , в 1760 теоретически обоснован И. Г. Ламбертом при простых предположениях: относительное изменение интенсивности света $dI/I$ при прохождении слоя вещества толщиной $z$ определяется уравнением $dI/I = -k_z$. Решением этого уравнения и является Б.–Л.–Б. з. Физич. смысл закона заключается в независимости поглощения (потери фотонов) от интенсивности света, проходящего через вещество. Однако при очень больших интенсивностях света (сфокусированное импульсное излучение лазера) закон может нарушаться, $k_$ становится зависящим от интенсивности (см. Многофотонное поглощение света , Самоиндуцированная прозрачность ).
Видео:39 Поглощение света Закон Бугера Коэффициент поглощенияСкачать

Коллоидная химия. Шпаргалка
Данное издание создано в помощь студентам вузов, которые хотят быстро подготовиться к экзаменам и сдать сессию без проблем. Пособие составлено с учетом Государственного образовательного стандарта.
Оглавление
- 1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
- 2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
- 3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
- 4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
- 5. Коллоиды. Примеры коллоидных систем, их распространенность в природе и значение для современной технологии
- 6. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия)
- 7. Оптические свойства коллоидов. Статическое рассеяние света. Оптическая анизотропия
- 8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
- 9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
- 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
- 11. Термодинамическое описание разделяющей поверхности
- 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
- 13. Хроматографический адсорбционный анализ
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка предоставлен нашим книжным партнёром — компанией ЛитРес.
8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
Уравнение Рэлея справедливо для монодисперсных разбавленных коллоидных растворов при размерах частиц дисперсной фазы r — kcδ ,
где I и I0 — интенсивность падающего света и света, прошедшего через раствор; k — коэффициент поглощения, зависящий от природы растворенного вещества и длины волны; c — концентрация поглощенного вещества; d — толщина слоя раствора.
Из данного уравнения можно вывести соответствующие уравнения для определения относительной прозрачности и относительного поглощения:
Для коллоидных растворов в уравнение Бугера-Ламберта-Бера вносят поправку, которая необходима для учета рассеяния света. Количество рассеянного света эквивалентно дополнительному количеству поглощенного света. В связи с этим приведем модифицированную формулу, в которой учитывается явление светорассеяния:
где v — объем коллоидной частицы.
Из последнего уравнения можно вывести формулу для расчета размеров коллоидной частицы. Предположим, что частица имеет правильную сферическую форму.
Тогда радиус этой частицы будет определяться так:
Эмпирически радиус частицы в жидком растворе можно определить методом ультрамикроскопии. Для этого при помощи микрометрической окулярной шкалы выделяют определенный объем коллоидного раствора, в котором визуально подсчитывают количество коллоидных частиц. Если известна масса частицы, то, учитывая плотность диспергированного вещества, можно определить объем и размеры частицы.
Поскольку ультрамикроскоп позволяет косвенно судить о форме коллоидных частиц, то необходимо принять во внимание две формулы. Если форма частицы представляет собой куб, то справедливо, что
если частица представляет собой сферу, то
где С — массовая концентрация коллоидного раствора; V — выделенный оптический объем; v — число частиц в объеме V; L — ребро куба; D — диаметр сферы.
🎦 Видео
Закон Бугера-Ламберта-БераСкачать

Урок 408. Основные понятия фотометрии - 1Скачать

Введение в спектрофотометриюСкачать
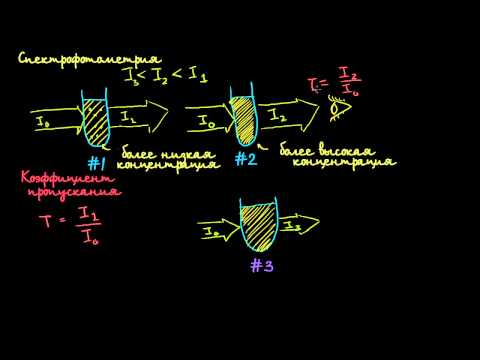
Изучение закона Ламбера-БераСкачать

Поглощение светаСкачать

Абсорбционно-оптический метод измеренийСкачать

СпектрофотометрияСкачать

Оптические методы анализа. Часть 2.Скачать

Изучение закона Ламбера-БераСкачать

Пример из спектрофотометрииСкачать

ЧК МИФ 5_2_2_5_(L4) _ ЗАКОН БУГЕРРАСкачать

Krylov 2017 Optics 25 1080pСкачать

Молекулярно-абсорбционная спектрофотометрия. Часть 1Скачать

Оптические методы анализа. Фотоэлектроколориметрия. Спектрофотометрия.Скачать

Лекция № 9Скачать

Лекция №12 "Анизотропия. Рассеяние света"Скачать

Лекция № 9Скачать

Повестки на акции памяти Навального. Шульман про Юлию Навальную. Касьянов. Z-блогер застрелилсяСкачать














