Видео:Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать

We are checking your browser. gomolog.ru
Видео:Восстановление металлов из оксидов водородом, углеродом, угарным газом, кремнием. BaSO4 + H2 / + CСкачать
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Восстановление железа из его оксида алюминиемСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e328e565c339936 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Взаимодействие алюминия с оксидом железа (III)Скачать

Восстановление оксидов железа монооксидом углерода
Реакции восстановления оксидов железа:
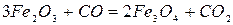
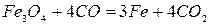
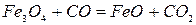
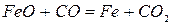
Реакция 1. Окись железа соединение непрочное (см. упругость диссоциации). Реакция идет слева направо при любом содержании в газовой фазе СО и СО2 до полного израсходования одного из реагентов (возможна даже термическая диссоциация).
Реакции 2 и 3. Окисел Fe3O4 более прочный. Для его восстановления необходим избыток окиси углерода в газовой фазе. В противном случае углекислота окисляет FeO до Fe3O4. Для протекания реакций отношение СО2:СО не должно быть больше определенных значений.
Реакция 4. FeO является самым прочным оксидом железа. Для протекания прямой реакции необходим еще больший избыток СО и меньшее отношение СО2:СО в газовой фазе.
Отсюда следует, что для каждого окисла при данной температуре существует такое соотношение восстановителя и его окисла (СО и СО2) в газовой фазе, при котором газовая фаза является нейтральной по отношению к окислу железа и продукту его восстановления, а восстановительно-окислительная реакция находится в подвижном равновесии.
Так как объем газообразных продуктов реакции равен объему газа, вступающему в реакцию, состав равновесной газовой фазы не зависит от давления и меняется только с изменением температуры. Равновесные соотношения СО2:СО в газовой фазе установлены расчетами в соответствии с законами химической термодинамики и подтверждены экспериментально.
Равновесные составы газовой фазы с окислами железа и железом при разных температурах могут быть представлены следующей диаграммой (рис. 2.1‑3).
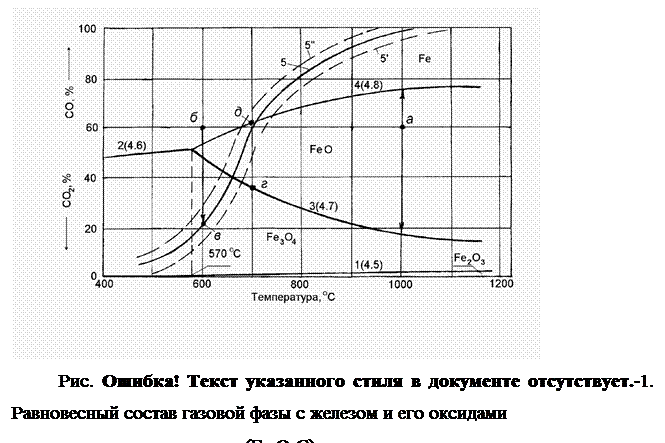
Равновесный состав газовой фазы реакции (1), необратимо протекающей при незначительном содержании СО, практически соответствует при любой температуре 100% СО2 в газовой фазе. Поэтому линия равновесия этой реакции как бы совпадает с осью абсцисс.
Равновесный состав газовой фазы реакции (2) с изменением температуры меняется по кривой 2. Равновесные составы газовой фазы реакций (3) и (4) изменяются соответственно по кривым 3 и 4. Причем кривая 3 нисходящая, а кривая 4 — восходящая. Это объясняется эндотермичностью реакции (3) (реакция протекает с затратами тепла, тепловой эффект реакции “-“) и экзотермичность реакции (4) (реакция протекает с выделением тепла, тепловой эффект реакции “+“). Повышение температуры в соответствии с принципом Ле Шателье смещает равновесие эндотермической реакции в сторону поглощения тепла, вызывает увеличение содержания СО2 и снижение содержания СО в газовой фазе (кривая 3 — нисходящая). Равновесие экзотермической реакции с повышением температуры сдвигается, наоборот, в сторону выделения тепла, увеличения содержания СО и уменьшения содержания СО2 в равновесной газовой фазе (кривая 4 -восходящая).
Таким образом, каждая точка на кривой характеризует равновесие одной из реакций восстановления.
Равновесные кривые делят диаграмму на три области устойчивых состояний: Fe3O4, FeO и Fe. При температурах ниже 570 О С область FeO исчезает, происходит восстановление Fe непосредственно из Fe3O4.
Любая точка вне кривых 2-4 характеризует нейтральный состав газовой смеси при данной температуре по отношению к тому веществу (окислу или железу), которое устойчиво в области расположения точки. Оно не будет ни восстанавливаться, ни окисляться.
Для других веществ состав газа неравновесный, поэтому реакции пойдут в направлении образования того вещества, которое определяет название данной области.
Например, если в газ, содержащий 40% СО2 и 60% СО, при температуре 900 О С поместить Fe, FeO и Fe3O4, то без изменения останется только FeO. Fe3O4 будет восстанавливаться до FeO, а Fe — окисляться до FeO, до тех пор пока не закончатся реагенты или состав газовой фазы не станет равновесным для данной реакции.
Анализ кривых равновесия реакций позволяет сделать следующие выводы:
— Для восстановления гематита достаточно невысокое содержание газа восстановителя;
— Восстановление FeO возможно лишь при высокой концентрации CO в газовой фазе. Причем с повышением температуры величина необходимого избытка восстановителя увеличивается;
— Газ, который не может быть использован для восстановления FeO, используется для восстановления Fe3O4 до FeO.
Восстановительные процессы в доменной печи не достигают рассмотренных равновесных состояний. Это обусловлено:
1. непродолжительным временем пребывания газа в печи
2. протеканием реакции взаимодействия углерода кокса и диоксида углерода кокса.
Реакция распада монооксида углерода газификации углерода кокса, получившая название «реакция Белла – Будуара» в честь ее исследователей, описывается уравнением:
5) 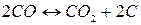
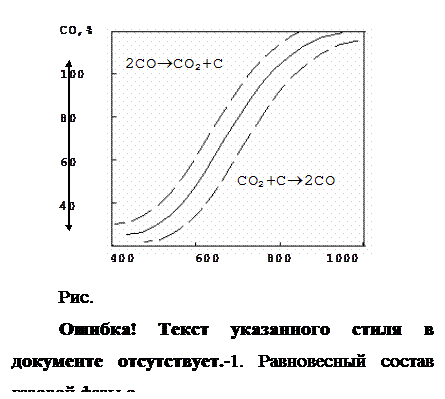
Кривая разделяет поле диаграммы на 2 области. В левой области реакция идет в сторону образования СО2 и сажистого С, в правой – в сторону образования СО. Реакция протекает с изменением объема газовой фазы. Поэтому с повышением давления равновесие реакции сдвигается в сторону увеличения содержания в газе углекислоты. Кривая смещается вправо, вниз.
Прямая реакция – реакция распада углерода протекает при низких температурах. Скорость реакция незначительна и для достижения равновесия необходимо длительное время. Реакция практически не оказывает влияния на состав газовой фазы и восстановительные процессы, протекающие в области низких температур.
Обратная реакция – реакция газификации углерода протекает при высоких температурах, отличается высокой скоростью и быстрым достижением равновесия. С ростом температур скорость этой реакции возрастает. Интенсивное развитие реакция получает при температурах 1000¼1100 О С. Реакция оказывает значительное влияние на состав газовой фазы и восстановительные процессы, протекающие в нижней части шахты печи при высоких температурах.
Совмещение диаграмм, описывающих термодинамические условия равновесия в системах Fе–О–С и С–СО–СО2 позволяет сделать следующие выводы:
— Состав газа левой области препятствует течению восстановительного процесса, состав правой области — способствует.
— Из-за низких скоростей протекания реакции в левой области диаграммы, она не оказывает значительного влияния на восстановительный процесс. Все количество двуокиси углерода, которое образуется в результате рассмотренных реакций, при умеренных температурах (до 700…1000 О С) ни с чем не взаимодействует и уносится газами из печи.
— Реакция оказывает существенное влияние на восстановительный процесс в правой области диаграммы. При температурах 900-1200 О С весь, образующийся в результате восстановления железа, углекислый газ полностью расходуется по этой реакции.
В низкотемпературной зоне за время опускания материала восстановление Fe2O3, Fe3O4 и части FeO успевает завершиться. В высокотемпературной зоне в нормально работающей печи восстанавливается лишь часть FeO.
На основании сказанного можно просуммировать реакции 4 и 5, то есть реакции, протекающие в области высоких температур.
Результирующая реакция имеет вид:

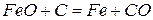
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Твердофазное восстановление оксидов железа углеродом
Процессы углетермического восстановления оксидов железа принадлежат к числу сложных гетерогенных, физико-химических процессов, в которых участвуют твердые, жидкие и газообразные вещества. Термодинамические и кинетические параметры системы непрерывно изменяются в силу одновременного протекания взаимосвязанных химических превращений и физических явлений. Процессы тепло- и массообмена восстановительных реагентов и продуктов реакции оказывают существенное влияние на кинетику процессов диссоциации оксидов, диффузию в газообразных, сплошных и пористых средах, адсорбцию газов на внешних поверхностях и т. д. На кинетику процесса большое влияние оказывают также температура, давление, состав восстановителя, исходная физическая структура оксида, ее изменение в процессе восстановления, химический состав, строение и физико-химическое состояние поверхностных слоев оксидов, степень контактирования фаз и т. д. Структура поверхности твердого тела определяется особенностями и закономерностями его внутреннего строения, а также сложными и разнообразными химическими и физическими процессами и явлениями (адсорбция, десорбция, зарождение новых структур, диффузия и т. д.), которые оказывают существенное влияние на реакционную способность поверхности оксида. В качестве восстановителей используют вещества, обладающие большим сродством к кислороду, чем железо.
На основании многолетних экспериментальных исследований для объяснения закономерностей восстановления твердых оксидов предложены различные механизмы: контактный, термодиссоционный, двухстадийный адсорбционно-автокаталитический (с регенерацией СО), оксид сублимационный, газокарбидный, схема восстановления неустойчивыми газообразными веществами и т. д.
Наиболее часто используется двухстадийная схема восстановления оксидов, основанная на адсорбционно-каталитической теории Г. И. Чуфарова. Согласно данной теории, взаимодействие между оксидами и углеродом осуществляется по двухэтапному механизму при участии газовой фазы, которая регенерируется углеродом по реакции газификации:
На начальном этапе при достаточно хорошем контакте реагентов восстановление происходит локально на границе контакта путем непосредственного взаимодействия оксида и твердого углерода. Область прямого контакта между твердым восстановителем и оксидом ограничена, а коэффициенты взаимной диффузии малы. Реакция является ведущей до тех пор, пока на поверхности оксида не образуются твердые продукты реакции в виде тонкого слоя, который препятствует диффузии реагентов в твердых фазах.
Далее восстановление происходит преимущественно косвенным путем через газовую фазу. Основная часть восстановления связана с кинетикой газификации углерода, которая зависит от температуры процесса и наличия окислителей, а заключительная определяется температурой и составом конвертированного газа.
При восстановлении газами, содержащими углерод, происходит науглероживание материала. Содержание углерода зависит как от температуры, так и от соотношения СО2: СО в газе. В случае восстановления металлов, образующих соединения с углеродом, возможно образование карбидов.
В зависимости от температуры, состава газов, давления, толщины восстановленного слоя, физических свойств контактирующих материалов и т. д. может происходить смена процессов, идущих в диффузионном (внешняя и внутренняя диффузия) или кинетическом (кристаллохимические превращения) режиме. Смена режимов ведет к изменению влияния основных факторов на скорость процесса. Развитие адсорбционно-химических воздействий при газовом восстановлении железа из его оксидов определяет кинетику процесса восстановления, оказывает влияние на формирование пористости твердых продуктов восстановления, от которой зависит развитие диффузионного газообмена и продолжительность восстановления железа из его оксидов. Между адсорбированными молекулами монооксида углерода и поверхностными ионами кислорода оксидной фазы происходит электронный обмен, характерный для хемосорбции [1].
Опираясь на вышеописанные операции сборки и разборки конструкции запорного устройства разрабатывается визуализация сборочного процесса запорного устройства, состоящая из нескольких этапов:
Роль реакций косвенного восстановления определяется температурой и прочностью оксида. По отношению к более прочным оксидам, таким, как Cr2O3, TiO2, ZrO2 и т. д., с термодинамической точки зрения монооксид является слабым восстановителем, однако на практике отмечаются достаточно высокие скорости восстановления газообразными реагентами, которые могут существовать в газовой фазе, контактирующей с твердым углеродом [2].
Несмотря на большое количество экспериментальных и теоретических работ, термодинамика и механизм процесса твердофазного восстановления по-прежнему остаются недостаточно изученными. Перечисленные механизмы позволяют объяснить процесс восстановления определенных оксидов в различных интервалах температур. Единой теории, позволяющей объяснить весь комплекс явлений, происходящих в процессе твердофазного восстановления оксидов углеродсодержащими материалами, нет.
Процесс восстановления железа из оксидов протекает ступенчато, в соответствии с диаграммой Fe-O в системе возникают не только низшие оксиды, но и твердые растворы. На основании принципа последовательности превращений А. А. Байкова переход от высших оксидов к низшим происходит по следующим схемам: при температурах выше 560 °С Fe2O3→Fe3O4→FeO→Fe, ниже 560 °С магнетит восстанавливается до металлического железа, минуя вюстит Fe2O3→Fe3O4→Fe.
В работе [3] рассмотрены особенности низкотемпературного восстановления гематита. Удаление кислорода с поверхности гематита обусловливает избыточную концентрацию ионов железа, которая ведет к переходу ионов Fe+ в границу раздела фаз. Насыщение ионами Fe+ границы раздела фаз ведет к перестройке решетки гематита в решетку магнетита. Одновременно с перемещением границы в глубь кристалла продвигается и свободная поверхность гематита, в результате чего происходит образование каналов. Определяющая роль в механизме процесса роста продукта восстановления отводится диффузии по границам раздела фаз.
Сведения о кинетических параметрах для каждого этапа восстановления железа из оксидов, а также степень металлизации в научно-технической литературе сильно различаются, что обусловлено разным видом оксидов и восстановителей, отличаются и методики проведения экспериментов и методы определения степени металлизации.
СведенияТак, например, при твердофазном восстановлении углеродом электропечных шламов железа [4] в температурном интервале 600–620 °С фиксируется известный переход Fe3O4→FeO. Температурная область устойчивости FeO невелика и по реакции 3FeO+ 3C=Fe3C+ 2CO2 происходит образование цементита, который при дальнейшем нагреве до 900 °С распадается на металлическое железо и оксид углерода Fe3C+CO2 = 3Fe+ 2CO. Температурные интервалы прохождения реакций для разных шламов различаются.
Скорость и степень завершенности процесса восстановления существенно зависят от скорости нагрева образцов. В работе [5] установлено, что при увеличении скорости нагревания от 2,9 до 9,8 °С/мин температура начала восстановления гематита повышается на 10–45 °С, а вюстита уменьшается на 20–60 °С. При быстром нагревании максимальная скорость восстановления вюстита до железа достигает больших значений, чем при медленном нагревании.
На скорость диссоциации оксида большое влияние оказывает реакционная способность восстановителя. Восстановительная способность углеродных материалов определяется содержанием летучих веществ и золы, пористой структурой, удельной поверхностью. Древесный уголь обладает наибольшей пористостью и максимальной удельной поверхностью, которая в десятки раз больше, чем у других углеродсодержащих материалов. Древесный уголь вступает в реакцию уже при 650 °С. После кратковременного воздействия летучих дальнейшее восстановление идет за счет углеродного остатка и определяется его реакционной способностью [6].
В работе [7] исследовали кинетику восстановления оксидов железа ачесоновским графитом и древесным углем. Эксперименты проводили при 950 °С. Отмечено, что цементит в значительных количествах образуется при низких степенях восстановления, с ростом объемов металлической фазы количество карбидов железа уменьшается.
Процесс науглероживания начинается задолго до полного восстановления железа из оксидов, его следует рассматривать в контексте образования твердых растворов углерода в α- и γ-железе. В результате γ→α появляется α-железо, насыщенное до 0,02% С, избыточный углерод выделяется в виде карбида. Анализ структуры показывает, что в результате неравномерного распределения углерода имеет место структурная неоднородность и зональность протекания не только процессов восстановления, но и науглероживания. С ростом температуры увеличиваются скорость и степень науглероживания, а увеличение времени выдержки ведет к увеличению количества связанного углерода в восстановленном железе [8].
Результаты экспериментальных исследований, представленные в работе [9], где в качестве восстановителя использовали графит МПГ6, показали, что восстановление Fe2O3 сопровождается тремя этапами:
Температуры достижения максимальной скорости восстановления составляют 780–980 и 1010 °С.
При углетермическом восстановлении магнетитовых суперконцентратов [10] значительное количество металлического железа появляется только при температуре выше 900° С. Максимальная степень металлизации 33% была достигнута при 950 °С. При 1000 °С степень металлизации составила 27,4% (40 мин обжига). При температурах ниже 900 °С степень металлизации не превышала 5%. Отмечен максимум степени металлизации при температуре 550 °С. Оптимальная температура для углетермического восстановления оленегорского суперконцентрата нефтяным коксом составляет 950° С, при которой степень восстановления и металлизации брикетов достигла соответственно 51 и 33%.
Превращение оксида железа в магнетит составляет небольшую долю в общем объеме восстановления – 11,1 % по кислороду и протекает при большом избытке углерода. Доминирующую роль в общей кинетике восстановления (67%) занимает превращение вюстита, протекающее в наиболее неблагоприятных термодинамических и кинетических условиях. Для одних углеродсодержащих материалов скорость восстановления вюстита пропорциональна их реакционной способности, для других такая закономерность не соблюдается. Отсутствие единой зависимости доказывает существование качественно разных типов кинетики восстановления оксида железа углеродом. Как при восстановлении графитом, который отличается своей способностью к автокаталитическому превращению вюстита в железо, аналогичные максимумы имеют место и при восстановлении нефтяным коксом, сажей. Несмотря на их низкую реакционную способность, при восстановлении вюстита развиваются скорости, близкие и даже превышающие скорости восстановления высокореакционными материалами, такими, как древесный уголь, торфо-кокс, кокс бурого угля [11, 12].
Необходимо отметить, что объемные и поверхностные свойства в значительной мере определяют термические условия образования оксидов, при этом наблюдается тесная корреляционная связь между концентрацией точечных дефектов и адсорбционными свойствами поверхности. Окалина, образовавшаяся при температурах 1273–1473 К, восстанавливается со скоростью в 2–4 раза, превышающей скорость восстановления окалины, сформированной при других температурах [13, 14].
Таким образом, представленные данные свидетельствуют о значительном расхождении экспериментальных исследований кинетики процесса металлизации, температурных и временных параметров процесса восстановления.
Термогравиметрические исследования позволяют получать кинетические параметры процесса изменения массы в процессе восстановления, установить направление изменения и величину энтальпии, характер развития восстановительного процесса. Процессы, протекающие при восстановлении оксидов железа, сопровождаются кристаллохимическими превращениями, приводящими к изменению теплосодержания системы, которое может быть зарегистрировано методом дифференциальнотермического анализа. В связи с этим для проведения экспериментальных исследований использовали дериватограф Q-1500D, на котором предварительно провели дифференциально-термический анализ диссоциации древесного угля. Нагрев проводили в температурном интервале 20–1000 °С со скоростью 10 °С/мин. В качестве образца сравнения использовали прокаленный до 1400 °С оксид алюминия. Для измерения применяли приготовленные из стеатита держатели открытого типа. Навеска образца древесного угля – 170 мг.
Дериватограмма, полученная в результате анализа, показана на рис. 1.
Рисунок 1 – Дериватограмма разложения древесного угля
На кривой ДТА зафиксированы два эндотермических и один экзотермический эффект. Первый эндотермический эффект (100 °С) соответствует процессу выделения содержащейся в древесном угле адсорбированной воды. Вследствие процесса дегидратации произошло уменьшение массы образца на 6%. В интервале температур 200–250 °С начинается процесс оксидации (горения) угля с выделением тепла, что сопровождается растянутым экзотермическим эффектом (температура окончания эффекта
960 °С). Второй эндотермический эффект с максимумом при 815 °С обусловлен разложением карбонатов, присутствующих в угле, до оксидов. Потеря массы образца составила 101 мг (61% от общей массы навески), из которых 3 мг (2% от общей массы навески) связаны с разложением карбонатов и выделением СО2. Следовательно, количество углерода в древесном угле составляет примерно 60% от общей массы. Для определения химического состава не выгоревшего остатка провели его рентгенофазовый анализ на дифрактометре.
Расшифровка дифрактограммы показала, что в остатке присутствует значительное количество соединений, таких, как кварц, оксиды кальция и магния, а также полевые шпаты. Степень загрязнения такими примесями составляет примерно 32% от массы древесного угля.
Для дальнейших экспериментальных работ в качестве исходных материалов использовали химически чистый порошок гематита, молотые окалины сталей 20ХНР, 20ХГТ, 40ХГНМ и активированный уголь. В каждом опыте материал, содержащий оксид железа, смешивали с восстановителем в пропорции 4:1 и 2:1 соответственно.
Рисунок 2 – Кривые ТГ при соотношении оксид-восстановитель 4:1
Рисунок 3 – Кривые ТГ при соотношении оксид-восстановитель 2:1
По результатам работы получены дериватограммы, основные параметры которых приведены на рис. 2–5. Как видно из рисунков, процессы, протекающие при восстановлении окалины легированных сталей, практически идентичны.
Более высокая потеря массы по линии ТГ, отражающей гематит, определяется тем, что окалина преимущественно уже состоит из магнетита.
На кривой ТГ начальное уменьшение массы образца, которое обусловлено удалением адсорбционной влаги, сопровождается первым эндотермическим эффектом при температуре 100 °С. В интервале 200–250 °С начинается процесс окисления активированного угля с выделением тепла, что сопровождается большим экзотермическим эффектом.
Рисунок 4 – Кривые ДТА при соотношении оксид-восстановитель 4:1
Рисунок 5 – Кривые ДТА при соотношении оксид-восстановитель 2:1
На кривых ДТА (рис. 5) можно выделить три основных пика, которые соответствуют превращениям α-Fe2O3 в β-Fe2O3 при температурах 500– 600 °С, что хорошо согласуется с литературными данными относительно начала восстановления, восстановлению Fe2O3 до Fe3O4 при температурах 800–900 °С и восстановлению Fe3O4 при температурах 900–1000 °С.
Присутствие на рис. 4 только двух пиков в интервалах 500–600 и 800–900 °С (восстановление до магнетита) предположительно, связано с недостаточным количеством восстановителя, что привело к замедлению процесса восстановления при повышенных температурах.
Можно отметить, что, пройдя через ряд обратимых окислительно-восстановительных реакций, сопровождающихся эндо-и экзотермическими эффектами, образцы окалины восстановились и повторно окислились в виду того, что после полного выгорания восстановителя образцы находились некоторое время в окислительной атмосфере при повышенных температурах. Однако по кривым гематита наблюдается восстановление, связанное с потерей 21 мг кислорода для навески 4:1 и 23 мг – для навески 2:1. Количество кислорода в навесках гематита составляло соответственно 128 и 107 мг.
На следующем этапе с целью исключения влияния окислительной атмосферы на дериватографе провели анализ восстановления гематита углем в атмосфере аргона. Для эксперимента использовали порошок чистого гематита, в качестве восстановителя – размолотый древесный уголь. Дериватограмма восстановления гематита показана на рис. 6.
Рисунок 6 – Дериватограмма восстановления гематита древесным углем в инертной атмосфере
Посредством сопоставления дериватограмм восстановления гематита (рис. 6) и горения угля (см. рис. 1) были исключены эндотермические пики, соответствующие дегидратации угля и разложению карбонатов. Таким образом, были зафиксированы два основных эндотермических эффекта, соответствующих восстановлению Fe2O3 до Fe3O4 при 700–800 °С и восстановлению Fe3O4 при 850–950 °С. Потеря суммарной массы кислорода из оксидов железа составила 56 мг, что соответствует степени восстановления в 86% и степени металлизации в 79%.
Рентгенофазовый анализ, проведенный на установке ДРОН-2, показал, что в полученных образцах порошок состоит из смеси оксидов железа с разной степенью окисления. Степень металлизации образцов составляет 45–65%.
Список использованной литературы
1. Симонов В. К., Карпов В. Ю. Диффузия, сорбция и фазовые превращения в процессах восстановления металлов. М.: Наука, 1981.
2. Чернобровин В. П., Сенин А. В., Михайлов Г. Г., Пашкеев И. Ю. Термодинамический анализ восстановления хромсодержащих оксидов газообразными восстановителями // Изв. вузов. Черная металлургия. 2005. №7. С. 6–10.
3. Горбачев В. А., Шаврин С. В. О механизме низкотемпературного восстановления гематита // Изв. вузов. Черная металлургия. 1983. № 2. С. 3–5.
4. Аверин В. В., Корнеев В. П., Дюбанов В. Г. Твердофазное восстановление углеродом электропечных шламов // Изв. вузов. Черная металлургия. 2010. № 9. С. 10–13.
5. Ван Хиен Нгуен, Колчанов В. А., Рыжонков Д. И., Филиппов С. И. Исследование восстановления окислов железа углеродом термогравиметрическим методом // Изв. вузов. Черная металлургия. 1971. №8. С. 8–13.
6. Зайцев А. К., Криволапов Н. В., Валавин В. С., Вандарьев С. В. Особенности восстановления железа каменноугольными и углеграфитовыми материалами из маложелезистого шлака // Изв. вузов. Черная металлургия. 2002. №3. С. 6–15.
7. Острик П. Н., Кудиевский С. С., Жук Г. П., Поспелова Л. И. Особенности восстановления окислов железа ачесоновским графитом и древесным углем // Изв. вузов. Черная металлургия. 1978. № 5. С. 12–16.
8. Рыжонков Д. И., Левина В. В., Бурминская Л. М., Булгаков Г. В. Исследование процессов науглероживания восстановленного железа в брикетах // Изв. вузов. Черная металлургия. 1997. № 9. С. 3–6.
9. Утуи Яхья Л., Рыжонков Д. И., Дроздов Н. Н. Углетермическое восстановление смесей MnO2 и Fe2O3 // Изв. вузов. Черная металлургия. 1984. № 11. С 4–8.
10. Пыриков А. Н., Жак А. Р., Борисов А. В. К вопросу об углетермическом восстановлении магнетитовых суперконцентратов // Изв вузов. Черная металлургия. 1986. № 1. С. 14–17.
11. Архипов В. С., Смольянинов С. И., Страхов В. М. Теория и практика прямого получения железа. М.: Наука, 1986. С. 131–135.
12. Архипов В. С., Смольянинов С. И. Влияние реакционной способности углерода на скорость восстановления гематита // Изв. вузов. Черная металлургия. 1989. № 1. С. 10–13.
13. Карабасов Ю. С., Чижикова В. Н., Горбунов В. Б. и др. Влияние температуры обработки окиси железа на ее реакционную способность // Изв. вузов. Черная металлургия. 1984. № 7. С. 23–25.
14. Туговиков А. Э., Сойфер Л. М., Кашин В. И. Влияние температуры формирования окалины на скорость ее восстановления // Изв. вузов. Черная металлургия. 1986. № 9. С. 15–18.
📺 Видео
Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать

Оксид углерода(II). Угарный газ. Состав. Строение. Получение. СвойстваСкачать

Окислительно-восстановительные реакции в неорганической химии 9-11 класс.Скачать

Способ высокотемпературного прямого восстановления оксидов металлов водородомСкачать

Как получить оксид железа Fe2O3 самому.Скачать

9 класс. Оксиды углерода.Скачать

6 Восстановление оксида меди водородомСкачать

Соединения железаСкачать

Оксид углерода II. Способы получения и химические свойства | ХимияСкачать

Получение оксида железа(III)Скачать

Железо | ХимияСкачать

Восстановление оксида меди водородомСкачать

Угарный газСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Процесс получения Fe2O3. Оксид железа |||.Скачать








