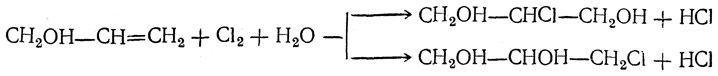
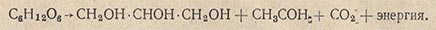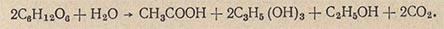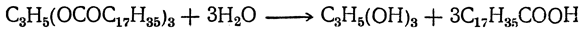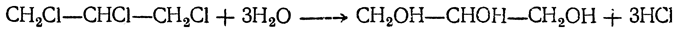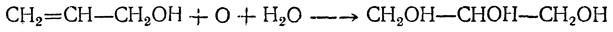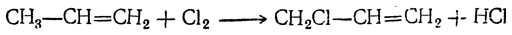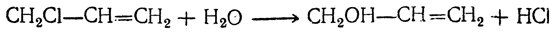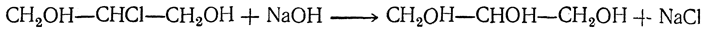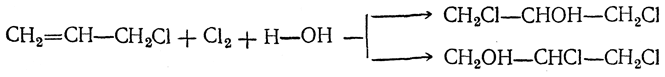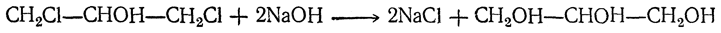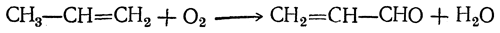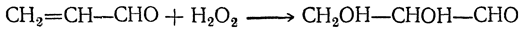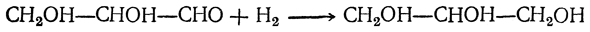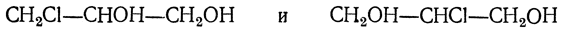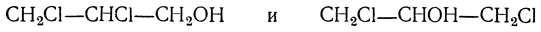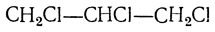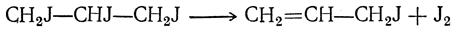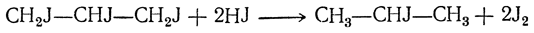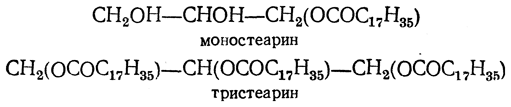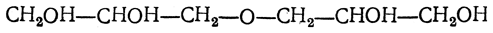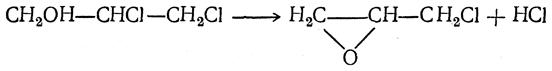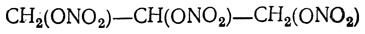Видоизмененный процесс спиртового брожения, при котором в среде накапливается глицерин, получил в технике название глицеринового или альдегидо-глицеринового брожения. Суммарное уравнение глицериновой формы брожения следующее:
Альдегидо-глицериновое брожение имеет исключительно важное техническое значение, так как лежит в основе получения глицерина из сахара при помощи дрожжей. Метод получения глицерина путем изменения хода спиртового брожения был разработан Нейбергом. Техническое оформление метод получил в Германии в 1915 г., во время первой мировой войны, когда потребление глицерина возросло (для производства взрывчатых веществ), а ресурсы жиров истощились.
Метод, предложенный Нейбергом, заключается в том, что в сбраживаемую среду вводится сульфит натрия. Эта соль связывает уксусный альдегид в альдегид-сернистый натрий, предупреждая его восстановление до этилового спирта, но зато способствует образованию глицерина. Вывести ацетальдегид из сферы реакции можно также с помощью бисульфитных солей кальция и натрия, а также активированного угля. Если в среды добавлять углекислые или борнокислые соли натрия или калия (это повышает pH среды, делая ее щелочной), то можно заставить дрожжи образовывать при брожении, кроме этилового спирта, глицерин и уксусную кислоту:
Альдегидо-глицериновое брожение можно осуществить на различных питательных субстратах, содержащих 10-15% сахара, добавляя от 4 до 20% сульфита. Вводят сульфит обычно порциями по мере его использования в процессе. При этом удается получить выходы глицерина, достигающие 21-37% от количества сброженного сахара.
Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать

Глицерин
Глицерин (пропантриол-1,2,3). Наиболее важным из трехатомных спиртов является простейший, называемый просто глицерином; он имеет строение СН2ОН—СНОН—СН2ОН. Глицерин был открыт в 1779 г. Шееле; его состав был установлен Пелузом в 1836 г., а для уяснения его строения богатые данные дали работы Бертело (1854) и Вюрца (1855—1857). В свободном состоянии глицерин в небольших количествах содержится в крови животных.
Как уже было указано, природные жиры и масла состоят из сложных эфиров глицерина и высших жирных предельных и непредельных кислот, из которых главнейшими являются пальмитиновая C15H31COOH, стеариновая C17H35COOH и олеиновая C17H33COOH. Омыление жиров производится обычно под действием различных катализаторов (кислот, щелочей, энзимов), причем жиры расщепляются на глицерин и жирные кислоты, например:
Полный синтез глицерина был произведен Фриделем (1873) следующим путем. Восстановлением ацетона был получен изопропиловый спирт СН3—СНОН—СН3, при отнятии воды дающий пропилен СН3—СН=СН2, который, присоединяя хлор, превращается в хлористый пропилен СН3—СНСl—СН2Сl; при действии на него хлора получается трихлорпропан (трихлоргидрин глицерина) СН2Сl—СНСl—СН2Сl, при нагревании с водой дающий глицерин:
Глицерин может быть получен также осторожным окислением аллилового спирта перманганатом в щелочной среде (Е. Е. Вагнер):
Глицерин образуется в небольшом количестве при спиртовом брожении; в особых условиях он может быть получен путем брожения и в промышленном масштабе.
В настоящее время осуществлено промышленное производство синтетического глицерина из непищевого сырья (на основе пропилена, выделяемого из газов нефтепереработки).
Синтез глицерина из пропилена включает следующие стадии:
Возможен и другой, более короткий путь — присоединение элементов хлорноватистой кислоты к хлористому аллилу
и последующее омыление дихлоргидринов глицерина:
Третий способ, основанный на окислении пропилена, состоит из следующих стадий:
2. Присоединение перекиси водорода к акролеину в присутствии четырехокиси осмия:
Глицерин — сиропообразная бесцветная жидкость сладкого вкуса; смешивается с водой и спиртом, нерастворим в эфире и хлороформе; способен растворять многие органические, а также и неорганические соединения (многие соли, например гипс). Он может быть получен в виде кристаллов, плавящихся при 17° С. Получение глицерина в кристаллическом виде представляет, однако, значительную трудность вследствие его большой склонности к переохлаждению и медленной кристаллизации. Глицерин кипит со слабым разложением при 290° С; относительная плотность d4 20 =1,260.
Химические свойства глицерина определяются наличием в его молекуле трех гидроксильных групп, благодаря чему он может давать три ряда производных, причем моно- и дипроизводные могут существовать в двух структурно-изомерных формах. Монопроизводные глицерина типа СН2Х—СНОН—СН2ОН и дипроизводные СН2Х—СНХ—СН2ОН содержат асимметрический атом углерода, и потому для них возможна оптическая изомерия.
Глицерин дает три ряда металлических производных — глицератов, которые могут получаться даже при действии на глицерин окислов тяжелых металлов, например окиси меди. Это свидетельствует о том, что кислотные свойства у глицерина выражены значительно сильнее, чем у одноатомных спиртов.
Действием галоидоводородных кислот или галоидных соединений фосфора можно получить ряд галоидгидринов глицерина, например монохлоргидрины
и, наконец, трихлорпропан:
При действии иода и фосфора на безводный глицерин получается иодистый аллил, который, вероятно, образуется в результате отщепления иода от непрочного трииодпропана:
Действием иода и фосфора на водный глицерин получается иодистый изопропил. Возможно, что он образуется при неполном восстановлении трииодпропана иодистым водородом:
При недостаточном содержании иодистого водорода в реакционной смеси в качестве побочного продукта получается пропилен СН3—СН=СН2.
Можно предполагать образование также следующих продуктов:
При действии кислот, хлорангидридов или ангидридов на глицерин могут получиться три ряда сложных эфиров.
Сложные эфиры глицерина с органическими одноосновными кислотами получают названия по входящим в их состав кислотам: эфиры пальмитиновой кислоты называются пальмитинами, стеариновой — стеаринами, олеиновой — олеинами и т. д. Три ряда сложных эфиров обозначают, пользуясь приставками моно-, ди- и три-, например:
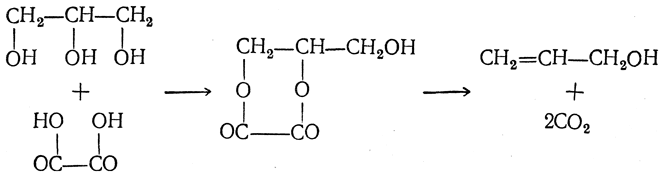
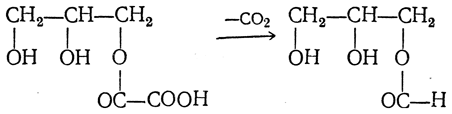
При действии на глицерин безводной щавелевой кислоты НООС—СООН можно получить аллиловый спирт. Если безводную щавелевую кислоту нагревать с избытком глицерина до 150° С, то сначала образуется двузамещенный щавелевоглицериновый эфир, который при дальнейшем нагревании распадается на углекислоту и аллиловый спирт:
Под действием новой порции щавелевой кислоты в результате омыления получается муравьиная кислота, которая при нагревании отгоняется, а глицерин и щавелевая кислота снова вступают в реакцию и т. д. Таким образом с помощью небольшого количества глицерина можно превратить в муравьиную кислоту неограниченное количество щавелевой кислоты.
При действии водоотнимающих средств (KHSO4, H3BO3, безводный MgSO4) из глицерина получается акролеин.
При действии более слабых водоотнимающих средств могут образоваться полиглицериновые алкоголи, например
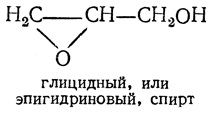
Из производных глицерина, содержащих окисное кольцо, наибольший интерес представляют соединения типа
Глицидный спирт (глицидол) — бесцветная, слабо пахнущая жидкость, смешивающаяся с водой, спиртом и эфиром; т. кип. 180° С. Подобно окиси этилена, он может быть получен действием едкого кали на монохлоргидрин глицерина. Аналогичное ему хлорпроизводное — эпихлоргидрин может быть получено действием едкого кали на дихлоргидрины, например:
Эпихлоргидрин — нерастворимая в воде жидкость с т. кип. 118° С. В настоящее время он приобрел важное значение как исходный полупродукт для получения эпоксидных смол. Эти полимеры получаются поликонденсацией эпихлоргидрина с ароматическими диоксисоединениями, чаще всего с бис-фенолами.
Глицерин находит значительное практическое применение. В больших количествах он расходуется для изготовления полиэфирных, так называемых алкидных смол, в частности глифталевых, широко применяемых в лакокрасочной промышленности. Он употребляется также для подслащивания ликеров и других напитков, для предохранения материалов от высыхания (на этом основано применение его в текстильной промышленности для аппретуры и шлихтования), как средство смягчения кожи и составная часть различных косметических препаратов. Значительные количества глицерина идут на приготовление нитроглицерина.
получающийся при осторожном смешении глицерина с охлажденной смесью концентрированных серной и азотной кислот. Нитроглицерин — маслообразная, тяжелая (относительная плотность 1,601 при 15° С) жидкость, нерастворимая в воде, легкорастворимая в спирте, смешивающаяся с эфиром, хлороформом и бензолом. При охлаждении он кристаллизуется (две полиморфные модификации: неустойчивая с т. пл. 2,2° С и устойчивая с т. пл. 12,2°С). Пары нитроглицерина довольно ядовиты.
Нитроглицерин — чрезвычайно взрывчатое вещество. Он взрывает, особенно в твердом состоянии, с исключительной силой, иногда от простого прикосновения. Растворы его не взрывают. Жидкий нитроглицерин вследствие слишком легкой взрываемости не применяется для подрывных работ. Сравнительно безопасна в обращении смесь 75% нитроглицерина с 25% инфузорной земли (трепела), называемая динамитом. Динамит «бризантен», т. е. разложение его носит характер мгновенного взрыва; поэтому динамит не может быть использован для стрельбы из огнестрельного оружия, а применяется лишь для подрывных работ. Так как в твердом состоянии тринитрат глицерина весьма чувствителен к механическим воздействиям, температуру замерзания динамитов понижают, применяя различные добавки, например добавляют к нитроглицерину динитрат гликоля.
Нитроглицерин в смеси с нитратом целлюлозы образует желатинообразную массу («взрывчатый желатин», или «гремучий студень»), которая горит сравнительно медленно и применяется для изготовления бездымных порохов.
Видео:8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎬 ВидеоХИМИЧЕСКИЙ ОПЫТ - Глицерин и МарганцовкаСкачать  10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать  7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать  8.2. Многоатомные спирты (этиленгликоль, глицерин): Способы получения. ЕГЭ по химииСкачать  Удивительные свойства глицеринаСкачать  Тесты по химии. Глицерин и глюкоза. А36 РТ 15 16 этап 2Скачать  Реакция глицерина с перманганатом калияСкачать  Взаимодействие глицерина с гидроксидом меди(II). | Лабораторный опыт № 3.Скачать  Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать  Качественные реакции на глицерин, глюкозу и сахарозуСкачать  МАРГАНЦОВКА И ГЛИЦЕРИН - химические опытыСкачать  НИТРОГЛИЦЕРИН - что это такое? значение и описаниеСкачать  Глицерол, получение АТФСкачать  АльдегидыСкачать  Химия, 11-й класс, Этиленгликоль, глицеринСкачать  Качественная реакция на альдегиды с гидроксидом медиСкачать  90. Что такое глицеринСкачать  Опыты по химии. Омыление жировСкачать  |