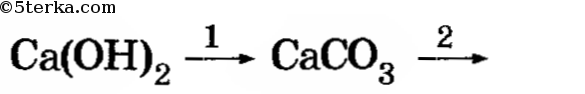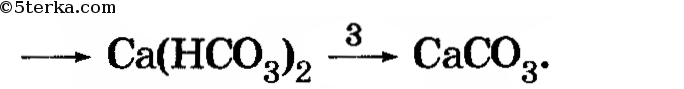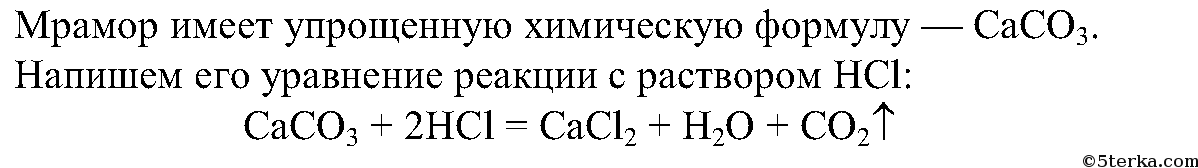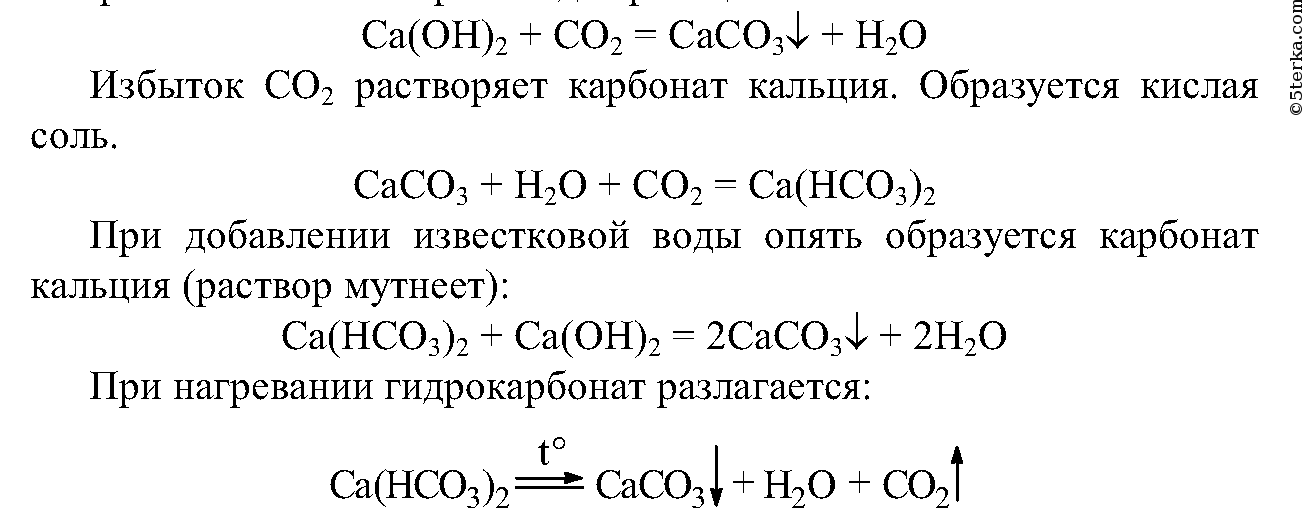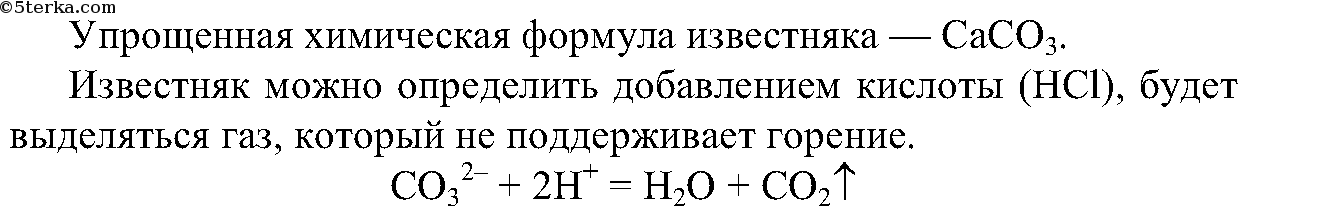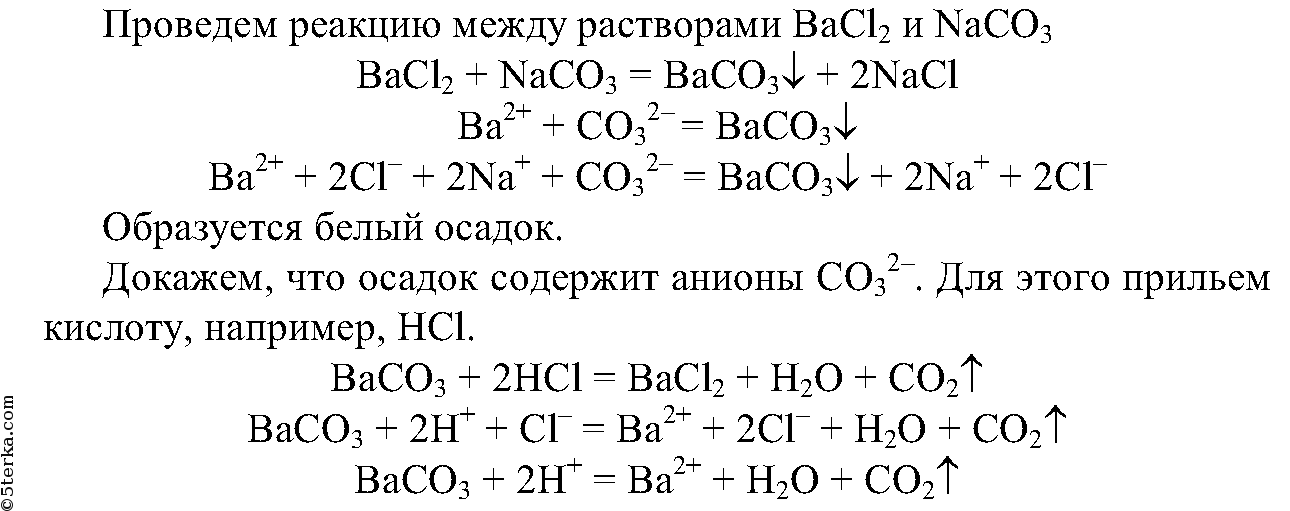- Получение оксида углерода (IV) и изучение его свойств.
- Распознавание карбонатов.
- Получение оксида углерода (IV) и изучение его свойств.
- Распознавание карбонатов.
- Практическое занятие № 5. Получение СО2 и изучение его свойств. Распознавание карбонатов
- Получите углекислый газ с помощью аппарата, заряженного мелом или мрамором и соляной ккислотой?
- Напишите сокращенное ионно — молекулярное уравнение реакции?
- Получите CO2(углекислый газ) воздействием мрамора и соляной кислоты?
- Напишите молекулярные, полные и сокращение ионны уравнения реакций между растворами нитрата свинца(ll) и соляной кислоты?
- Напишите пожалуйста молекулярное и ионное уравнения получения реакций обмена углекислого газа?
- Уравнение реакции по получению углекислого газа, путём помещения в пробирку с кусочками мрамора или мела соляной кислоты?
- Напишите уравнение реакций электролитической диссоциации соляной кислоты и сокращенное ионно — молекулярное уравнение реакции нейтрализации?
- Напишите в молекулярном, ионном и сокращенном ионном виде уравнения реакций, с помощью которых можно различить соляную, серную и азотную кислоты?
- Что происходит, если на мел или мрамор подействуете соляной кислотой?
- Напишите уравнение электролитической диссоциации соляной кислоты и сокращенное ионно — молекулярное уравнение реакции нейтрализации?
- Получить углекислый газ при реакции мела с соляной кислотой?
- 🌟 Видео
Видео:Качественная реакция на углекислый газ.Скачать

Получение оксида углерода (IV) и изучение его свойств.
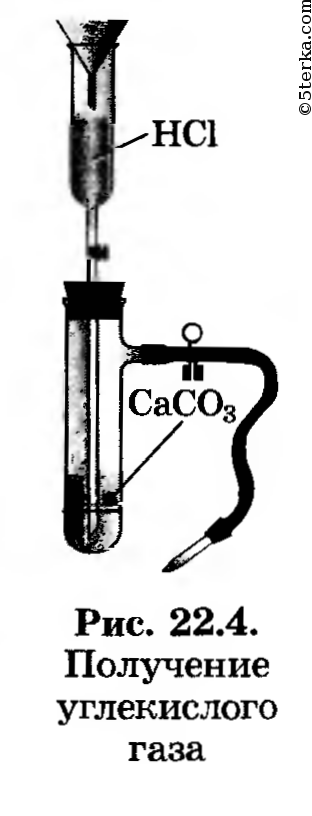
1) Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Пробирку быстро за кройте пробкой с газоотводной трубкой. Коней трубки поместите в другую пробирку, в которой находится 2-3 мл известковой воды. Несколько минут пропускайте выделяющийся газ через известковую воду.
Что происходит, если на мел (мрамор) действуют соляной кислотой?
Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется?
2) Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Поместите трубку в пробирку с 2-3 мл дистиллированной воды и пропустите через неё выделяющийся газ. Через не сколько минут выньте трубку из раствора и добавьте к нему несколько капель синего лакмуса. Что наблюдаете?
3) В пробирку налейте 2-3 мл разбавленного раствора гидроксида натрия, добавьте к нему несколько капель фенолфталеина и затем через раствор пропустите выделяющийся газ. Что наблюдаете?
Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
Видео:Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать

Распознавание карбонатов.
В трёх пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите, какое вещество находится в каждой пробирке.
Сделайте вывод, что является качественной реакцией на карбонат-ионы. Напишите соответствующее уравнение реакции.
Видео:Качественная реакция на углекислый газСкачать

Получение оксида углерода (IV) и изучение его свойств.
При взаимодействии мела с соляной кислотой наблюдается выделение газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H + + 2Cl — ⟶ Ca 2+ + 2Cl — + H2O + CO2↑
CaCO3 + 2H + ⟶ Ca 2+ + H2O + CO2↑
При пропускании выделяющегося газа через известковую воду, наблюдается помутнение раствора:
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2O
Ca 2+ + 2OH — + CO2 ⟶ CaCO3↓ + H2O
При дальнейшем пропускании выделяющегося газа мутный раствор становится прозрачным. Это связано с тем, что нерастворимый карбонат кальция, при взаимодействии с углекислым газом, превращается в растворимый гидрокарбонат кальция:
CaCO3 + H2O + CO2 ⟶ Ca(HCO3)2
CaCO3 + H2O + CO2 ⟶ Ca 2+ + 2HCO3 —
При добавлении лакмуса в дистиллированную воду, через которую пропускали углекислый газ, наблюдается окрашивание в красный цвет. Это объясняется тем, что углекислый газ реагирует с водой с образованием слабой угольной кислоты:
H2O + CO2 ⇄ H2CO3
При добавлении фенолфталеина раствор гидроксида натрия, наблюдается окрашивание раствора в малиновый цвет. При пропускании углекислого газа через этот раствор, происходит его обесцвечивание. Это связано с тем, что гидроксид натрия вступает в реакцию с углекислым газом:
2NaOH + CO2 ⟶ Na2CO3 + H2O
2Na + + 2OH — + CO2 ⟶ 2Na + + CO3 2- + H2O
2OH — + CO2 ⟶ CO3 2- + H2O
Видео:Задачи на примеси. 1 часть. 9 класс.Скачать

Распознавание карбонатов.
В начале добавить соляной кислоты, в пробирке с карбонатом калия выделится газ: K2CO3 + 2HCl ⟶ 2KCl + H2O + CO2↑
В оставшиеся две пробирки добавить хлорид бария, в пробирке с сульфатом натрия образуется осадок белого цвета: Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
В последнюю пробирку добавить гидроксид натрия, если там находится хлорид цинка, то выпадет белый осадок:
ZnCl2 + 2NaOH ⟶ 2NaCl + Zn(OH)2↓
Качественной реакцией на карбонат-ионы, является взаимодействие с кислотой, в результате реакции образовывается углекислый газ.
Видео:9 класс Химия Практическая работа Получение углекислого газа и изучение его свойств.Скачать

Практическое занятие № 5. Получение СО2 и изучение его свойств. Распознавание карбонатов
Задания. 1. Получите углекислый газ взаимодействием мрамора с соляной кислотой.
2. Изучите некоторые физические свойства диоксида углерода (IV) (цвет, запах, растворимость в воде, относительную плотность).
3. а) Изучите взаимодействие углекислого газа с водой;б) осуществите следующие превращения;
4. Распознайте известняк среди выданных образцов минералов.
5. Получите карбонат бария с помощью реакции обмена.
Оборудование. Прибор для получения газов, заправленный кусочками мрамора и соляной кислотой, лабораторный штатив, штатив с пробирками, пипетки, стаканы на 150 мл (2 шт.), картонный кружок для стакана, пробиркодержатели (2 шт.), нагревательный прибор.
Вещества. 10%-е растворы карбоната натрия и хлорида бария, 10%-я соляная кислота, известковая вода, раствор лакмуса, дистиллированная вода, минералы гипс, каолин, известняк, кварц.
1. Получение оксида углерода (IV). Зарядите прибор для получения углекислого газа (рис. 22.4). Получите углекислый газ, соберите его в химический стакан и прикройте картонным кружком. (Для чего?)
2. Изучение свойств оксида углерода (IV). Внесите в стакан горящую спичку. Что наблюдаете? «Перелейте» содержимое в другой стакан. Убедитесь с помощью горящей спички, что углекислый газ действительно «перелился» из одного стакана в другой.
Какое свойство углекислого газа лежит в основе этого опыта? Опишите физические свойства исследуемого газа.
Налейте в пробирку (на 1 /4 ее объема) дистиллированную воду, подкрасьте ее фиолетовым раст
вором лакмуса и пропускайте через эту воду углекислый газ до изменения окраски индикатора. Почему изменилась окраска лакмуса? Составьте уравнение соответствующей реакции. Нагрейте содержимое пробирки до начала кипения. Почему снова изменился цвет лакмуса? Объясните это с помощью уравнения реакции.
3. Прилейте в пробирку (на 1/4 ее объема) известковую воду и пропускайте через нее углекислый газ. Что вы наблюдаете? Где используется в практике эта реакция? Продолжайте пропускать углекислый газ через мутную смесь до полного осветления раствора. Что произошло? Составьте уравнения наблюдаемых реакций.
Содержимое пробирки с полученным гидрокарбонатом кальция разделите на две равные части. В одну пробирку добавьте известковую воду, а другую нагрейте до начала кипения раствора. Что вы наблюдаете? Объясните происходящее явление с помощью уравнений реакций. Сделайте выводы: а) каким образом карбонаты можно превратить в гидрокарбонаты;б) как можно гидрокарбонаты превратить в карбонаты.
4. Из выданных вам минералов с помощью химических реакций определите известняк. Составьте ионные уравнения проделанной реакции.
5. Получите реакцией обмена карбонат бария. Опытным путем докажите, что выпавший осадок действительно является карбонатом. Составьте полные и сокращенные ионные уравнения проделанных реакций.
Картонным кружком стакан прикрывают для того, чтобы не улетучивался углекислый газ.
При внесении в стакан с углекислым газом спичка тухнет, т.к. углекислый газ не поддерживает горения. Углекислый газ можно переливать из одного стакан в другой, т.к. он тяжелее воздуха и оседает на дне.
Наблюдается помутнение раствора, на практике это используется при побелке стен. Происходит реакция:
а) карбонаты можно перевести в гидрокарбонаты, пропуская через них углекислый газ;
б) гидрокарбонаты можно перевести в карбонаты нагреванием или добавлением известковой воды.
Выделяется газ, который не поддерживает горение.

задача №5
к главе «Практические занятия».
Видео:Углекислый газ для теплиц с помощью газогенераторовСкачать

Получите углекислый газ с помощью аппарата, заряженного мелом или мрамором и соляной ккислотой?
Химия | 5 — 9 классы
Получите углекислый газ с помощью аппарата, заряженного мелом или мрамором и соляной ккислотой.
Напишите сокращенное ионно — молекулярное уравнение реакции.
CaCO3 + 2HCl = CaCl2 + CO2 + H2OCaCO3 + 2H( + ) + 2CL( — ) = Ca( + 2) + 2Cl( — ) + CO2 + H2OCaCO3 + 2H( + ) = Ca( + 2) + CO2 + H2O.
Видео:Получение углекислого газа и изучение его свойствСкачать

Напишите сокращенное ионно — молекулярное уравнение реакции?
Напишите сокращенное ионно — молекулярное уравнение реакции.
Видео:Практическая работа №5. Получение углекислого газа, качественная реакция на карбонат ионыСкачать

Получите CO2(углекислый газ) воздействием мрамора и соляной кислоты?
Получите CO2(углекислый газ) воздействием мрамора и соляной кислоты?
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Напишите молекулярные, полные и сокращение ионны уравнения реакций между растворами нитрата свинца(ll) и соляной кислоты?
Напишите молекулярные, полные и сокращение ионны уравнения реакций между растворами нитрата свинца(ll) и соляной кислоты.
Видео:Получение углекислого газа и тест на его обнаружениеСкачать

Напишите пожалуйста молекулярное и ионное уравнения получения реакций обмена углекислого газа?
Напишите пожалуйста молекулярное и ионное уравнения получения реакций обмена углекислого газа.
Видео:Химия 7 класс. Выделение углекислого газа из мела и уксуса.Эксперемент с мелом и уксусом #1Скачать

Уравнение реакции по получению углекислого газа, путём помещения в пробирку с кусочками мрамора или мела соляной кислоты?
Уравнение реакции по получению углекислого газа, путём помещения в пробирку с кусочками мрамора или мела соляной кислоты.
Видео:Угарный и углекислый газ. Это знать обязательно.Скачать

Напишите уравнение реакций электролитической диссоциации соляной кислоты и сокращенное ионно — молекулярное уравнение реакции нейтрализации?
Напишите уравнение реакций электролитической диссоциации соляной кислоты и сокращенное ионно — молекулярное уравнение реакции нейтрализации.
Видео:Взаимодействие углекислого газа с известковой водой (CO2 + Ca(OH)2 = CaCO3 + H2O)Скачать

Напишите в молекулярном, ионном и сокращенном ионном виде уравнения реакций, с помощью которых можно различить соляную, серную и азотную кислоты?
Напишите в молекулярном, ионном и сокращенном ионном виде уравнения реакций, с помощью которых можно различить соляную, серную и азотную кислоты.
Видео:Получение углекислого газа дома.Скачать

Что происходит, если на мел или мрамор подействуете соляной кислотой?
Что происходит, если на мел или мрамор подействуете соляной кислотой?
Почему при пропускании газа через раствор известковой воды, сначала происходит помутнение, а затем известь растворяется?
Что происходит при пропускании оксида углерода (4)через дистиллированную воду?
Напишите уравнение соответствующих реакций в молекулярном, ионном и сокращенном виде.
Ответьте на вопросы.
Видео:Оксид углерода(IV). Углекислый газ. Состав и строение молекулы. Получение. Свойства и применениеСкачать

Напишите уравнение электролитической диссоциации соляной кислоты и сокращенное ионно — молекулярное уравнение реакции нейтрализации?
Напишите уравнение электролитической диссоциации соляной кислоты и сокращенное ионно — молекулярное уравнение реакции нейтрализации.
Видео:4 способа получения углекислого газа БЕЗ СЖИГАНИЯ чего-либо!!!Скачать

Получить углекислый газ при реакции мела с соляной кислотой?
Получить углекислый газ при реакции мела с соляной кислотой.
Вы зашли на страницу вопроса Получите углекислый газ с помощью аппарата, заряженного мелом или мрамором и соляной ккислотой?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 5 — 9 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
3 металлические свойства усиливаются сверху вниз и справа налево.
Са(NO3)2 + Na2CO3 = 2NaNo3 + CaCO3 Ca + 2NO3 + 2Na + CO3 = 2Na + 2NO3 + CaCO3 Ca + CO3 = CaCO3.
Ca(NO3)2 + Na2CO3 — > CaCO3 + 2NaNO3 Ca( + 2) + 2NO3( — ) + 2Na( + ) + CO3( — 2) — > CaCO3 + 2Na( + ) + 2NO3( — ) Ca( + 2) + CO3( — 2) — > CaCO3.
2Al + 3H2SO4 = Al2(SO4)3 + 3H2 n(Al) = 4. 5 г / 27г / моль = 0. 17 моль 2n(Al) = 3n(H2) = 0. 11 моль m(H2) = 0. 11 моль * 2 г / моль = 0. 22 г.
1)ионная 2)ковалентно — полярная 3)неполярная.
1) Капли дождя падали и летели на землю . 2) Капли дождя падали и получались большии лужи .
2Mg + O2 — > 2MgO MgO + 2HCl — > MgCl2 + H2O MgCl2 + 2NaOH — > Mg(OH)2 + 2NaCl Mg( + 2) + 2Cl( — ) + 2Na( + ) + 2OH( — ) — > Mg(OH)2 + 2Na( + ) + 2Cl( — ) Mg( + 2) + 2OH( — ) — > Mg(OH)2 2Ba + O2 — > 2BaO BaO + H2O — > Ba(OH)2 Ba(OH)2 + 2HNO3 — > Ba(..
🌟 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение, собирание и распознавание углекислого газаСкачать

Как определить газ легче или тяжелее воздуха #химия #химияскатей #химияегэ #химияогэ #огэхимияСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать