4.4.1. Построение кривой окислительно-восстановительного титрования
Построение кривой титрования дает возможность оценить, насколько успешным будет титрование, и позволяет выбрать индикатор. При построении кривой окислительно – восстановительного титрования по оси ординат откладывают потенциал системы, а по оси абсцисс – объем титранта или степень оттировывания.
Рассмотрим в качестве примера титрование 100 мл 0,1 н. раствора FeSO 4 0,1 н. раствором KMnO 4 в кислой среде ( [ H + ] = 1 моль/л):
5Fe 2+ + MnO4 — + 8H + = 5Fe 3+ + Mn 2+ + 4H2O.
Запишем уравнения полуреакций для данной окислительно-восстановительной реакции и найдем для них стандартные потенциалы в табл. 5 Приложения:
MnO4 — + 8H + + 5e → Mn 2+ + 4H2O, E o = 1,51 В;
Fe 2+ — 2e → Fe 3+ , E o = 0,77 В.
lg К = (1,51-0,77)∙5 / 0,059 = 62 и К = 10 62 .
Очень большое численное значение К показывает, что равновесие реакции, протекающей при титровании, практически целиком сдвинуто вправо. При расчете кривых окислительно-восстановительного титрования обычно не приводят значение потенциала для точки, соответствующей моменту, когда в исследуемый раствор еще не добавлен титрант.
После добавления первых же капель перманганата калия в растворе образуются две окислительно-восстановительные пары: MnO 4 — / Mn 2+ и Fe 3+ / Fe 2+ , потенциал каждой из которых можно вычислить по уравнению Нернста:
При расчете по любому из этих уравнений получится одно и то же значение потенциала, поскольку в каждый момент титрования система находится в равновесии. Однако из соображений простоты расчета до точки эквивалентности потенциал следует рассчитывать по второму из них, а после точки эквивалентности – по первому. Количество вещества Fe 3+ до точки эквивалентности будет равно количеству вещества эквивалента добавленного KMnO 4, поскольку высокое численное значение константы равновесия говорит о практически полном сдвиге равновесия вправо.
В уравнение Нернста входит соотношение концентраций окисленной и восстановленной форм, поэтому при [Н + ] = 1 моль/л изменение объема не влияет на результаты расчета. Следовательно, при построении кривой титрования можно условно считать, что объем титруемого раствора не изменяется и остается равным 100 мл.
Если к 100,0 мл 0,1 н. FeSO 4 добавить 1,0 мл 0,1 н. KMnO 4 ( f экв= 1/5), то в результате реакции образуется эквивалентное количество вещества Fe 3+ , концентрация которого в растворе будет равна [ Fe 3+ ] = 0,1∙1,0/100,0=1,0∙10 -3 моль-экв/л, а концентрация ионов Fe 2+ составит 0,099 моль-экв/л. Окислительно-восстановительный потенциал раствора составит:
Е = 0,77 + 0,059 lg (1,0∙10 -3 /0,099)= 0,65 В.
Остальная часть кривой титрования до точки эквивалентности рассчитывается аналогично; результаты приведены в таблице 4.1.
Потенциал в точке эквивалентности можно рассчитать по уравнению:
где Е1 ° и Е2 ° — стандартные потенциалы окислительно-восстановительных пар, участвующих в данной реакции;
Таблица 4.1 – Изменение Е при добавлении 0,1 н. KMnO 4 ( f экв= 1/5) к 100 мл 0,1 н. FeSO 4 при [Н + ] = 1 моль/л
- Как провести фотометрическое титрование железа (II) дихроматом калия? При каких условиях (λ, рН) следует выполнять это титрование?
- Описание и исходные данные задания, 50% решения + фотография:
- Хроматометрия: сущность метода, общая характеристика, достоинства и недостатки. Применения хроматометрии для определения железа в рудах и сплавах
- 🎦 Видео
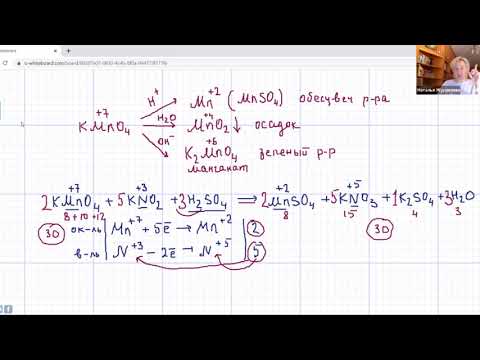
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Как провести фотометрическое титрование железа (II) дихроматом калия? При каких условиях (λ, рН) следует выполнять это титрование?






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Как провести фотометрическое титрование железа (II) дихроматом калия? При каких условиях (λ, рН) следует выполнять это титрование? Написать уравнения реакций, привести общий вид кривой титрования. обозначить точку эквивалентности и дать уравнение для расчета массы железа в пробе.
Решение :
Метод фотометрического (спектрофотометрического) титрования основан на последовательном измерении светопоглощения А (оптической плотности D ) раствора в процессе титрования при заранее заданной длине волны излучения.
Количественное определение основано на реакции окисления ионов железа дихроматом калия в кислой среде, определение оптической плотности проводят при λ=380 нм.
| Если вам нужно решить химию, тогда нажмите ➔ заказать химию. |
| Похожие готовые решения: |
- В чем сущность высокочастотного титровании? Каковы особенности измерительной аппаратуры высокочастотного титрования: Z-, Q- и Р- метров?
- Для нефелометрического определения серы в каменном угле использовали в качестве стандартного 0,0100 М раствор H2SO4.
- В две мерные колбы на 100,0 мл поместили по 20 мл сточной воды. В одну колбу добавили 10,0 мл стандартного раствора CuSO4 (ТCu — 0.0010000)
- При титровании 50,0 мл HCl 2,00 М раствором КОН были получены результаты: V КОН, мл 3,2 6,0 9,2 15,6 20,0 23,5 Χ, См/м 3,2 2,56 1,86 1,64 2,38 2,96 Определить концентрацию HCl, г/л
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Занятие 5. Стандартизация тиосульфата натрия по дихромату калия.Скачать

Хроматометрия: сущность метода, общая характеристика, достоинства и недостатки. Применения хроматометрии для определения железа в рудах и сплавах
Хроматометрия − метод окислительно-восстановительного титрования, основанный на реакциях окисления восстановителей дихроматом калия K2Cr2O7, или (реже) хроматом калия K2CrO4. По основному реактиву этот метод иногда называют дихроматометрией.
Обычно титрование проводят в кислой среде, дихромат при этом восстанавливается по уравнению:
Из уравнения (2.6) следует, что

Стандартный окислительно-восстановительный потенциал этой системы (при [Н + ] = 1 моль/л) E 0 (Cr2O7 2− /2Cr 3+ ) = 1,36 В, т.е. дихромат калия является
довольно сильным окислителем.
В хроматометрии используют прямое, обратное титрование и метод замещения.
Дихромат калия способен окислять многие неорганические и органические вещества: Fe(II), Mn(III), Mn(IV), V(IV), Mo(V), Te(IV), Ti(III), сульфиты, дитионаты, гексацианоферрат (II),арсенит, йодид, спирты, гидрохинон, глицерин, аскорбиновую кислоту и др.
Дихромат калия используется и для определения окислителей (U(VI), V(V), Mo(VI), Fe(III), Co(III), NO3 − , ClO3 − , H2O2 и др.). Метод основан на предварительном восстановлении окислителей до соединений низшей степени окисления (например, в редукторе Джонса) и последующем титровании полученных восстановленных форм стандартным раствором дихромата калия; или окислители восстанавливают стандартным раствором восстановителя (чаще всего ионами Fe 2+ , например, раствором соли Мора – FeSO4∙(NH4)2SO4×6H2O) с последующим титрованием избытка восстановителя дихроматом.
Например, для определения нитратов к анализируемому раствору прибавляют избыток соли железа (II) и полученную смесь кипятят. При этом протекает окислительно-восстановительная реакция:
nFe 2+ + NO3 − + 4H + 
Затем избыток ионов железа (II) оттитровывают дихроматом:
6(n−3)Fe 2+ + (n−3)Cr2O7 2− + 14(n−3)Н + → 6(n−3)Fe 3+ + 2(n−3)Cr 3+ + 7(n−3) H2O
По сравнению с другими методами окислительно-восстановительного титрования, и в частности по сравнению с методом перманганатометрии метод хроматометрии имеет следующие достоинства:
1. Перекристаллизацией из водного раствора с последующим высушиванием при 200 0 С легко получить химически чистый дихромат калия строго соответствующий формуле K2Cr2O7. Поэтому стандартный раствор дихромата калия готовят по точной его навеске. Полученный раствор можно использовать как для титрования, так и для стандартизации растворов других веществ.
2. Растворы дихромата калия очень устойчивы. K2Cr2O7 не разлагается даже при кипячении в подкисленном растворе, поэтому титр раствора K2Cr2O7 не изменяется в течение длительного времени.
3. Титрование дихроматом калия можно проводить в солянокислой среде. При этом на холоду ионы Cl − не окисляются, т.к. E 0 (Cl2 /2Cl − ) = 1,358 В, т.е. практически равен потенциалу дихромата (1,36 В). Однако, при концентрации HCl более 2 н. или при кипячении дихромат калия окисляет ионы Cl − до свободного хлора.
4. Дихромат труднее, чем перманганат восстанавливается органическими веществами, попадающими в дистиллированную воду.
К недостаткам метода относятся:
1. Дихромат калия менее сильный окислитель, чем перманганат, и поэтому он используется относительно меньше.
2. Окислительно-восстановительные реакции с участием дихромата протекают относительно медленно. Скорость реакции заметно повышается в сильно кислых средах, т.к. окислительно-восстановительный потенциал системы возрастает по мере увеличения концентрации ионов водорода (см. уравнение 1.3). Однако иногда прямое титрование оказывается неосуществимо, и в методе хроматометрии часто используют обратное титрование.
3. В процессе титрования дихроматом образуются ионы Cr 3+ , придающие раствору зеленую окраску. Сам дихромат окрашен в оранжевый цвет, и в конечной точке титрования одна лишняя капля дихромата вызовет изменение окраски из зеленой в желто-зеленую. Однако такой переход виден не очень отчетливо, поэтому конечную точку титрования устанавливают с помощью индикаторов, в качестве которых используют дифениламин, дифениламинсульфокислоту, фенилантраниловую кислоту, или инструментальными методами (потенциометрический, кондуктометрический, амперометрический и др.).
Методом хроматометрии можно определять почти те же вещества, что и методом перманганатометрии. Наиболее широко хроматометрия используется для определения урана, который предварительно переводят в U(IV), и особенно ― содержания железа в рудах и сплавах. Образцы растворяют в серной или соляной кислотах, при этом железо получается в виде ионов Fe 2+ и Fe 3+ . Последние восстанавливают хлоридом олова SnCl2 или металлическим цинком и титруют дихроматом калия в присутствии дифениламина по уравнению:
В процессе титрования происходит окисление дифениламином
Е 0 =0,76 В рТ=0,76±0,03В
Скачек титрования 0,944-1,302В
Т.е дифенил амин должен изменять окраску за долю до скачка титрования. Что бы этого избежать титрование ведут в присутствие Н3PO4 который связывает ионы Fe 3+ в прочный комплекс.
В результате получается концентрация свободных ионов Fe 3+ что приводит к снижению о/в потенциала скачек титрования смещается в область более низких потенциалов в соответствующий интервал перехода дифениламина.
Хроматометрическое определение органических веществ применения не получило в связи с неполнотой протекания многих реакций и появлением побочных продуктов (СО наряду с СО2 и др.), количество которых контролировать не удавалось. Однако ряд веществ (метанол, глицерин и некоторые другие) легко окисляется дихроматом до СО2 и H2O, и их хроматометрическое определение имеет практическое значение.
🎦 Видео
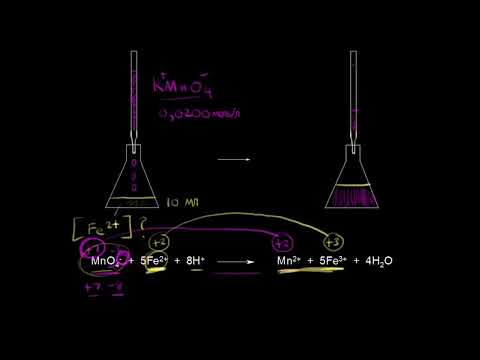
Окислительно-восстановительное титрование: перманганатометрия.Скачать

ОВР с перманганатом калия.Скачать
Шеховцова Т.Н. - Аналитическая химия - Окислительно-восстановительное титрование. Скорость реакцийСкачать

Химия | Схемы ОВР для перманганат и дихромат ионовСкачать

Окислительно-восстановительное титрование (видео 17) | Титриметрический анализ | ХимияСкачать
Из хромата калия K2CrO4 в дихромат калия K2Cr2O7 и обратно - цветные переходы соединений хромаСкачать

Определение концентрации вещества в растворе методом титриметрииСкачать

Равновесие в растворе роданида железаСкачать

Кузьмич Е.С. Окислительно восстановительное титрование.Скачать

Взаимодействие хлорида железа III с роданидом калияСкачать

Кузьмич Е.С.Приготовление рабочего раствора бихромата калия Бихроматометрическое определение желез.Скачать

Окислительно-восстановительное титрование: броматометрия, иодатометрия.Скачать

Окислительно восстановительное титрованиеСкачать

Цветные химические опыты с дихроматом калия.Скачать

Стандартизация раствора натрия тиосульфата по калия дихроматуСкачать

Перманганатометрическое титрованиеСкачать

Титрование 👌🏼Скачать

Взаимодействие тиосульфата натрия с перманганатом калияСкачать






