Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
- Что такое теплообмен и при каких условиях он происходит
- Уравнение теплового баланса и сохранение тепловой энергии
- Уравнение теплового баланса
- Если несколько тел участвуют в процессе теплообмена
- Пример расчетов для теплообмена между холодным и горячим телом
- Задача для самостоятельного решения:
- Решение задач на теплообмен с использованием уравнения теплового баланса (методические рекомендации)
- Плавление или кристаллизация
- Кипение или конденсация
- Фазовые переходы и уравнение теплового баланса
- теория по физике 🧲 термодинамика
- Плавление и отвердевание
- Парообразование и конденсация
- Тепловые процессы при нагревании и охлаждении
- Частные случаи тепловых процессов
- Уравнение теплового баланса
- Взаимные превращения механической и внутренней энергии
- Примеры КПД
- 💡 Видео
Видео:Урок 112 (осн). Уравнение теплового балансаСкачать

Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
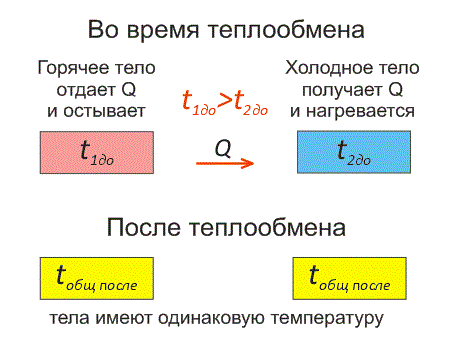
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Видео:Урок 113 (осн). Задачи на уравнение теплового балансаСкачать

Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
(large Q_<text> left( text right) ) – это количество теплоты горячее тело теряет.
(large Q_<text> left( text right) ) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
[large Q_ + Q_ = 0 ]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
[large boxed < Q_+ Q_ + Q_ + ldots + Q_ = 0 > ]
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Видео:Решение задач на уравнение теплового баланса. Физика 8 классСкачать

Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
2). Теперь запишем формулу для каждого количества теплоты:
Примечания:
- (large c_<text> ) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность (large (t_<text> — t_<text> ) ) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность (large (t_<text> — t_<text> ) ) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
4). Для удобства, заменим символы числами:
[large 4200 cdot 0,2 cdot (t_<text> — 80 ) + 4200 cdot 0,1 cdot (t_<text> — 15 ) = 0 ]
[large 840 cdot (t_<text> — 80 ) + 420 cdot (t_<text> — 15 ) = 0 ]
Раскрыв скобки и решив это уравнение, получим ответ:
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- (large Q_ ) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- (large Q_ ) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- (large Q_ ) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Видео:ЕГЭ физика. Уравнение теплового баланса (термодинамика)Скачать

Решение задач на теплообмен с использованием уравнения теплового баланса (методические рекомендации)
Разделы: Физика
Пособие рекомендовано учащимся, желающим получить практические навыки в решении задач на теплообмен, и может быть полезным для учителей и абитуриентов.
При соприкосновении тел, имеющих разные температуры, между этими телами происходит теплообмен. С точки зрения молекулярно-кинетической теории, это объясняется так: молекулы более нагретого тела имеют большую кинетическую энергию, чем молекулы тела, менее нагретого. При “столкновениях” молекул соприкасающихся тел происходит процесс выравнивания их средних кинетических энергий. Молекулы более нагретого тела теряют часть своей кинетической энергии, при этом нагретое тело будет остывать. Кинетическая энергия молекул холодного тела возрастает, поэтому температура этого тела будет увеличиваться. В конечном итоге кинетические энергии молекул обоих тел сравняются, и температуры тел станут одинаковыми. На этом теплообмен прекращается.
Энергию, которую тело получает или отдаёт в процессе теплообмена, называют количеством теплоты (Q).
Количество теплоты, как и все другие виды энергии, измеряется в системе СИ в Джоулях: [Q] = Дж. (Здесь и в дальнейшем единицы измеряются в системе СИ.)
Нагревание или охлаждение
При нагревании или охлаждении тела количество теплоты, поглощаемое или выделяемое им, рассчитывается по формуле:
(t2 – t1) – разность температур тела,° С (или К);
с – удельная теплоёмкость вещества, из которого состоит тело,
Удельная теплоёмкость вещества – это количество теплоты, которое нужно сообщить одному килограмму данного вещества, чтобы увеличить его температуру на 1° С (или это количество теплоты, которое выделяет один килограмм данного вещества, остывая на 1° С).
Значения удельных теплоемкостей других веществ можно найти в справочниках, а также в школьном учебнике или задачнике.
При нагревании тела его внутренняя энергия увеличивается. Это требует притока энергии к телу от других тел. Значит, оно поглощает некоторое количество теплоты, принимая его от других тел, участвующих в теплообмене.
При охлаждении тела его внутренняя энергия уменьшается. Поэтому остывающее тело отдаёт кому-либо некоторое количество теплоты.
Обычно конечную температуру, установившуюся в результате теплообмена, обозначают греческой буквой 
В формуле (1) произведение cm для каждого конкретного тела есть величина постоянная. Её называют теплоёмкостью тела и обозначают С:
Размерность теплоемкости: 
Теплообмен между телами, имеющими одинаковые температуры, не происходит, даже если контактируют вещества, находящиеся в разных агрегатных состояниях. Например, при температуре плавления (0° С) лёд и вода могут находиться бесконечно долго, при этом количество льда и количество воды останутся неизменными. Аналогично ведут себя пар и жидкость, находящиеся при температуре кипения. Теплообмен между ними не происходит.
Плавление или кристаллизация
Если при нагревании тела его температура достигнет температуры плавления, то начинает происходить процесс перехода этого вещества из твердого состояния в жидкое. При этом идут изменения в расположении и характере взаимодействия молекул. Температура при плавлении не изменяется. Это означает, что средние кинетические энергии молекул жидкости и твердого тела при температуре плавления одинаковы. Однако внутренняя энергия тела при плавлении возрастает за счет увеличения энергии взаимодействия молекул. Количество теплоты, поглощаемое телом при плавлении, рассчитывается по формуле

где m – масса тела, кг;

При кристаллизации, наоборот, внутренняя энергия тела уменьшается на величину 
Удельная теплота плавления показывает, сколько энергии нужно сообщить одному килограмму данного вещества, взятого при температуре плавления, чтобы полностью превратить его при этой температуре в жидкость (или сколько энергии выделяет 1 кг жидкости, взятой при температуре кристаллизации, если вся она при этой температуре полностью превратится в твёрдое тело).
Удельную теплоту плавления любого вещества можно найти в справочниках. Для льда же
Температура плавления у каждого вещества своя. Её также можно найти в справочниках. Важно подчеркнуть, что температура плавления вещества равна температуре кристаллизации этого же вещества. У льда tпл = 0° С.
Кипение или конденсация
При достижении жидкостью температуры кипения начинает происходить другой фазовый переход – кипение, при котором расстояния между молекулами значительно увеличиваются, а силы взаимодействия молекул уменьшаются. Вся подводимая к жидкости теплота идет на разрыв связей между молекулами. При конденсации пара в жидкость, наоборот, расстояния между молекулами значительно сокращаются, а силы взаимодействия молекул увеличиваются. Для кипения жидкости энергию к жидкости нужно подводить, при конденсации пара энергия выделяется. Количество теплоты, поглощаемое при кипении или выделяемое при конденсации, рассчитывается по формуле:
где m – масса тела, кг; L – удельная теплота парообразования,
Удельная теплота парообразования показывает, сколько энергии нужно сообщить одному килограмму жидкости, взятой при температуре кипения, чтобы при этой температуре полностью превратить её в пар (для конденсации: сколько энергии выделяет один килограмм пара, взятого при температуре конденсации, полностью превращаясь в жидкость).
При одинаковом давлении температура кипения и температура конденсации одного и того же вещества одинаковы.
Температуры кипения и удельные теплоты парообразования также можно найти в справочниках. Для воды же они соответственно равны: рис. 9 (при нормальном атмосферном давлении).
Уравнение теплового баланса
Тела, участвующие в теплообмене, представляют собой термодинамическую систему. Термодинамическая система называется теплоизолированной, если она не получает энергию извне и не отдаёт её; теплообмен происходит только между телами, входящими в эту систему. Для любой теплоизолированной системы тел справедливо следующее утверждение: количество теплоты, отданное одними телами, равно количеству теплоты, принимаемому другими телами.
Это утверждение описывает частный случай закона сохранения и превращения энергии в применении к процессу теплообмена. А формула (5) является одним из видов уравнения теплового баланса.
При решении задач с помощью данного вида уравнения теплового баланса в формуле (1) в качестве t2 следует брать большую температуру, а в качестве t1 – меньшую. Тогда разность (t2 – t1) будет положительна и всё произведение cm(t2–t1) также будет положительным. Все теплоты, отданные и полученные, будут положительными.
Уравнение теплового баланса можно записать и в таком виде:
где n – количество тел системы.
Алгебраическая сумма всех количеств теплоты (поглощенных и выделенных) в теплоизолированной системе равна нулю.
Q1, Q2, …, Qn – это теплоты, поглощаемые или выделяемые участниками теплообмена. Очевидно, что в этом случае какие-то теплоты должны быть положительны, а какие-то – отрицательны. При записи уравнения теплового баланса в виде (6) всегда t2 – конечная температура, а t1 – начальная.
Если тело нагревается, то разность (t2 – t1) положительна и все произведение cm(t2 – t1) положительно. То есть Q > 0 тогда, когда теплота к данному телу подводится.
А если t2 0; если тело выделяет энергию (кристаллизация, конденсация), то Q
 | Проведём анализ: Вода и калориметр находились в тепловом равновесии, поэтому они имели одинаковую температуру: t1 = t2 = 20° С. При опускании в воду с температурой 20° С свинцового тела с температурой 90° С между водой и свинцом будет происходить теплообмен. Свинец будет остывать, а вода — нагреваться. В этом же процессе участвует и калориметр, который, как и вода, будет тоже нагреваться. |
 | Изменение температур тел с течением времени удобно изображать на графике зависимости t(t ). Отрезок АВ соответствует графику изменения температуры свинцового тела. Стрелка, идущая от него, показывает, что, остывая, свинец выделяет энергию Q3. |
| Два параллельных отрезка СВ соответствуют графикам изменения температур калориметра и воды. Стрелки, идущие к ним, показывают, что для нагревания калориметра и воды требуется энергия Q1 и Q2, которую они поглощают. | |
| Решим задачу с использованием уравнения теплового баланса в виде (5): |
Решим задачу с использованием уравнения теплового баланса в виде (6):
Ответ: Вода нагреется до 24° С.
Предлагаю читателю самостоятельно сделать проверку размерности.
Видео:Урок 127 (осн). Задачи на уравнение теплового баланса - 1Скачать

Фазовые переходы и уравнение теплового баланса
теория по физике 🧲 термодинамика
Фазовые переходы — это термодинамические процессы, приводящие к изменению агрегатного состояния вещества.
Видео:Урок 175. Уравнение теплового балансаСкачать

Плавление и отвердевание
Для расчета количества теплоты, необходимого для процесса плавления, следует применять формулу:
m — масса вещества, λ (Дж/кг) — удельная теплота плавления.
Плавление каждого вещества происходит при определенной температуре, которую называют температурой плавления. Все проводимое тепло идет на разрушение кристаллической решетки, при этом увеличивается потенциальная энергия молекул. Кинетическая энергия остается без изменения и температура в процессе плавления не изменяется.
Удельная теплота плавления показывает, какое количество теплоты необходимо сообщить 1 кг данного вещества, чтобы перевести его из твердого состояния в жидкое при условии, что оно уже нагрето до температуры плавления. В процессе отвердевания 1 кг данной жидкости, охлажденной до температуры отвердевания, выделится такое же количество теплоты.
Внимание! Удельная теплота плавления — табличная величина.
Определение Отвердевание, или кристаллизация — переход состояния из жидкого состояния в твердое (это процесс, обратный плавлению).
Отвердевание происходит при той же температуре, что и плавление. В процессе отвердевания температура также не изменяется. Количество теплоты, выделяемое в процессе отвердевания:
Видео:10 класс, 11 урок, Уравнение теплового баланса с учетом изменения агрегатного состояния веществаСкачать

Парообразование и конденсация
Количество теплоты, необходимое для процесса кипения, вычисляют по формуле:
m — масса вещества, r (Дж/кг) — удельная теплота парообразования.
Парообразование происходит при определенной температуре, которую называют температурой кипения. В отличие от испарения, процесс парообразования идет со всего объема жидкости. Несмотря на то, что к кипящему веществу подводят тепло, температура не изменяется. Все затраты энергии идут на увеличение промежутком между молекулами. Температура кипения зависит от рода вещества и внешнего атмосферного давления.
Удельная теплота парообразования показывает, какое количество теплоты необходимо затратить, чтобы перевести в пар 1 кг жидкости, нагретой до температуры кипения. Такое же количество теплоты выделится в процессе конденсации 1 кг пара, охлажденного до температуры конденсации.
Внимание! Удельная теплота парообразования — табличная величина.
Определение Конденсация — процесс, обратный кипению. Это переход вещества из газообразного состояния в жидкое.
Конденсация происходит при температуре кипения, которая также не изменяется во время всего процесса. Количество теплоты, выделяемое в процессе конденсации:
Видео:89 НЕ ЗНАЮТ этого в Физике: Что такое Количество Теплоты, Теплоемкость, Уравнение Теплового БалансаСкачать

Тепловые процессы при нагревании и охлаждении
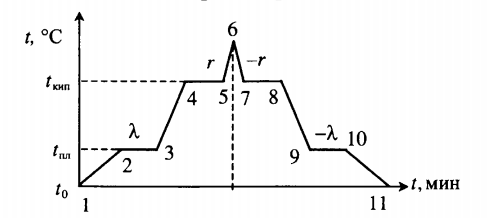
Все фазовые переходы, а также процессы нагревания и остывания вещества можно отобразить графически. Посмотрите на график фазовых переходов вещества:
Он показывает зависимость температуры вещества от времени в процессе его нагревания и остывания. Опишем процессы, отображаемые на графике, в таблице.
| Процесс | Что происходит | Количество выделенной теплоты | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1–2 | Нагревание твердого тела | |||||||||||||||||||||||||||||||||||||||||||||||||
| 2–3 | Плавление при температуре плавления (tпл) | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3–4 | Нагревание жидкости | |||||||||||||||||||||||||||||||||||||||||||||||||
| 4–5 | Кипение при температуре кипения (tкип) | |||||||||||||||||||||||||||||||||||||||||||||||||
| 5–6 | Нагревание пара | |||||||||||||||||||||||||||||||||||||||||||||||||
| 6–7 | Охлаждение пара | |||||||||||||||||||||||||||||||||||||||||||||||||
| 7–8 | Кипение при температуре кипения (tкип) | |||||||||||||||||||||||||||||||||||||||||||||||||
| 8–9 | Охлаждение жидкости | |||||||||||||||||||||||||||||||||||||||||||||||||
| 9–10 | Отвердевание при температуре плавления (tпл) | |||||||||||||||||||||||||||||||||||||||||||||||||
| 10–11 | Охлаждение твердого тела |
| Что происходит | График | Формула количества теплоты | |||||||||||||||||||||||||||||||||||||
| Полностью растопили лед, имеющий отрицательную температуру. | 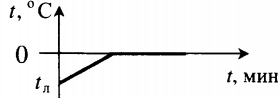 | ||||||||||||||||||||||||||||||||||||||
| Лед, взятый при отрицательной температуре, превратили в воду при комнатной температуре. | 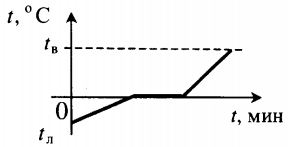 | ||||||||||||||||||||||||||||||||||||||
| Взяли лед при температуре 0 о С и полностью испарили. | 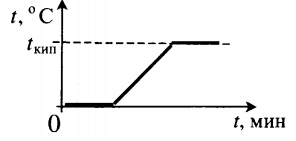 | ||||||||||||||||||||||||||||||||||||||
| Взяли воду при комнатной температуре и половину превратили в пар. | 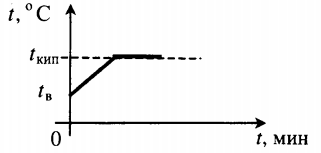 |
| Единицы измерения | Температуру можно оставлять в градусах Цельсия, так как изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах. |
| Кипяток | Вода, которая при нормальном атмосферном давлении имеет температуру в 100 о С. |
| Объем воды 5 л | m = 5 кг, так как: m = ρ V =10 3 · 5 · 10 − 3 м 3 = 5 к г Внимание! Равенство V (л) = m (кг) справедливо только для воды. |
Пример №1. Какое количество теплоты нужно сообщить льду массой 2 кг, находящемуся при температуре –10 о С, чтобы превратить его в воду и нагреть ее до температуры +30 о С?
Можно выделить три тепловых процесса:
- Нагревание льда до температуры плавления.
- Плавление льда.
- Нагревание воды до указанной температуры.
Поэтому количество теплоты будет равно сумме количеств теплоты для каждого из этих процессов:
Q = Q 1 + Q 2 + Q 3
Q = c л m ( 0 − t 1 ) + λ m + c в m ( t 2 − 0 )
Удельные теплоемкости и удельную теплоту плавления смотрим в таблицах:
- Удельная теплоемкость льда = 2050 Дж/(кг∙К).
- Удельная теплоемкость воды = 4200 Дж/(кг∙К).
- Удельная теплота плавления льда = 333,5∙10 3 Дж/кг.
Q = 2050 · 2 ( 0 − ( − 10 ) ) + 333 , 5 · 10 3 · 2 + 4220 · 2 · 30 = 961200 ( д ж ) = 961 , 2 ( к Д ж )
Видео:🔴 ЕГЭ-2022 по физике. Уравнение теплового балансаСкачать

Уравнение теплового баланса
Суммарное количество теплоты, которое выделяется в теплоизолированной системе равно количеству теплоты (суммарному), которое в этой системе поглощается.
Математически уравнение теплового баланса с учетом знаков количества теплоты записывается так:
Q о т д = − Q п о л
Отданное количество теплоты меньше нуля (Qотд 0).
Подсказки к задачам на уравнение теплового баланса
| Теплообмен происходит в калориметре | Потерями энергии можно пренебречь. |
| Жидкость нагревают в некотором сосуде | Начальные и конечные температуры жидкости и сосуда совпадают. |
| В жидкость опускают термометр | Через некоторое время он покажет конечную температуру жидкости и термометра. |
| Мокрый снег | Содержит воду и лед при 0 о С. Учтите, что лед плавится, если он находится при температуре 0 о С и получает энергию от более нагретого тела. Вода кристаллизируется при температуре 0 о С, если она отдает энергию более холодному телу. Если лед и вода находятся при температуре 0 о С, то никаких агрегатных переходов между ними не происходит. |
Частные случаи теплообмена
| В воду комнатной температуры бросили ком снега, содержащий некоторое количество воды, после чего установилась некоторая положительная температура. | 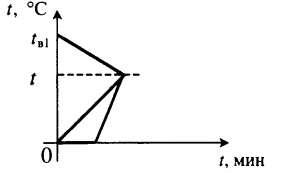 Уравнение теплового баланса: Уравнение теплового баланса:Q 1 + Q 2 + Q 3 = 0 c в m в 1 ( t − t в 1 ) + c в m в 2 ( t − 0 ) + λ m л + c в m л ( t − 0 ) = 0 | ||||||||||||||
| Для получения некоторой положительной температуры воды используют горячую воду и лед, имеющий отрицательную температуру. | 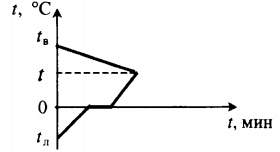 Уравнение теплового баланса: Уравнение теплового баланса:c в m в ( t − t в ) + c л m л ( 0 − t л ) + λ m л + c в m л ( t − 0 ) = 0 | ||||||||||||||
| В воду комнатной температуры бросают раскаленное твердое тело, в результате часть воды испаряется. | 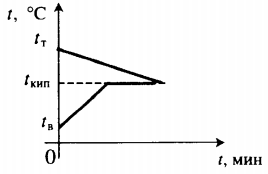 Уравнение теплового баланса: Уравнение теплового баланса:c т m т ( 100 − t т ) + c в m в ( 100 − t в ) + r m п = 0 | ||||||||||||||
| Воду комнатной температуры нагревают до кипения, вводя пар при t = 100 о С. | 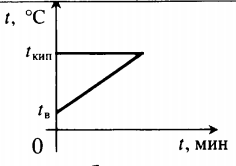 Уравнение теплового баланса: Уравнение теплового баланса:− r m п + c в m в ( 100 − t в ) = 0 | ||||||||||||||
| Лед, имеющий температуру плавления, нагревают до положительной температуры, вводя пар при t = 100 о С. | 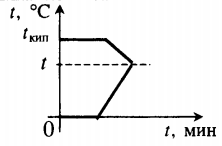 Уравнение теплового баланса: Уравнение теплового баланса:− r m п + c в m п ( t − t к и п ) + λ m л + c в m л ( t − t п л ) = 0 Пример №2. В кастрюлю, где находится вода объемом 2 л при температуре 25 о С, долили 3 л кипятка. Какая температура воды установилась? Количество теплоты, отданное кипятком, равно количеству теплоты, принятому более прохладной водой. Поэтому: c m 1 ( t − t 0 ) = − c m 2 ( t − t к и п ) m 1 ( t − t 0 ) = − m 2 ( t − t к и п ) m 1 t + m 2 t = m 1 t 0 + m 2 t к и п ( m 1 + m 2 ) t = m 1 t 0 + m 2 t к и п t = m 1 t 0 + m 2 t к и п m 1 + m 2 . . t = 2 · 25 + 3 · 100 2 + 3 . . = 350 5 . . = 70 ( ° C ) Видео:Задача на Тепловой обмен. физика 8 классСкачать  Взаимные превращения механической и внутренней энергииЕсли в тексте задачи указан процент одного вида энергии, перешедший в другой, то он указывается в виде десятичной дроби перед этой энергией, которой тело обладало вначале. Частные случаи закона сохранения энергии
|








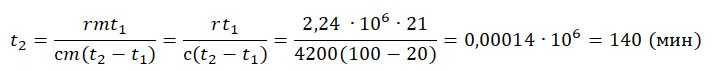
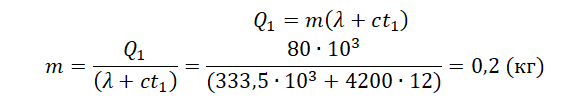
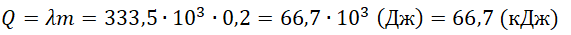
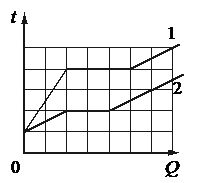 На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.
На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.








