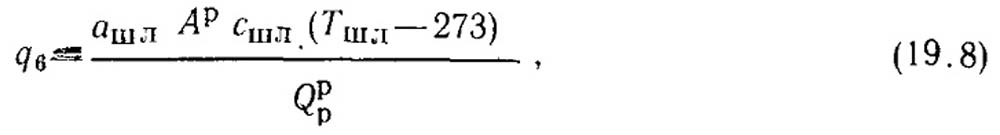- Топливо и его горение
- Составные части топлива
- Сущность процесса горения
- Количество воздуха, необходимое для полного сгорания топлива
- Теплота сгорания топлива
- Условное топливо
- Температура горения топлива
- Способы сжигания топлива
- Тепловой баланс процессов горения
- 1333. Тепловой баланс процессов горения
- 3.1 Расчёт теплоты сгорания
- 3.2 Тепловой баланс и расчёт температуры горения
- 3.3 Расчёт температуры горения методом последовательных приближений
- 3.4 Задачи для самостоятельного решения
- Тепловой баланс котельного агрегата
- Тепловой баланс котельного агрегата
- 🔍 Видео
Видео:89 НЕ ЗНАЮТ этого в Физике: Что такое Количество Теплоты, Теплоемкость, Уравнение Теплового БалансаСкачать

Топливо и его горение
Топливом называют горючие вещества, применяемые для получения теплоты (тепловой энергии) при их сжигании. Под сжиганием обычно подразумевают окисление горючих веществ кислородом воздуха.
Промышленным топливом считаются не все горючие вещества, а лишь те, которые удовлетворяют следующим требованиям:
- при сгорании выделяют достаточно большое количество теплоты;
- не дают продуктов сгорания, губительно действующих на окружающий растительный и животный мир;
- встречаются в больших количествах в природе или легко получаются при переработке других веществ;
- легко добываются и транспортируются на большие расстояния;
- быстро воспламеняются.
Топливо, добываемое из недр земли в готовом виде, называют естественным , а получаемое путем переработки горючих веществ и природного топлива – искусственным . Как естественное, так и искусственное топливо подразделяют на твердое, жидкое и газообразное.
В качестве примера естественных твердых топлив можно привести ископаемый уголь, торф, горючие сланцы, дрова, отходы сельскохозяйственного производства. Искусственное твердое топливо – кокс, полукокс, пылевидное топливо, брикеты, древесный уголь.
К естественному жидкому топливу относится нефть, а к искусственному – получаемые из нефти продукты – бензин, керосин, дизельное топливо, газойль, мазут, нефтяное и котельное топливо.
По назначению топливо подразделяют на энергетическое и технологическое .
К энергетическим относят все низкосортные топлива, которые можно сжигать на электростанциях, в производственно-бытовых и других тепловых установках в натуральном виде или после переработки. Это антрацит, бурые угли, торф, природный газ, а также продукты переработки других топлив.
К технологическому топливу относят высокосортное топливо и коксующиеся угли.
По методу добычи и потребления различают местное и привозное топливо.
Составные части топлива
Топливо состоит из органической и минеральной частей.
Органическую часть топлива составляют следующие химические элементы: углерод (С), водород (Н2), кислород (О2), азот (N2) и сера (S). Топливо может состоять из смеси этих элементов или только их части.
Так, органическую массу кокса или древесного угля в основном составляет углерод, а нефтепродуктов и газового топлива – углерод, водород и кислород.
Наиболее ценные из перечисленных элементов топлива – углерод и водород.
Кислород и азот являются внутренним балластом топлива, поскольку они не горят. Сера является нежелательным компонентом топлива, несмотря на то, что сгорая, она выделяет теплоту. При сгорании этого элемента образуется сернистый газ и серная кислота, пагубно влияющие на экологию и вызывающие сильную коррозию металлов.
Минеральная часть топлива составляют вода и минеральные примеси, которые являются внешней балластной частью (внешним балластом) топлива. Содержание балластной части в топливе очень нежелательно, поскольку увеличивая массу и объем топлива, она уменьшает его тепловую ценность.
Минеральные составляющие после сжигания образуют твердый остаток – золу.
Сущность процесса горения
Горение есть окисление горючих элементов топлива кислородом, сопровождающееся выделением теплоты.
В зависимости от скорости распространения пламени различают нормальное горение и горение со взрывом . При нормальном горении скорость распространения пламени равна 15-25 м/с, а при взрывном горении – 2000-3000 м/с. Чтобы топливо начало гореть, его необходимо нагреть до определенной температуры, называемой температурой воспламенения .
Так, например, каменный уголь воспламеняется при температуре 225-375 ˚С, сухой торф – 225-300 ˚С, дрова – 350-450 ˚С, керосин – 380 ˚С, бензин – 415 ˚С, метан (СН4) – 650-700 ˚С и т. д.
При нагревании топлива до температуры воспламенения начинается распад горючей массы на составные элементы, которые затем окисляются кислородом и выделяют теплоту. Эта теплота способствует нагреву массы близлежащего топлива, в которых начинают протекать аналогичные процессы (распад и окисление) , и, таким образом, вся масса топлива, находящегося в топке, начинает гореть.
Для того, чтобы процесс горения не прекратился, выделяющаяся теплота должна поддерживать температуру топлива не ниже температуры воспламенения.
Горение может быть полным и неполным.
Полным горением называют процесс окисления горючих элементов топлива кислородом, при котором выделяются продукты, не способные гореть в дальнейшем.
Неполное сгорание топлива сопровождается выделением продуктов горения, которые в дальнейшем могут воспламеняться и сгорать повторно. Так, при полном сгорании углерода выделяется углекислый газ СО2, который в дальнейшем гореть не способен.
Однако, если углерод сгорает при недостаточном количестве кислорода, то продуктом его окисления является углекислота СО, которая может загореться при соответствующих условиях. При этом неполное горение сопровождается выделением значительно меньшего количества теплоты, т. е. считается нежелательным явлением. Для того чтобы процесс горения был полным, необходимо обеспечить подачу достаточного количества воздуха (содержащего кислород) в зону горения.
На практике, сжигая топливо, стараются придерживаться определенного баланса между количеством воздуха и топлива, поскольку избыток воздуха сопровождается потерями теплоты на его подогрев.
Количество воздуха, необходимое для полного сгорания топлива
Количество воздуха, необходимое для полного сгорания топлива, определить несложно, если известно процентное содержание в топливе основных горючих элементов – углерода, водорода, серы и кислорода.
Так как атомная масса углерода 12, а кислорода – 16, то для получения углекислого газа СО2 необходимо 12 частей углерода соединить с 32 частями кислорода, т. е. на одну массовую долю углерода должно приходиться 2,67 частей кислорода.
Зная атомную массу водорода и серы, а также формулы продуктов их полного окисления, можно аналогично рассчитать необходимое количество кислорода для сжигания 1 части любого горючего элемента.
При определении количества воздуха, необходимого для полного горения, следует учитывать, что в топливе тоже содержится некоторое количество кислорода, а также то, что массовая доля кислорода в воздухе — 23,2 %. В общем случае формула для определения массового количества воздуха для полного сгорания топлива имеет вид:
где: Ср , Нр , Sр , Ор – соответственно массовое содержание углерода, водорода, серы и кислорода в топливе.
При сгорании топлива часть кислорода воздуха не успевает вступить в реакцию окисления, поэтому для обеспечения полного сгорания топлива следует к нему подводить воздух с некоторым избытком по сравнению с теоретически необходимым количеством. Отношение действительного количества воздуха к теоретически необходимому количеству называют коэффициентом избытка воздуха . На практике этот коэффициент (в зависимости от вида топлива) может принимать значения от 1,05 (газообразное и пылевидное топливо) до 1,8 (твердое топливо) .
Теплота сгорания топлива
Важнейшая характеристика топлива – теплота его сгорания – количество теплоты, выделившейся при полном сгорании единицы количества топлива (для жидких и твердых топлив – кг, для газообразных – м 3 ) . Различают высшую и низшую теплоту сгорания.
Высшей теплотой сгорания Qв называют теплоту, выделяемую при полном сгорании единицы количества топлива, в результате которого образующаяся влага конденсируется и выделяется в виде жидкости из продуктов сгорания.
Если в результате сгорания единицы количества топлива образуемая влага остается в продуктах сгорания в парообразном состоянии, то выделяемую при этом теплоту называют низшей теплотой сгорания Qн . Эта величина меньше высшей теплоты сгорания топлива на теплоту парообразования (конденсации) влаги, образуемой при сжигании единицы количества топлива.
Теплоту сгорания топлива, кДж/кг , можно определить опытным путем (при сжигании порции топлива в специальном приборе – калориметре) или расчетом (по формулам Менделеева) , если известен элементарный состав топлива.
Например, для твердого топлива:
Qв = 339С + 1250Н – 108,85(О – S) ;
для жидкого топлива:
где: С , Н , О , S и W – соответственно процентное содержание углерода, водорода, кислорода, серы и влаги в рабочем топливе.
Условное топливо
При расчете расхода топлива, а также топливных ресурсов пользуются понятием условное топливо .
Это реальное топливо, теплота сгорания которого равна 29,3 МДж/кг.
Для перевода любого топлива в условное, пользуются тепловым эквивалентом, который получается от деления теплоты Qрц сгорания данного топлива на теплоту сгорания условного топлива, т. е. на 29300 кДж/кг или 29,3 МДж/кг.
Так, например, для торфа Эт = 8500/29300 = 0,29, т. е. 1 тонна торфа по своей тепловой ценности равноценна 0,29 тонны условного топлива.
Температура горения топлива
Следует различать теоретическую и действительную температуру горения.
Теоретической температурой горения называют максимальную температуру, которую способно давать данное топливо при полном сгорании с теоретически необходимым количеством воздуха. Ее определяют опытным путем, или аналитически, используя формулы, в которых учитывается массовая доля и теплотворная способность каждого горючего элемента в топливе. При этом теоретическая температура горения будет равна отношению теплоты, полученной от сгорания единицы топлива, к сумме произведений массовых составляющих горючих элементов на их теплотворную способность.
Теоретически определенная температура горения топлива всегда выше действительной, поскольку при расчетах не учитывается ее понижение из-за потерь теплоты на лучеиспускание, избыток воздуха при сжигании, неполное сгорание топлива и т. п.
Действительная температура горения (при коэффициенте избытка воздуха равном 1,0) : антрацита — 2270 ˚С, торфа – 1700 ˚С, мазута – 1125 ˚С, природного газа – 2000 ˚С.
Способы сжигания топлива
В котельной практике известны слоевой, факельный и вихревой способы сжигания топлива.
Слоевой способ сжигания топлива (рис. 1а) заключается в следующем. Загруженное в топку топливо распределяется ровным слоем по колосниковой решетке, через которую проходит воздух, встречающий на своем пути неподвижный или движущийся слой горящего топлива.
При взаимодействии с топливом воздух превращается в газовоздушный поток, который, пройдя через топочное пространство, выходит наружу. Для предотвращения уноса топлива необходимо, чтобы вес частичек топлива был больше силы газовоздушного потока. Однако, при слишком больших размерах кусков топлива замедляется процесс горения и уменьшается количество теплоты, получаемой в единицу времени, поэтому оптимальный размер кусков – 20-30 мм.
Основным достоинством слоевого способа сжигания твердого топлива является наличие на колосниках запаса горящего топлива, обеспечивающего устойчивость протекания процесса. Существенным недостатком этого способа является необходимость использования твердого топлива с оптимальными размерами кусков, что требует предварительной их сортировки и дробления.
Факельный способ сжигания топлива (рис. 1б) , в отличие от слоевого, заключается в том, что частицы топлива движутся вместе с газовоздушным потоком в топочном пространстве. Поэтому масса частиц должна быть как можно меньше, и они должны удерживаться в газовоздушном потоке.
Этим обеспечивается очень тщательное перемешивание частичек топлива с воздухом, интенсивное их горение, получается более однородный, устойчивый факел горения и происходит наиболее полное выгорание горючих элементов, составляющих горючую массу топлива. Поэтому при факельном способе применяют твердое топливо в виде очень мелких частичек (пыли) , размеры которых составляют доли миллиметра.
Существенный недостаток этого способа – малая скорость обтекания частиц топлива газовоздушным потоком, которая не позволяет значительно увеличить интенсивность горения, а также большая чувствительность к изменению режима работы, поскольку в топочном пространстве постоянно находится небольшое количество (запас) топлива. Поэтому регулирование процесса возможно при одновременном изменении подачи топлива и воздуха.
Вихревой способ сжигания топлива (рис. 1в) заключается в создании в топочном пространстве вихря, благодаря которому топливо, поступающее в топку, подхватывается газовоздушным потоком и движется вместе с ним по определенной траектории до полного выгорания горючих элементов из горючей массы.
Вихревое движение топлива в газовоздушном потоке способствует более длительному нахождению топлива в топочном пространстве, что создает условия для полного сгорания частиц размером 3-5 мм и для получения более устойчивого горения, чем при факельном способе сжигания.
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Видео:Энергия топлива, удельная теплота сгорания топлива. 8 класс.Скачать

Тепловой баланс процессов горения
Видео:Решение задач на уравнение теплового баланса. Физика 8 классСкачать

1333. Тепловой баланс процессов горения
Видео:ЕГЭ физика. Уравнение теплового баланса (термодинамика)Скачать

3.1 Расчёт теплоты сгорания
При тепловых расчётах определят, как правило, низшую теплоту сгорания вещества. Низшая теплота рассчитывается как количество тепла, выделяющегося при сгорании единицы количества вещества или единицы массы при газообразном состоянии воды как продукта реакции. В первом случае речь идёт о мольной теплоте сгорания, во втором – об удельной теплоте сгорания. Связь мольной и удельной теплоты сгорания даётся формулой

где 

Формулы, для расчёта низшей теплоты сгорания приводятся в таблице 3-1.
Табл. 3-1 Расчётные формулы для определения низшей теплоты сгорания.


Формула (3.2) представляет следствие из закона Гесса. Согласно этому следствию тепловой эффект реакции будет равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ. Здесь 


Формула (3.3) носит название формулы . Она применяется для расчёта теплот сгорания сложных веществ, если известен их состав в массовых процентах. Здесь C, H,S, N,O – содержание соответствующего элемента в массовых процентах, W — влажность горючего.
Теплоту сгорания газовоздушных смесей определяют по формуле

где Qн – низшая теплота сгорания газообразного горючего, ц – содержание горючего в смеси (в объёмных %). В случае нескольких горючих газов производится суммирование по всем горючим

Пример 1. Рассчитать мольную и удельную теплоту сгорания уксусной кислоты.
Горючее – индивидуальное вещество. Для расчёта мольной теплоты сгорания воспользуемся следствием из закона Гесса (3.4). Запишем уравнение реакции
CH3CO2H + 2(O2 +3,76N2) = 2CO2 + 2H2O + 2·3,76N2.
Кислород и азот – простые вещества и их стандартные теплоты образования равны нулю. теплоты образования остальных участников реакции возьмём из справочных данных: ДfH0(CH3CO2H) = -485,6 кДж/моль, ДfH0(CO2) = -396,9 кДж/моль, ДfH0(H2O) = -242,2 кДж/моль. Теплота сгорания уксусной кислоты будет равна 

Пример 2. Рассчитать низшую теплоту сгорания органического вещества состава С – 62%, H – 8%, O – 28%, S – 2%.
Горючее – сложное вещество, для расчёта теплоты сгорания воспользуемся формулой Менделеева (3.3). 
Пример 3. Рассчитать теплоту сгорания газовой смеси состава (в об. %) CH4 – 40%, C4H10 – 20%,O2 – 15%, H2S – 15%, NH3 – 10%, CO2 – 10%.
Определим низшую теплоту сгорания каждого горючего газа в смеси CH4, C4H10, H2S и NH3 используя следствие из закона Гесса (3.4). Теплоты образования горючих продуктов реакции возьмём из справочных таблиц. Поскольку теплота образования азота равна нулю (простое вещество) то для простоты не будем включать азот воздуха в уравнение реакции.
Табл. 3-2. Теплоты сгорания компонентов газовой смеси.
Теплота сгорания, кДж/моль
CH4 +2O2 = CO2 + 2H2O
C4H10 + 6,5O2 = 4CO2 + 5H2O
H2S +1,5O2 = H2O + SO2
NH3 +0,75O2 = 0,5N2 + 1,5H2O
По формуле (3.6) определим теплоту сгорания газовой смеси.


Пример 4: Рассчитать теплоту сгорания 1 м3 стехиометрической смеси гексана с воздухом.
Стехиометрический состав смеси находится из уравнения реакции
C6H14 + 9,5(O2 + 3,76N2) = 6CO2 + 7H2O + 9,5·3,76N2.
Весь объём участников реакции, т. е. сумму стехиометрических коэффициентов, примем за 100%. А количество горючего (1 моль) будет соответствовать стехиометрической концентрации 



Видео:Урок 112 (осн). Уравнение теплового балансаСкачать

3.2 Тепловой баланс и расчёт температуры горения
Под температурой горения понимают максимальную температуру, до которой нагреваются продукты горения. В технике и пожарном деле различают теоретическую, калориметрическую, адиабатическую и действительную температуру горения.
Теоретическая температура горения – это температура, при которой выделившаяся теплота горения смеси стехиометрического состава расходуется на нагрев и диссоциацию продуктов горения. Практически диссоциация продуктов горения начинается при температуре выше 2000 К
Калориметрическая температура горения – это температура, которая достигается при горении стехиометрической горючей смеси с начальной температурой 273 К и при отсутствии потерь в окружающую среду.
Адиабатическая температура горения – это температура полного сгорания смесей любого состава при отсутствии тепловых потерь в окружающую среду.
Действительная температура горения – это температура горения, достигаемая в условиях реального пожара. Она намного ниже теоретической, калориметрической и адиабатической, т. к. в реальных условиях до 40 % теплоты горения обычно теряется на излучение, недожог, нагрев избытка воздуха и т. д.
Экспериментальное определение температуры горения для большинства горючих веществ представляет значительные трудности, особенно для жидкостей и твёрдых материалов. Однако в ряде случаев теория позволяет с достаточной для практики точностью вычислить температуру горения веществ, основываясь только на знании их химической формулы, состава исходной горючей смеси и продуктов горения.
В общем случае используется зависимость вида

где Qпг – теплота, перешедшая в продукты горения (энтальпия или теплосодержание продуктов горения), Vпг – объём продуктов горения, Cp – удельная теплоёмкость продуктов горения при постоянном давлении, Tг – температура горения. Но напрямую пользоваться формулой (3.7) нельзя, т. к. теплоёмкость есть функция температуры (
Энтальпия продуктов горения определяется из уравнения теплового баланса.


где Qпг – энтальпия продуктов горения, Qисп – теплота испарения, Qпот – тепловые потери за счёт излучения (Qи), недожога (Qнед) и диссоциации (Qдисс) продуктов горения. В зависимости от рода учитываемых потерь теплоты в зоне горения (на излучение, недожог, диссоциацию продуктов горения) вычисляется та или иная температура.
Энтальпия продуктов реакции может быть представлена как сумма энтальпий всех продуктов реакции.

где Vпг. i – объём i-того продукта горения, Cp, i – его изобарная теплоёмкость, Tг – температура горения.
При кинетическом горении газопаровоздушных смесей потери теплоты из зоны горения пренебрежимо малы, поэтому для этих смесей действительная температура горения близка к адиабатической, которую и используют в пожарно-технических расчетах.
Для расчёта температуры горения составим уравнение теплового баланса, учитывая, что выделяющееся тепло нагревает продукты горения от начальной температуры T0 до температуры Tг.

где з — коэффициент теплопотерь (доля потерь тепла на излучение, а также в результате неполноты сгорания). из уравнения теплового баланса следует

Трудность в определении температуры горения по этой формуле заключается в том, что теплоёмкость газа зависит от температуры. Так как газы нагреваются от температуры T0 до температуры Тг, то в формулу (3.12) необходимо подставить среднее значение теплоёмкости именно в этом интервале температур. Но температура горения нам неизвестна и мы хотим её найти. В этом случае можно поступить следующим образом. Среднее значение температуры горения большинства веществ в воздухе составляет примерно 1500 К. Поэтому с небольшой погрешностью в определении Тг для расчётов можно взять среднее значение теплоёмкости в интервале температур 273–1500 К.
Видео:Урок 114 (осн). Удельная теплота сгорания топлива. КПД нагревателяСкачать

3.3 Расчёт температуры горения методом последовательных приближений
Для более точных расчётов температуры горения используют метод последовательных приближений, по известной зависимости теплосодержания (энтальпии) продуктов горения от температуры. Если теплосодержание продуктов горения при Т=273 К принять равным нулю, то полное теплосодержание продуктов горения при Тг будет равно количеству теплоты, выделившейся в результате химической реакции. Учётом теплопотерь

где Hпг, i – энтальпия i – того продукта горения. Задача состоит в том, чтобы найти температуру, при которой будет справедливо это равенство. Энтальпии продуктов горения приведены в справочных таблицах.
Алгоритм расчёта приведён в табл. 3-3.
Табл. 3-3. Алгоритм расчёта температуры горения.
Объём и состав продуктов горения
Низшая теплота сгорания или количество тепла, пошедшего на нагрев продуктов горения (при наличии теплопотерь)
Среднее значение энтальпии продуктов горения

Температура горения T1 по средней энтальпии с помощью справочным таблицам, ориентируясь на азот (наибольшее содержание в продуктах горения)
Теплосодержание продуктов горения с температурой Т1

Теплосодержание продуктов горения с температурой Т2 Если Q1>Qпг то T2 T1
Расчёт ведётся до получения неравенства 

Температура взрыва, протекающего в изохорно-адиабатическом режиме (при постоянном объёме) рассчитывается по уравнению теплового баланса (3.13) и алгоритму табл. 3-3, В отличие от горения вместо энтальпии продуктов горения используется их внутренняя энергия (также находимая по справочным таблицам)

где Cv – теплоёмкость при постоянном объёме кДж/моль·К, кДж/кг·К.
Пример 5: Рассчитать адиабатическую температуру горения стехиометрической смеси этилового спирта (C2H6O) с воздухом.
Так как горючее – индивидуальное вещество для определения состава и объёма продуктов горения запишем уравнение реакции.
C2H6O + 3(O2 + 3,76N2) = 2CO2 + 3H2O + 3·3,76N2.
Объёмы продуктов реакции 










Пример 6: Рассчитать адиабатическую температуру горения органического вещества состава С – 60%, H – 7%, O – 25%, W – 8%.
Горючее – сложное вещество, состав продуктов горения определяем по формулам §2.2. 










Пример 7: Рассчитать действительную температуру горения фенола (C6H6O, 
Так как горючее – индивидуальное вещество составим уравнение реакции горения фенола.
C6H6O + 7(O2 + 3,76N2) = 6CO2 + 3H2O + 7·3,76N2
Определим объём и состав продуктов горения фенола. 






Пример 8: Рассчитать температуру взрыва метановоздушной смеси стехиометрического состава.
Расчет едём по алгоритму, изложенному в табл. 3-3. с учётом формулы (3.17). Составим уравнение реакции взрыва и найдём объём и состав продуктов горения
CH4 + 2(O2 + 3,76N2) = CO2 + 2H2O + 2·3,76N2.
Объёмы продуктов горения 










Видео:Задача на Тепловой обмен. физика 8 классСкачать

3.4 Задачи для самостоятельного решения
1. В каком случае в условиях пожара при горении бутана выделится больше тепла: при полном горении или неполном, протекающем по реакции С4Н10 + 4,5О2→4СО+5Н2О. Ответ необходимо подтвердить расчётом с использованием закона Гесса.
2. Вычислить теплоту образования ацетилена (C2H2) из элементов, если его теплота горения равна 1411, 2 кДж/моль.
3. Определить теплоту сгорания 12 кг бензола (C6H6), если теплота его образования составляет -82,9 кДж/моль/
4. Определить теплоту образования пимелиновой кислоты (С7Н12О4), если теплота её сгорания составляет 3453, 5 кДж/моль.
5. Определить теплоту сгорания салициловой кислоты (C7H6O3), если теплота её образования составляет -589,5 кДж/моль.
6. Вычислить теплоту образования метана, если при сжигании 10 г его в стандартных условиях выделяется 556,462 кДж тепла.
7. Определить теплоту сгорания бензилового спирта (С7Н8О), если теплота его образования составляет -875, 4 кДж/моль.
8. При образовании октана (C8H18) из элементов выделяется 208,45 кДж/моль тепла. Рассчитать его теплоту горения.
9. Теплота образования ацетона (C3H6O) составляет -248,28 кДж/моль. Определить его теплоту горения и количество тепла, которое выделится при сгорании 30 г. вещества.
10. Рассчитать теплоту сгорания сульфапиридазина (С11Н12О3N4S) без учёта потерь на испарение влаги.
11. Определить теплоту сгорания сульфофенилгидразина (С6Н8О3N2S) с учётом потерь на испарение воды. Содержание влаги в веществе 20 %.
12. Определить теплоту сгорания 4, 4-диаминодифенилсульфона (С12Н12О2N2S) без учёта потерь на испарение влаги по формуле .
13. Определить теплоты сгорания 4, 6-диметилгексагидро-1, 3, 5-триазинтиона-2 (С5Н9N3S) по формуле .
14. Определить теплоту сгорания по формуле диаминомезитилен-6-сульфокислоты (С9Н14О3N2S), если содержание влаги в веществе 35 %.
15. Определить низшую теплоту горения древесины состава: С – 41,5%; Н – 6%; О – 43 %; N – 2%; W– 7,5%.
16. Определить теоретическую температуру горения ацетона (C3H6O) с использованием средних значений теплоёмкостей.
17. Определить теоретическую температуру горения пентана (C5H12) с использованием средних значений теплоёмкостей.
18. Определить теоретическую температуру горения октана (C8H18) и использованием средних значений теплоёмкостей.
19. Определить теоретическую температуру горения бензола (C6H6) с использованием средних значений теплоёмкостей.
20. Методом последовательных приближений рассчитать адиабатическую температуру горения пропанола (C3H8O).
21. Рассчитайте температуру горения для стехиометрической смеси горючего вещества с воздухом (табл. 3-4).
Видео:Энергия топлива, удельная теплота сгорания топлива. Практическая часть - решение задачи. 8 класс.Скачать

Тепловой баланс котельного агрегата
Тепловой баланс котельного агрегата
Тепловой баланс котельного агрегата устанавливает равенство между поступающим в агрегат количеством теплоты и его расходом. На основании теплового баланса котельного агрегата определяют расход топлива и вычисляют коэффициент полезного действия, который является важнейшей характеристикой энергетической эффективности работы котла.
В котельном агрегате химически связанная энергия топлива в процессе горения преобразуется в физическую теплоту горючих продуктов сгорания. Эта теплота расходуется на выработку и перегрев пара или нагревание воды. Вследствие неизбежных потерь при передаче теплоты и преобразовании энергии вырабатываемый продукт (пар, вода и т.д.) воспринимает только часть теплоты. Другую часть составляют потери, которые зависят от эффективности организации процессов преобразования энергии (сжигания топлива) и передачи теплоты вырабатываемому продукту.
Тепловой баланс котельного агрегата заключается в установлении равенства между поступившим в агрегат количеством теплоты и суммой использованной теплоты и тепловых потерь. Тепловой баланс котельного агрегата составляется на 1 кг твердого или жидкого топлива или для 1 м 3 газа. Уравнение, при котором тепловой баланс котельного агрегата для установившегося теплового состояния агрегата записывают в следующем виде:
Где Qр/ р — теплота, которой располагают; Q1 — использованная теплота; ∑Qn — общие потери; Q2 — потери теплоты с уходящими газами; Q3 — потери теплоты от химического недожога; Q4 — потери теплоты от механической неполноты сгорания; Q5 — потери теплоты в окружающую среду; Q6 — потери теплоты с физической теплотой шлаков.
Если каждое слагаемое правой части уравнения (19.3) разделить Qp/ p и умножить на 100%, получим второй вид уравнения, при котором тепловой баланс котельного агрегата:
В уравнении (19.4) величина q1 представляет собой коэффициент полезного действия установки «брутто». Он не учитывает затраты энергии на обслуживание котельной установки: привод дымососов, вентиляторов, питательных насосов и прочие расходы. Коэффициент полезного действия «нетто» меньше КПД «брутто», так как он учитывает затраты энергии на собственные нужды установки.
Левая приходная часть уравнения теплового баланса (19.3) является суммой следующих величин:
где QB.BH — теплота, вносимая в котлоагрегат с воздухом на 1 кг топлива. Эта теплота учитывается тогда, когда воздух нагревается вне котельного агрегата (например, в паровых или электрических калориферах, устанавливаемых до воздухоподогревателя); если воздух нагревается только в воздухоподогревателе, то эта теплота не учитывается, так как она возвращается в топку агрегата; Qпap — теплота, вносимая в топку с дутьевым (форсуночным) паром на 1 кг топлива; Qфиз.т — физическая теплота 1 кг или 1 м 3 топлива.
Теплоту, вносимую с воздухом, рассчитывают по равенству
где β — отношение количества воздуха на входе в воздухоподогреватель к теоретически необходимому; ср — средняя объемная изобарная теплоемкость воздуха; при температуре воздуха до 600 К можно считать ср = 1,33 кДж/(м 3 К); Тг.вз — температура нагретого воздуха, К; Тх.вз — температура холодного воздуха, принимаемая обычно равной 300 К.
Теплоту, вносимую с паром для распыления мазута (форсуночный пар), находят по формуле:
где Wф — расход форсуночного пара, равный 0,3 — 0,4 кг/кг; iф — энтальпия форсуночного пара, кДж/кг; r — теплота парообразования, кДж/кг.
Физическая теплота 1 кг топлива:
где ст — теплоемкость топлива, кДж/(кгК); Тт — температура топлива, К.
Значение величины Qфиз. т обычно незначительно и в расчетах учитывается редко. Исключением являются мазут и низкокалорийный горючий газ, для которых значение Qфиз.т существенно и должно обязательно учитываться.
Если предварительный подогрев воздуха и топлива отсутствует и пар для распыления топлива не используется, то Q p /р = Q р /н. Слагаемые потерь тепла в уравнении теплового баланса котельного агрегата подсчитывают на основании равенств, приводимых ниже.
1. Потерю теплоты с уходящими газами Q2(q2) определяют как разность между энтальпией газов на выходе из котельного агрегата и воздуха, поступающего в котельный агрегат (двоздухоподогревателя), т.е.
где Vr — объем продуктов сгорания 1 кг топлива, определяемый по формуле (18.46), м 3 /кг; cр.r, ср.в — средние объемные изобарные теплоемкости продуктов сгорания топлива и воздуха, определяемые как теплоемкости газовой смеси (§ 1.3) с помощью таблиц (см. прил. 1); Тух, Тх.вз — температуры уходящих газов и холодного воздуха; а — коэффициент, учитывающий потери от механического недожога топлива.
Котельные агрегаты и промышленные печи работают, как правило, под некоторым разрежением, которое создается дымососами и дымовой трубой. Вследствие этого через не плотности в ограждениях, а также через смотровые лючки и т.д. подсасывается из атмосферы некоторое количество воздуха, объем которого необходимо учитывать при расчете Iух.
Энтальпию всего поступающего в агрегат воздуха (с учетом присосов) определяют по коэффициенту избытка воздуха на выходе из установки αух = αт + ∆α.
Общий подсос воздуха в котельных установках не должен превышать ∆α = 0,2 ÷ 0,3.
Из всех потерь теплоты величина Q2 — самая значительная. Величина Q2 возрастает с увеличением коэффициента избытка воздуха, температуры уходящих газов, влажности твердого топлива и забалластированности негорючими газами газообразного топлива. Снижение присосов воздуха и улучшение качества горения приводят к некоторому уменьшению потери теплоты Q2. Основным определяющим фактором, влияющим на потерю теплоты уходящими газами, является их температура. Для снижения Тух увеличивают площадь теплоиспользующих поверхностей нагрева — воздухоподогревателей и экономайзеров.
Величина Тух влияет не только на КПД агрегата, но и на капитальные затраты, необходимые для установки воздухоподогревателей или экономайзеров. С уменьшением Тух возрастает КПД и снижаются расход топлива и затраты на него. Однако при этом возрастают площади теплоиспользующих поверхностей (при малом температурном напоре площадь поверхности теплообмена необходимо увеличивать; см. § 16.1), в результате чего повышаются стоимость установки и эксплуатационные расходы. Поэтому для вновь проектируемых котельных агрегатов или других теплопотребляющих установок значение Тух определяют из технико — экономического расчета, в котором учитывается влияние Tух не только на КПД, но и на величину капитальных затрат и эксплуатационных расходов.
Другой важный фактор, влияющий на выбор Тух, — содержание серы в топливе. При низкой температуре (меньше, чем температура точки росы дымовых газов) возможна конденсация водяных паров на трубах поверхностей нагрева. При взаимодействии с сернистым и серным ангидридами, которые присутствуют в продуктах сгорания, образуются сернистая и серная кислоты. В результате этого поверхности нагрева подвергаются интенсивной коррозии.
Современные котельные агрегаты и печи для обжига строительных материалов имеют Тух = 390 — 470 К. При сжигании газа и твердых топлив с небольшой влажностью Тух — 390 — 400 К, влажных углей
Тух = 410 — 420 К, мазута Тух = 440 — 460 К.
Влажность топлива и негорючие газообразные примеси являются газообразующим балластом, который увеличивает количество получающихся при горении топлива продуктов сгорания. При этом повышаются потери Q2.
При использовании формулы (19.6) следует иметь в виду, что объемы продуктов сгорания рассчитывают без учета механического недожога топлива. Фактическое количество продуктов сгорания с учетом механической неполноты горения будет меньше. Это обстоятельство учитывают, вводя в формулу (19.6) поправочный коэффициент a = 1 — р4/100.
2. Потеря теплоты от химического недожога Q3(q3). Газы на выходе из топки могут содержать продукты неполного горения топлива СО, Н2, СН4, теплота сгорания которых не использована в топочном объеме и далее по тракту котлоагрегата. Суммарная теплота сгорания этих газов и обусловливает химический недожог. Причинами появления химического недожога могут быть:
- недостаток окислителя (α 3 .
Недостаток воздуха приводит в тому, что часть горючих элементов газообразных продуктов неполного горения топлива может вообще не сгорать из-за отсутствия окислителя.
Плохое перемешивание топлива с воздухом является причиной или местного недостатка кислорода в зоне горения, или, наоборот, большого его избытка. Большой избыток воздуха вызывает снижение температуры горения, что уменьшает скорости реакций горения и делает процесс сжигания неустойчивым.
Малое удельное тепловыделение в топке (qv = BQ p/ н/Vт, где В — расход топлива; VT — объем топки) является причиной сильного рас сеяния теплоты в топочном объеме и ведет к снижению температуры. Завышенные значения qv также вызывают появление химического недожога. Объясняется это тем, что для завершения реакции горения требуется определенное время, а при значительно завышенном значении qv время нахождения топливовоздушной смеси в топочном объеме (т.е. в зоне наиболее высоких температур) оказывается недостаточным и ведет к появлению в газообразных продуктах сгорания горючих составляющих. В топках современных котельных агрегатов допустимое значение qv достигает 170 — 350 кВт/м 3 (см. § 19.2).
Для вновь проектируемых котельных агрегатов значения qv выбирают по нормативным данным в зависимости от вида сжигаемого топлива, способа сжигания и конструкции топочного устройства. При балансовых испытаниях эксплуатируемых котельных агрегатов величину Q3 рассчитывают по данным газового анализа.
При сжигании твердого или жидкого топлива величину Q3, кДж/кг, можно определить по формуле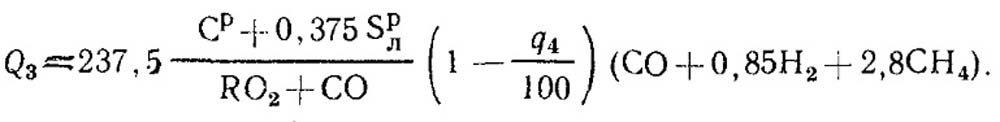
3.Потеря теплоты от механической неполноты сгорания топлива Q4(g4). При горении твердого топлива остатки (зола, шлак) могут содержать некоторое количество несгоревших горючих веществ (в основном углерода). В результате химически связанная энергия топлива частично теряется.
Потеря теплоты от механической неполноты сгорания включает ее потери вследствие:
- провала мелких частиц топлива через зазоры в колосниковой решетке Qпр (qпр);
- удаление некоторой части недогоревшего топлива со шлаком и золой Qшл (qшл);
- уноса мелких частиц топлива дымовыми газами Qун (qун)
Потеря теплоты qyн принимает большие значения при факельном сжигании пылевидного топлива, а также при сжигании неспекающихся углей в слое на неподвижных или подвижных колосниковых решетках. Значение qун для слоевых топок зависит от видимого удельного энерговыделения (теплонапряжения) зеркала горения qR, кВт/м 2 , т.е. от количества выделяющейся тепловой энергии, отнесенного к 1 м 2 горящего слоя топлива.
Допустимое значение qR BQ р /н/R (В — расход топлива; R — площадь зеркала горения) зависит от вида сжигаемого твердого топлива, конструкции топки, коэффициента избытка воздуха и т.д. В слоевых топках современных котельных агрегатов величина qR имеет значения в пределах 800 — 1100 кВт/м2. При расчете котельных агрегатов величины qR, q4 = qnp + qшл + qун принимают по нормативным материалам. При балансовых испытаниях потерю теплоты от механического недожога рассчитывают по результатам лабораторного технического анализа сухих твердых остатков на содержание в них углерода. Обычно для топок с ручной загрузкой топлива q4 = 5 ÷ 10%, а для механических и полумеханических топок q4 = 1 ÷ 10%. При сжигании пылевидного топлива в факеле в котельных агрегатах средней и большой мощности q4 = 0,5 ÷ 5%.
4. Потеря теплоты в окружающую среду Q5 (q5) зависит от большого числа факторов и главным образом от размеров и конструкции котла и топки, теплопроводности материала и талщины стенок обмуровки, тепловой производительности котлоагрегата, температуры наружного слоя обмуровки и окружающего воздуха и т. д.
Потери теплоты в окружающую среду при номинальной производительности определяют по нормативным данным в зависимости от мощности котлоагрегата и наличия дополнительных поверхностей нагрева (экономайзера). Для паровых котлов производительностью до 2,78 кг/с пара q5 — 2 — 4%, до 16,7 кг/с — q5 — 1 — 2%, более 16,7 кг/с — q5 = 1 — 0,5%.
Потери теплоты в окружающую среду распределяются по различным газоходам котлоагрегата (топка, пароперегреватель, экономайзер и т.д.) пропорционально теплоте, отдаваемой газами в этих газоходах. Эти потери учитывают, вводя коэффициент сохранения теплоты φ = 1 q5/(q5 + ȵк.а) где ȵк.а — КПД котельного агрегата.
5. Потеря теплоты с физической теплотой удаляемых из топок золы и шлаков Q6(q6) незначительна, и ее следует учитывать только при слоевом и камерном сжигание многозольных видов топлива (типа бурых углей, сланцев), для которых она составляет 1 — 1,5%.
Потери теплоты с горячей золой и шлаком q6, %, рассчитывают по формуле
где ашл — доля золы топлива в шлаке; Сшл — теплоемкость шлака; Тшл — температура шлака.
При факельном сжигании пылевидного топлива ашл = 1 — аун (аун — доля золы топлива, уносимой из топки с газами).
Для слоевых топок асл шл = ашл + апр (апр — доля золы топлива в «провале»). При сухом шлакоудалении температура шлака принимается Тш = 870 К.
При жидком шлакоудалении, которое наблюдается иногда при факельном сжигании пылевидного топлива Тшл = Тзол + 100 К (Тзол — температура золы в жидкоплавком состоянии). При слоевом сжигании горючих сланцев к зольности Aр вводится поправка на содержание углекислоты карбонатов, равная 0,3 (СО2), т.е. зольность принимается равной АР + 0,3 (СО2) р /к. Если удаляемый шлак находится в жидком состоянии, то значение величины q6 достигает 3%.
В печах и сушилках, применяемых в промышленности строительных материалов, помимо рассмотренных потерь теплоты приходится учитывать также потери на прогрев транспортных устройств (например, вагонеток), на которых материал подвергается тепловой обработке. Эти потери могут доходить до 4% и более.
Таким образом, КПД «брутто» может быть определен как
Теплоту, воспринятую вырабатываемым продуктом (пар, вода), обозначим Qк.a, кВт, тогда имеем:
для паровых котлов
для водогрейных котлоагрегатов
Где D — производительность котла, кг/с; iп.п — энтальпия перегретого пара (если котел вырабатывает насыщенный пар, то вместо iп.в следует поставить (iпн) кДж/кг; iп.в — энтальпия питательной воды, кДж/кг; р — количество воды, удаляемой из котлоагрегата с целью сохранения допустимого содержания солей в котловой воде (так называемая непрерывная продувка котла), %; i — энтальпия котловой воды, кДж/кг; Мв — расход воды через котлоагрегат,кг/с; ср.в — теплоемкость воды, кДж/(кгК); Tвых — температура горячей воды на выходе из котла; Твх — температура воды на входе в котел.
Расход топлива В, кг/с или м 3 /с, определяют по формуле
Объем продуктов сгорания (см. § 18.5) определяют без учета потери от механического недожога. Поэтому дальнейший расчет котельного агрегата (теплообмен в топке, определение площади поверхностей нагрева в газоходах, воздухоподогревателя и экономайзера) осуществляется по расчетному количеству топлива Вр:
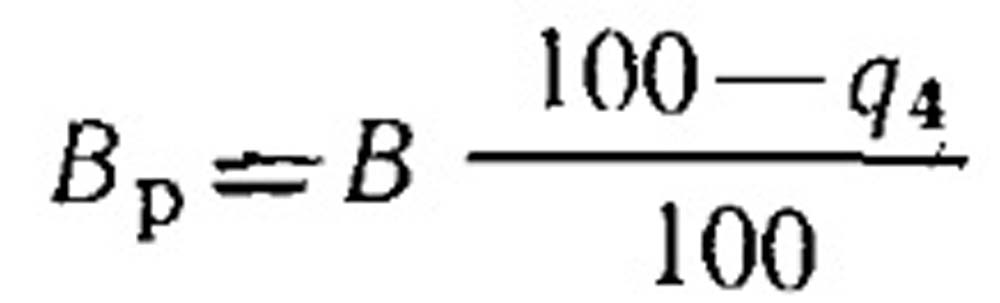
При сжигании газа и мазута Вр = В.
🔍 Видео
Урок 175. Уравнение теплового балансаСкачать

10 класс, 11 урок, Уравнение теплового баланса с учетом изменения агрегатного состояния веществаСкачать

Закон сохранения превращения энергии в тепловых процессах. 8 класс.Скачать

Урок 113 (осн). Задачи на уравнение теплового балансаСкачать

Теплообмен. Уравнение теплового баланса 8-10 класс | Физика TutorOnlineСкачать

Уравнение теплового балансаСкачать

Количество теплоты, удельная теплоемкость вещества. 8 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Урок 176. Задачи на уравнение теплового балансаСкачать

Физика 8 класс : Расчет количества теплоты сгорания топливаСкачать

ИЗИ Физика. Уравнение теплового баланса. Фазовые переходыСкачать

Удельная теплота сгорания топлива. Видеоурок 9. Физика 8 классСкачать