Ключевые слова конспекта: количество теплоты, уравнение теплового баланса, закон сохранения энергии в тепловых процессах.
Для механических явлений при определённых условиях выполняется закон сохранения механической энергии: полная механическая энергия системы тел сохраняется, если они взаимодействуют силами тяготения или упругости. Если действуют силы трения, то полная механическая энергия тел не сохраняется, часть её (или вся) превращается в их внутреннюю энергию.
При изменении состояния тела (системы) меняется его внутренняя энергия. Состояние тела и соответственно его внутреннюю энергию можно изменить двумя способами: в процессе теплопередачи или путём совершения внешними силами работы над телом (работа, например, силы трения). Мерой изменения внутренней энергии тела в процессе теплообмена выступает количество теплоты (Q).
- Уравнение теплового баланса
- Qотданное + Qполученное = 0
- Закон сохранения энергии в тепловых процессах
- Тепловое равновесие и уравнение теплового баланса
- Что такое теплообмен и при каких условиях он происходит
- Уравнение теплового баланса и сохранение тепловой энергии
- Уравнение теплового баланса
- Если несколько тел участвуют в процессе теплообмена
- Пример расчетов для теплообмена между холодным и горячим телом
- Задача для самостоятельного решения:
- Закон сохранения энергии в тепловых процессах. Преобразование энергии в тепловых машинах
- ПРИМЕРЫ ЗАДАНИИ
- Часть 1
- 🌟 Видео
Уравнение теплового баланса
В изолированной системе при смешивании горячей и холодной воды, количество теплоты Q1, отданное горячей водой, равно количеству теплоты Q2, полученному холодной водой, т.е.: |Q1|= |Q2| . Q1 (выделенное) 0.
Qотданное + Qполученное = 0
Записанное равенство называется уравнением теплового баланса (эта формула и уравнение, используемое в 8 классе!). Определение: суммарное количества теплоты, которое выделяется в теплоизолированной системе равно суммарному количеству теплоты, которое в этой системе поглощается.
Уравнение теплового баланса связывает количество теплоты, полученное одним телом, и количество теплоты, отданное другим телом при теплообмене. При этом в теплообмене могут участвовать не два тела, а три и более: Q1 + Q2 + Q3 + … = 0
Уравнение теплового баланса – это закон сохранения энергии для процессов теплообмена в термоизолированных системах. Оно даёт возможность определить те или иные величины. В частности, значения удельной теплоёмкости веществ определяют из уравнения теплового баланса.
◊◊◊ Обратите внимание! В более старших классах используется следующее определение «уравнения теплового баланса»: Если в изолированной системе тел не происходит никаких превращений энергии кроме теплообмена, то количество теплоты, отданное телами, внутренняя энергия которых уменьшается, равно количеству теплоты, полученному телами, внутренняя энергия которых увеличивается. При этом суммарная энергия системы не изменяется«. А также используется другая формула уравнения (с учетом интегральной формы Первого начала термодинамики):
Закон сохранения энергии в тепловых процессах
Закон сохранения энергии в тепловых процессах выполняется при нагревании тел за счёт энергии, выделяющейся при сгорании топлива. Топливо — это природный газ, дрова, уголь, нефть. При его сгорании происходит химическая реакция окисления — атомы углерода соединяются с атомами кислорода, содержащимися в воздухе, и образуется молекула оксида углерода (углекислого газа) С02. При этом выделяется энергия.
При сгорании различного топлива одинаковой массы выделяется разное количество теплоты. Например, хорошо известно, что природный газ является энергетически более выгодным топливом, чем дрова. Это значит, что для получения одного и того же количества теплоты, масса дров, которые нужно сжечь, должна быть существенно больше массы природного газа. Следовательно, различные виды топлива с энергетической точки зрения характеризуются величиной, называемой удельной теплотой сгорания топлива.
Конспект урока «Уравнение теплового баланса».
Видео:Закон сохранения превращения энергии в тепловых процессах. 8 класс.Скачать

Тепловое равновесие и уравнение теплового баланса
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Видео:Физика. Объяснение темы "Закон сохранения внутренней энергии и уравнение теплового баланса"Скачать

Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
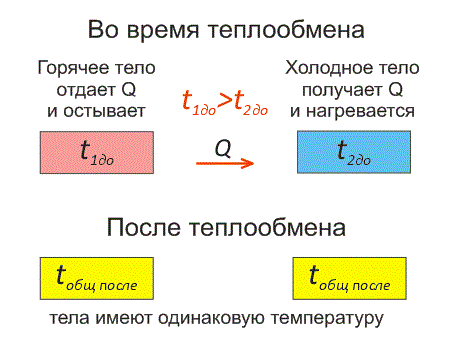
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Видео:Урок 112 (осн). Уравнение теплового балансаСкачать

Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
(large Q_<text> left( text right) ) – это количество теплоты горячее тело теряет.
(large Q_<text> left( text right) ) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
[large Q_ + Q_ = 0 ]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
[large boxed < Q_+ Q_ + Q_ + ldots + Q_ = 0 > ]
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Видео:89 НЕ ЗНАЮТ этого в Физике: Что такое Количество Теплоты, Теплоемкость, Уравнение Теплового БалансаСкачать

Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
2). Теперь запишем формулу для каждого количества теплоты:
Примечания:
- (large c_<text> ) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность (large (t_<text> — t_<text> ) ) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность (large (t_<text> — t_<text> ) ) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
4). Для удобства, заменим символы числами:
[large 4200 cdot 0,2 cdot (t_<text> — 80 ) + 4200 cdot 0,1 cdot (t_<text> — 15 ) = 0 ]
[large 840 cdot (t_<text> — 80 ) + 420 cdot (t_<text> — 15 ) = 0 ]
Раскрыв скобки и решив это уравнение, получим ответ:
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- (large Q_ ) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- (large Q_ ) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- (large Q_ ) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Видео:Закон сохранения и превращения энергии в тепловых процессах. Практ. часть - решение задачи. 8 класс.Скачать
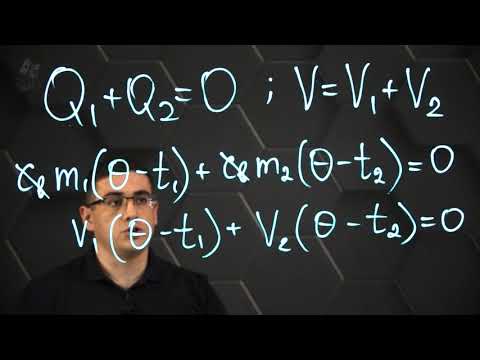
Закон сохранения энергии в тепловых процессах. Преобразование энергии в тепловых машинах
1. Для механических явлений при определённых условиях выполняется закон сохранения механической энергии: полная механическая энергия системы тел сохраняется, если они взаимодействуют силами тяготения или упругости. Если действуют силы трения, то полная механическая энергия тел не сохраняется, часть её (или вся) превращается в их внутреннюю энергию.
При изменении состояния тела (системы) меняется его внутренняя энергия. Состояние тела и соответственно его внутреннюю энергию можно изменить двумя способами: в процессе теплопередачи или путём совершения внешними силами работы над телом (работа, например, силы трения).
2. При решении задачи в предыдущем параграфе получено, что количество теплоты ( Q_1 ) , отданное горячей водой, равно количеству теплоты ( Q_2 ) , полученному холодной водой, т.е.: ( Q_1=Q_2 ) .
Записанное равенство называется уравнением теплового баланса. Оно связывает количество теплоты, полученное одним телом, и количество теплоты, отданное другим телом при теплообмене. При этом в теплообмене могут участвовать не два тела, а три и более. Например, если в стакан с горячим чаем опустить ложку, то в теплообмене будут участвовать стакан и чай (отдают энергию), и ложка и окружающий воздух (получают энергию). Как уже указывалось, в конкретных задачах мы можем пренебречь количеством теплоты, получаемым или отдаваемым некоторыми телами при теплообмене.
3. Уравнение теплового баланса даёт возможность определить те или иные величины. В частности, значения удельной теплоёмкости веществ определяют из уравнения теплового баланса.
Задача. Определите удельную теплоёмкость алюминия, если при опускании в стакан, содержащий 92 г воды при 75 °С, алюминиевой ложки массой 42 г при температуре 20 °С в стакане установилась температура 70 °С. Потерями энергии на нагревание воздуха, а также энергией, отдаваемой стаканом, пренебречь.
Анализ задачи. В теплообмене участвуют два тела: горячая вода и алюминиевая ложка. Вода отдаёт количество теплоты ( Q_1 ) и остывает от 75 до 70 °С. Алюминиевая ложка получает количество теплоты ( Q_2 ) и нагревается от 20 до 70 °С. Количество теплоты ( Q_1 ) , отданное горячей водой, равно количеству теплоты ( Q_2 ) , полученному ложкой.
Решение задачи в общем виде: уравнение теплового баланса: ( Q_1=Q_2 ) ; количество теплоты, отданное горячей водой: ( Q_1=c_1m_1(t_1-t) ) ; количество теплоты, полученное алюминиевой ложкой: ( Q_2=c_2m_2(t-t_2) ) . С учётом этого уравнение теплового баланса: ( c_1m_1(t_1-t)=c_2m_2(t-t_2) ) . Откуда: ( c_2=c_1m_1(t_1-t)/m_2(t-t_2) ) .
4. Закон сохранения энергии в тепловых процессах выполняется при нагревании тел за счёт энергии, выделяющейся при сгорании топлива. Топливо — это природный газ, дрова, уголь, нефть. При его сгорании происходит химическая реакция окисления — атомы углерода соединяются с атомами кислорода, содержащимися в воздухе, и образуется молекула оксида углерода (углекислого газа) СO2. При этом выделяется энергия.
При сгорании различного топлива одинаковой массы выделяется разное количество теплоты. Например, хорошо известно, что природный газ является энергетически более выгодным топливом, чем дрова. Это значит, что для получения одного и того же количества теплоты, масса дров, которые нужно сжечь, должна быть существенно больше массы природного газа. Следовательно, различные виды топлива с энергетической точки зрения характеризуются величиной, называемой удельной теплотой сгорания топлива.
Удельная теплота сгорания топлива — физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг.
Удельная теплота сгорания топлива обозначается буквой ( q ) , её единицей является 1 Дж/кг.
Значение удельной теплоты сгорания топлива определяют экспериментально. Наибольшую удельную теплоту сгорания имеет водород, наименьшую — порох.
Удельная теплота сгорания, например, нефти — 4,4·10 7 Дж/кг. Это означает, что при полном сгорании 1 кг нефти выделяется количество теплоты 4,4·10 7 Дж.
В общем случае, если масса топлива равна ( m ) , то количество теплоты ( Q ) , выделяющееся при его полном сгорании, равно произведению удельной теплоты сгорания топлива ( q ) на его массу ( m ) :
5. Предположим, что внутреннюю энергию тела ( U ) изменили, совершив над ним работу ( A ) и сообщив ему некоторое количество теплоты ( Q ) . В этом случае изменение внутренней энергии ( U ) равно сумме работы ( A ) , совершённой над телом, и переданного ему количества теплоты ( Q ) :
Записанное выражение представляет собой первый закон термодинамики 1 , который является обобщением закона сохранения энергии. Он формулируется следующим образом: изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме работы, совершённой над системой внешними силами, и количества теплоты, переданного системе.
1 Термодинамика — учение о тепловых процессах.
Предположим, что работу совершают не внешние силы, а само тело. Его работа в этом случае ( A^=-A ) и ( Q=U+A^ ) . Количество теплоты, переданное телу, идет на изменение его внутренней энергии и на работу тела против внешних сил.
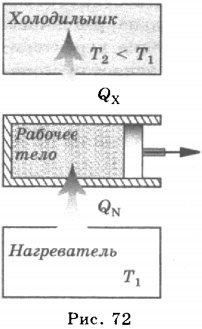
6. Устройства, совершающие механическую работу за счёт внутренней энергии топлива, называются тепловыми двигателями.
Любой тепловой двигатель состоит из нагревателя, холодильника и рабочего тела (рис. 72). В качестве рабочего тела используются газ или пар, поскольку они хорошо сжимаются, и в зависимости от типа двигателя может быть топливо (бензин, керосин), водяной пар и пр. Нагреватель передаёт рабочему телу некоторое количество теплоты ( (Q_1) ) , и его внутренняя энергия увеличивается, за счет этой внутренней энергии совершается механическая работа ( (A) ) , затем рабочее тело отдаёт некоторое количество теплоты холодильнику ( (Q_2) ) и охлаждается при этом до начальной температуры. Описанная схема представляет цикл работы двигателя и является общей, в реальных двигателях роль нагревателя и холодильника могут выполнять различные устройства. Холодильником может служить окружающая среда.
Поскольку в двигателе часть энергии рабочего тела передается холодильнику, то понятно, что не вся полученная им от нагревателя энергия идет на совершение работы. Соответственно, коэффициент полезного действия двигателя (КПД) равен отношению совершенной работы ( (A) ) к количеству теплоты, полученному им от нагревателя ( (Q_1) ) :
Коэффициент полезного действия обычно выражают в процентах.
7. Существует два типа двигателей внутреннего сгорания (ДВС): карбюраторный и дизельный. В карбюраторном двигателе рабочая смесь (смесь топлива с воздухом) готовится вне двигателя в специальном устройстве и из него поступает в двигатель. В дизельном двигателе горючая
смесь готовится в самом двигателе.
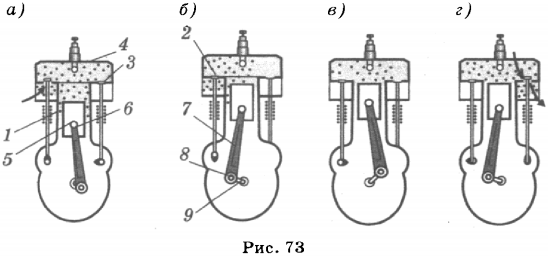
ДВС (рис. 73) состоит из цилиндра (1), в котором перемещается поршень (5); в цилиндре имеются два клапана (2, 3), через один из которых горючая смесь впускается в цилиндр, а через другой отработавшие газы выпускаются из цилиндра. Поршень с помощью кривошипно-шатунного механизма (6, 7) соединяется с коленчатым валом, который приходит во вращение при поступательном движении поршня. Цилиндр закрыт крышкой (4).
Цикл работы ДВС включает четыре такта: впуск, сжатие, рабочий ход, выпуск. Во время впуска поршень движется вниз, давление в цилиндре уменьшается, и в него через клапан поступает горючая смесь (в карбюраторном двигателе) или воздух (в дизельном двигателе). Клапан в это время закрыт (рис. 73 а). В конце впуска горючей смеси закрывается клапан.
Во время второго такта поршень движется вверх, клапаны закрыты, и рабочая смесь или воздух сжимаются (рис. 73 б). При этом температура газа повышается: горючая смесь в карбюраторном двигателе нагревается до 300—350 °С, а воздух в дизельном двигателе — до 500—600 °С. В конце такта сжатия в карбюраторном двигателе проскакивает искра, и горючая смесь воспламеняется. В дизельном двигателе в цилиндр впрыскивается топливо, и образовавшаяся смесь самовоспламеняется.
При сгорании горючей смеси газ расширяется и толкает поршень и соединенный с ним коленчатый вал, совершая механическую работу (рис. 73 в). Это приводит к тому, что газ охлаждается.
Когда поршень придёт в нижнюю точку, давление в нём уменьшится. При движении поршня вверх открывается клапан, и происходит выпуск отработавшего газа (рис. 73 г). В конце этого такта клапан закрывается.
8. Паровая турбина представляет собой насаженный на вал диск, на котором укреплены лопасти. На лопасти поступает пар. Пар, нагретый до 600 °С, направляется в сопло и в нём расширяется, При расширении пара происходит превращение его внутренней энергии в кинетическую энергию направленного движения струи пара. Струя пара поступает из сопла на лопасти турбины и передаёт им часть своей кинетической энергии, приводя турбину во вращение. Обычно турбины имеют несколько дисков, каждому из которых передаётся часть энергии пара. Вращение диска передаётся валу, с которым соединён генератор электрического тока.
Видео:ЕГЭ физика. Уравнение теплового баланса (термодинамика)Скачать

ПРИМЕРЫ ЗАДАНИИ
Часть 1
Для определения удельной теплоты сгорания топлива необходимо знать
1) энергию, выделившуюся при полном сгорании топлива, его объём и начальную температуру
2) энергию, выделившуюся при полном сгорании топлива, и его массу
3) энергию, выделившуюся при полном сгорании топлива, и его плотность
4) удельную теплоёмкость вещества, его массу, начальную и конечную температуры
2. В сосуд налили 1 кг воды при температуре 90 °С. Чему равна масса воды, взятой при 30 °С, которую нужно налить в сосуд, чтобы в нём установилась температура воды, равная 50 °С? Потерями энергии на нагревание сосуда и окружающего воздуха пренебречь.
1) 1 кг
2) 1,8 кг
3) 2 кг
4) 3 кг
3. В воду, взятую при температуре 20 °С, добавили 1 л воды при температуре 100 °С. Температура смеси оказалась равной 40 °С. Чему равна масса холодной воды? Теплообменом с окружающей средой пренебречь.
1) 1 кг
2) 2 кг
3) 3 кг
4) 4 кг
4. В толстостенной трубке быстро сжимают воздух. При этом внутренняя энергия воздуха
1) не изменяется
2) увеличивается
3) уменьшается
4) сначала увеличивается, потом не изменяется
5. Газ получил количество теплоты 300 Дж и совершил работу 100 Дж. Внутренняя энергия газа при этом
1) увеличилась на 400 Дж
2) увеличилась на 200 Дж
3) уменьшилась на 400 Дж
4) уменьшилась на 200 Дж
6. В двигателе внутреннего сгорания
1) внутренняя энергия рабочего тела преобразуется в механическую энергию
2) поршень перемещается за счёт переданного ему количества теплоты
3) механическая энергия поршня превращается во внутреннюю энергию рабочего тела
4) механическая работа совершается за счёт энергии рабочего тела и переданного поршню количества теплоты
7. Двигатель внутреннего сгорания совершает полезную работу при
1) сжатии рабочего тела
2) выпуске отработанного газа из цилиндра
3) впуске рабочего тела в цилиндр
4) расширении рабочего тела в цилиндре
8. Рабочим телом в автомобильном двигателя внутреннего сгорания является
1) воздух
2) бензин
3) горючая смесь, состоящая из воздуха и паров бензина
4) керосин
9. Тепловой двигатель получает за цикл работы от нагревателя количество теплоты 200 Дж и передаёт холодильнику количество теплоты 80 Дж. Чему равен КПД двигателя?
10. Двигатель получает от нагревателя количество теплоты 100 Дж и совершает полезную работу 200 Дж. Чему равен КПД такого двигателя?
1) 200%
2) 50%
3) 20%
4) такой двигатель невозможен
11. Установите соответствие между физическими величинами и их единицами в СИ. К каждой позиции левого столбца подберите соответствующую позицию левого столбца и запишите выбранные цифры под соответствующими буквами
ФИЗИЧЕСКАЯ ВЕЛИЧИНА
A) количество теплоты
Б) удельная теплоёмкость
B) удельная теплота сгорания
ЕДИНИЦА ВЕЛИЧИНЫ
1) Дж/кг
2) Дж
3) Дж/кг °С
12. Установите соответствие между физическими величинами и их возможными изменениями, анализируя следующую ситуацию: «При постоянном давлении газ некоторой массы быстро расширяется. Как при этом изменяются температура газа, его концентрация и внутренняя энергия?» Цифры в ответе могу повторяться. К каждой позиции левого столбца подберите соответствующую позицию левого столбца и запишите выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКАЯ ВЕЛИЧИНА
A) температура газа
Б) концентрация
B) внутренняя энергия
ЕДИНИЦА ВЕЛИЧИНЫ
1) не изменяется
2) увеличивается
3) уменьшается
13. Ударная часть молота массой 10 т свободно падает на стальную деталь массой 200 кг. С какой высоты падает ударная часть молота, если после 32 ударов деталь нагрелась на 20 °С? На нагревание расходуется 25% энергии молота.
🌟 Видео
Урок 175. Уравнение теплового балансаСкачать

Решение задач на уравнение теплового баланса. Физика 8 классСкачать

Урок 113 (осн). Задачи на уравнение теплового балансаСкачать

10 класс, 11 урок, Уравнение теплового баланса с учетом изменения агрегатного состояния веществаСкачать

8 класс, 7 урок, Закон сохранения энергии в тепловых процессахСкачать

Уравнение теплового балансаСкачать

Задача на Тепловой обмен. физика 8 классСкачать

Урок 176. Задачи на уравнение теплового балансаСкачать

Урок 127 (осн). Задачи на уравнение теплового баланса - 1Скачать

Урок 128 (осн). Задачи на уравнение теплового баланса - 2Скачать

ИЗИ Физика. Уравнение теплового баланса. Фазовые переходыСкачать

Теплообмен. Уравнение теплового баланса 8-10 класс | Физика TutorOnlineСкачать

🔴 ЕГЭ-2022 по физике. Уравнение теплового балансаСкачать

уравнение теплового балансаСкачать