В случае, если результатом теплообмена становится передача телу некоего количества теплоты Q , то его температура и внутренняя энергия претерпевают изменения.
Необходимое для нагревания 1 к г вещества на 1 К количество теплоты Q носит название удельной теплоемкости вещества c , а ее формула выглядит следующим образом:
В большом количестве ситуаций удобной для использования является молярная теплоемкость C :
C = M · c , где M представляет собой молярную массу вещества.
Теплоемкость, полученная таким способом, не является однозначной характеристикой вещества. Исходя из первого закона термодинамики, можно сказать, что изменение внутренней энергии тела зависимо не только от количества полученной теплоты, но и от величины совершенной телом работы. В разных условиях осуществления процесса теплопередачи тело может совершать различную работу. Таким образом, переданное телу одинаковое количество теплоты способно провоцировать изменения его внутренней энергии и, соответственно, температуры.
Подобной неоднозначностью при определении теплоемкости характеризуются только газообразные вещества. Объем в процессе нагрева практически не меняет своей величины, что сводит работу расширения к нулю. По этой причине вся полученная телом теплота уходит на изменение его внутренней энергии. Газ в процессе теплопередачи может значительно менять свой объем и совершать работу, чем отличается от твердых тел и жидкостей. Таким образом, теплоемкость газообразного вещества имеет зависимость от характера термодинамического процесса.
Видео:Как расчитать степени свободыСкачать

Изопроцессы в газах
Чаще всего рассматриваются два значения теплоемкости газов:
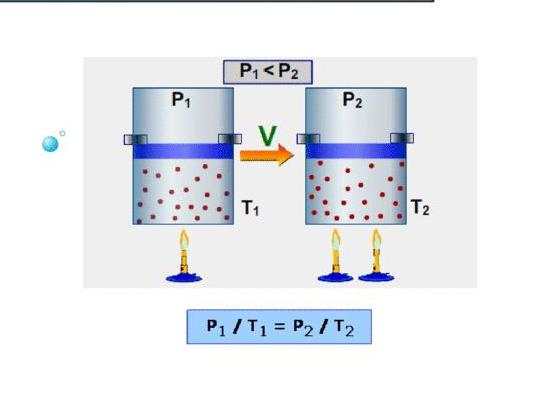
- C V являющаяся молярной теплоемкостью в изохорном процессе ( V = c o n s t ) ;
- C p представляющая собой молярную теплоемкость в изобарном процессе ( p = c o n s t ) .
При условии постоянного объема газ не совершает работы: A = 0 . Исходя из первого закона термодинамики для 1 м о л я газа, можно сказать, что справедливым является следующее выражение:
Q V = C V ∆ T = ∆ U .
Изменение величины Δ U внутренней энергии газа прямо пропорционально изменению значения Δ T его температуры.
В условиях процесса при постоянном давлении первый закон термодинамики дает такую формулу:
Q p = ∆ U + p ( V 2 — V 1 ) = C V ∆ T + p V .
В котором Δ V является изменением объема 1 м о л я идеального газа при изменении его температуры на Δ T . Таким образом, можно заявить, что:
C p = Q p ∆ T = C V + p ∆ V ∆ T .
Из уравнения состояния идеального газа, записанного для 1 м о л я , может выражаться отношение Δ V Δ T :
В котором R представляет собой универсальную газовую постоянную. При условии постоянства давления p = c o n s t , можно записать следующее: p ∆ V = R ∆ T или ∆ V ∆ T = R p .
Из этого следует, что выражающее связь между молярными теплоемкостями C p и C V соотношение имеет вид (формула Майера):
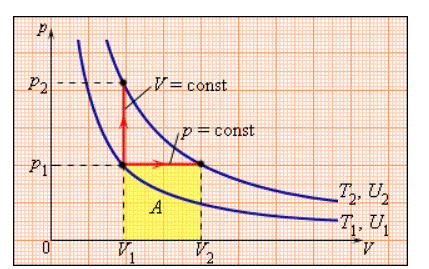
В процессе с неизменным давлением молярная теплоемкость C p газа всегда превышает молярную теплоемкость C V в процессе с не подверженным изменениям объемом, что демонстрируется на рисунке 3 . 10 . 1 .
Рисунок 3 . 10 . 1 . Два возможных процесса нагревания газа на Δ T = T 2 – T 1 . При p = c o n s t газ совершает работу A = p 1 ( V 2 – V 1 ) . Поэтому C p > C V .
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом занимает важное место в термодинамике и обозначается в виде греческой буквы γ .
Данное отношение включено в формулу для адиабатического процесса.
Между двумя изотермами, обладающими температурами T 1 и T 2 на диаграмме ( p , V ) реальны различные варианты перехода. Так как для всех подобных переходов изменение величины температуры Δ T = T 2 – T 1 является одним и тем же, выходит, что изменение значения
Δ U внутренней энергии тоже одинаково. С другой стороны, совершенные при этом работы A и количества теплоты Q , полученные в результате теплообмена, выйдут разными для различных путей перехода. Из этого следует, что газа имеет относительно приближенное к бесконечности число теплоемкостей. C p и C V представляют собой частные, однако, очень важные для теории газов, значения теплоемкостей.
Рисунок 3 . 10 . 2 . Модель теплоемкости идеального газа.
Термодинамические процессы, в которых теплоемкость газа не подвергается изменениям, носят название политропических.
Каждый изопроцесс являются политропическим. В изотермическом процессе Δ T = 0 , из-за чего C T = ∞ . В адиабатическом процессе Δ Q = 0 , выходит, что C а д = 0 .
Стоит обратить внимание на то, что «теплоемкость» и «количество теплоты» являются крайне неудачными терминами, доставшимися современной науке в качестве наследства теории теплорода, которая господствовала в XVIII веке.
Данная теория представляла теплоту в виде содержащегося в телах особого невесомого вещества. Считалось, что оно не подвержено уничтожению и не может быть созданным. Явление нагрева объясняли повышением, а охлаждение – понижением содержания в телах теплорода. Однако теория теплорода оказалась несостоятельной, так как не смогла дать ответа на вопрос, почему одинаковое изменение внутренней энергии тела возможно получить, приводя ему разное количество теплоты в зависимости от совершаемой им работы. По этой причине утверждение, что в данном теле содержится некоторый запас теплорода лишено смысла.
Видео:Теплоемкость. Теплоемкость газа. Молярная теплоемкостьСкачать

Молекулярно-кинетическая теория
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией E → поступательного движения молекул и абсолютной температурой T :
Внутренняя энергия 1 м о л я идеального газа эквивалентна произведению E → на число Авогадро N А :
U = 3 2 k N A T = 3 2 R T .
При условии изменения температуры на величину Δ T внутренняя энергия изменяется на величину:
U = 3 2 R ∆ T = C V ∆ T .
Коэффициент пропорциональности между Δ U и Δ T эквивалентен теплоемкости C V в условиях постоянного давления:
C V = 3 2 R = 12 , 47 Д Ж / м о л ь · К.
Данное выражение подтверждается экспериментами с газами, которые состоят из одноатомных молекул вроде гелия, неона или аргона. При этом для двухатомных (водород, азот) и многоатомных (углекислый газ) газов такое соотношение не согласуется с полученными в результате опытов данными. Причина этого расхождения заключается в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию как поступательного, так и вращательного их движения.
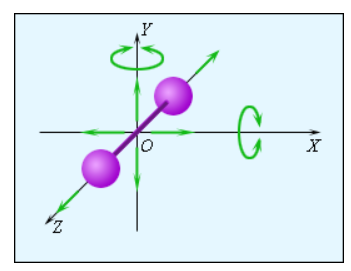
Рисунок 3 . 10 . 3 . Модель двухатомной молекулы. Точка O совпадает с центром масс молекулы.
Рисунок 3 . 10 . 3 иллюстрирует модель двухатомной молекулы. Молекула имеет возможность производить пять независимых типов движений: три поступательных движения вдоль осей X , Y , Z и два вращения относительно осей X и Y .
Опытным путем выяснено, что вращение относительно оси Z , на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких значениях температуры. В условиях обычных температур вращение вокруг оси Z не происходит.
Каждое независимое движение в молекуле носит название степени свободы.
Выходит, что одноатомная молекула обладает 3 поступательными степенями свободы, «жесткая» двухатомная молекула 5 степенями, то есть 3 поступательными и 2 вращательными, а многоатомная молекула 6 степенями свободы, из которых 3 приходятся на поступательные и 3 на вращательные.
В классической статистической физике доказывается теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T , то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 1 2 k T .
Из данной теоремы следует, что для молярных теплоемкостей газа C p и C V и их отношения
γ справедлива запись в следующем виде:
C V = i 2 R , C p = C v + R = i + 2 2 R , γ = C p C V = i + 2 i ,
где i представляет собой количество степеней свободы газа.
Для газа, состоящего из одноатомных молекул ( i = 3 )
C V = 3 2 R , C p = C v + R = 5 2 R , γ = C p C V = 5 3 = 1 , 66 .
Для газа, состоящего из двухатомных молекул ( i = 5 )
C V = 5 2 R , C p = C v + R = 7 2 R , γ = C p C V = 7 5 = 1 , 4 .
Для газа, состоящего из многоатомных молекул ( i = 6 )
C V = 3 R , C p = C v + R = 4 R , γ = C p C V = 4 3 = 1 , 33 .
В обычных условиях экспериментально измеренные теплоемкости многих газов неплохо согласуются с приведенными выражениями, но в целом классическая теория теплоемкости газов вполне удовлетворительной не является. Существует колоссальное число примеров со значительной разницей между результатами эксперимента и теорией. Данный факт объясняется тем, что классическая теория не может полностью учесть, связанную с внутренними движениями в молекуле энергию.
Теорема о равномерном распределении энергии по степеням свободы может быть применена и по отношению к тепловому движению частиц в твердом теле. Входящие в состав кристаллической решетки атомы колеблются около положений равновесия. Энергия данных колебаний представляет собой внутреннюю энергию твердого тела. Каждый конкретный атом может колебаться в кристаллической решетке в трех взаимно перпендикулярных направлениях. Выходит, что каждый атом имеет 3 колебательные степени свободы. При условии гармонических колебаний средняя кинетическая энергия эквивалентна средней потенциальной энергии. По этой причине в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия k T , а на один атом – 3 k T .
Внутренняя энергия 1 м о л я твердого вещества равна следующему выражению:
U = 3 R N A k t = 3 R t .
Следовательно, молярная теплоемкость вещества в твердом состоянии равняется:
С = 3 R = 25 , 12 Д ж / м о л ь · К .
Данное выражение носит название закона Дюлонга–Пти. Для твердых тел почти нет различия между C p и C V по причине пренебрежительно малой работы при сжатии или расширении.
Опыт показывает, что молярная теплоемкость у многих твердых тел (химических элементов) при обычных температурах на самом деле близка к 3 R . При этом, в условиях низких температур заметны довольно сильные расхождения между теорией и экспериментом. Таким образом, гипотеза о равномерном распределении энергии по степеням свободы может считаться лишь приближением. Заметная в опыте зависимость теплоемкости от температуры объясняется только при условии использования квантовых представлений.
Видео:4 Лекция 16 Степени свободы и теплоемкостьСкачать

Изохорная теплоемкость идеального газа
В термодинамике при изучении переходов из начального в конечное состояние некоторой системы важно знать тепловой эффект процесса. С этим эффектом тесно связано понятие теплоемкости. В данной статье рассмотрим вопрос, что понимают под изохорной теплоемкостью газа.
Видео:Физика. Термодинамика: Внутренняя энергия идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Идеальный газ
Идеальным называется такой газ, частицы которого считаются материальными точками, то есть не имеют размеров, но обладают массой, и у которого вся внутренняя энергия состоит исключительно из кинетической энергии движения молекул и атомов.
Любой реальный газ в идеале никогда не будет удовлетворять описанной модели, поскольку его частицы все же имеют некоторые линейные размеры и взаимодействуют между собой с помощью слабых ван-дер-ваальсовых связей или химических связей другого типа. Однако при низких давлениях и высоких температурах расстояния между молекулами велики, а их кинетическая энергия превышает потенциальную в десятки раз. Все это позволяет применять с высокой степенью точности идеальную модель для реальных газов.
Видео:число степеней свободыСкачать

Внутренняя энергия газа
Внутренняя энергия любой системы — это физическая характеристика, которая равна сумме потенциальной и кинетической энергии. Поскольку в идеальных газах можно пренебречь потенциальной энергией, то для них можно записать равенство:
Где Ek — энергия кинетическая системы. Используя молекулярно-кинетическую теорию и применяя универсальное уравнение состояния Клапейрона-Менделеева, несложно получить выражение для U. Оно записано ниже:
Здесь T, R и n — абсолютная температура, газовая постоянная и количество вещества соответственно. Величина z — это целое число, показывающее количество степеней свободы, которыми обладает молекула газа.
Видео:Система с двумя степенями свободыСкачать

Изобарная и изохорная теплоемкость
В физике теплоемкостью называется количество теплоты, которое необходимо предоставить изучаемой системе, чтобы нагреть ее на один кельвин. Справедливо также и обратное определение, то есть теплоемкость — это количество теплоты, которое система выделяет при охлаждении на один кельвин.
Проще всего для системы определить изохорную теплоемкость. Под ней понимают теплоемкость при постоянном объеме. Поскольку система в таких условиях работу не совершает, то вся энергия расходуется на повышение внутренних энергетических запасов. Обозначим изохорную теплоемкость символом CV, тогда можно записать:
То есть изменение внутренней энергии системы прямо пропорционально изменению ее температуры. Если сравнить это выражение, с записанным в предыдущем пункте равенством, то приходим к формуле для CV в идеальном газе:
Данной величиной на практике неудобно пользоваться, поскольку она зависит от количества вещества в системе. Поэтому было введено понятие удельной изохорной теплоемкости, то есть величины, которую рассчитывают либо на 1 моль газа, либо на 1 кг. Обозначим первую величину символом CV n , вторую — символом CV m . Для них можно записать такие формулы:
Здесь M — молярная масса.
Изобарной называется теплоемкость при поддержании постоянного давления в системе. Примером такого процесса является расширение газа в цилиндре под поршнем при его нагревании. В отличие от изохорного, во время изобарного процесса подводимое к системе тепло расходуется на повышение внутренней энергии и на выполнение механической работы, то есть:
Энтальпия изобарного процесса представляет собой произведение изобарной теплоемкости на изменение температуры в системе, то есть:
Если рассмотреть расширение при постоянном давлении 1 моль газа, то первое начало термодинамики запишется в виде:
Последнее слагаемое получено из уравнения Клапейрона-Менделеева. Из этого равенства следует связь между изобарной и изохорной теплоемкостями:
Для идеального газа удельная молярная теплоемкость при постоянном давлении всегда больше соответствующей изохорной характеристики на величину R=8,314 Дж/(моль*К).
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Степени свободы молекул и теплоемкость
Выпишем еще раз формулу для удельной молярной изохорной теплоемкости:
В случае газа одноатомного величина z = 3, поскольку атомы в пространстве могут перемещаться лишь в трех независимых направлениях.
Если же речь идет о газе, состоящем из двухатомных молекул, например, кислород O2 или водород H2, то, помимо поступательного движения, эти молекулы могут еще вращаться вокруг двух взаимно перпендикулярных осей, то есть z будет равно 5.
В случае более сложных молекул для определения CV n следует использовать z=6.
Видео:Количество теплоты, удельная теплоемкость вещества. 8 класс.Скачать

Теплоемкость идеального газа.
Для характеристики макроскопических тепловых свойств систем пользуются особым параметром – теплоёмкостью системы.
Теплоёмкость C термодинамической системы численно равна количеству теплоты dQ, которое необходимо передать системе (или отвести от неё), чтобы изменить её температуру T на 1 К (или 1 °С); точнее – это отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению:
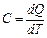 , , | (1) |
где dQ – переданное системе количество теплоты, dT – бесконечно малое изменение температуры.
Удельной теплоёмкостью вещества c называется величина, равная количеству теплоты, которую необходимо сообщить единице массы вещества для увеличения ее температуры на 1 К:
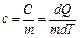 , , | (2) |
Для газов удобно пользоваться молярной теплоёмкостью Cm – количеством теплоты, необходимым для нагревания одного моля данного вещества на 1 К:
 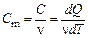 → Cm = cμ, → Cm = cμ, | (3) |
где µ – молярная масса вещества; 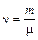
Молярная теплоёмкость в системе СИ измеряется в Дж·моль –1 ·К –1 (в дальнейшем молярную теплоемкость будем обозначать С).
Теплоёмкость газов зависит от строения молекулы данного газа – числа атомов в молекуле и их взаимного расположения, т. е. от количества степеней свободы данной молекулы. С другой стороны, теплоемкость зависит от типа термодинамического процесса.
Число степеней свободы i в механике – это число независимых координат, определяющих положение механической системы в пространстве, причем таких, по которым элементы системы могут двигаться. Например, поршень в цилиндре может двигаться только по оси цилиндра, поэтому у него одна степень свободы. В соответствии с характером этого движения различают поступательные, вращательные и колебательные степени свободы.
При определении числа степеней свободыдлямолекулыее можно рассматривать как систему материальных точек – атомов.
Для одноатомной молекулы i = 3 (три поступательные степени свободы, соответствующие перемещениям вдоль осей X, Y и Z).
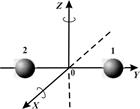 |
| Рис. 1. Модель молекулы двухатомного газа |
Для двухатомной молекулы (например, N2 или H2) с жёсткой внутренней связью между атомами, т. е. при неизменном расстоянии между атомами вдоль оси Y, i = 5 (три поступательные степени свободы её центра инерции и две вращательные, соответствующие вращениям вокруг осей X и Z). Вращение вокруг оси Y для такой модели молекулы не приводит ни к каким изменениям.
Для трёхатомной молекулы с жёсткими связями i = 6 (три поступательных и три вращательных степени свободы).
В классической статистической физике показано (закон равнораспределения энергии по степеням свободы), что на каждую степень свободы приходится в среднем энергия 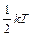
Для молекул с упругой связью между атомами необходимо учесть колебательные степени свободы. Так как колебательное движение характеризуется наличием и потенциальной, и кинетической энергий, средние значения которых равны, то на каждую колебательную степень свободы в среднем приходится энергия в 2 раза больше. Однако при обычных (комнатных) температурах колебательные степени свободы не вносят вклад в теплоёмкость многоатомного газа, они выключены («заморожены»), так как могут возбуждаться лишь при достаточно высоких температурах.
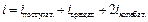 . . | (4) |
Таким образом, средняя энергия E молекулы равна:
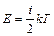 , , | (5) |
где i – сумма возможных степеней свободы молекулы; k – постоянная Больцмана; T – температура.
В соответствии с первым началом термодинамики количество теплоты dQ, подводимое к газу, может расходоваться на увеличение внутренней энергии газа dU и на совершение термодинамической работы dA при расширении газа:
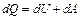 . . | (6) |
Увеличение внутренней энергии идеального газа в случае изменения его температуры на dT рассчитывается по формуле:
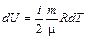 . . | (7) |
где R – универсальная газовая постоянная (R ≈ 8,31 10 3 Дж·кмоль –1 ·К –1 ).
При расширении газа система выполняет работу dA:
| dA = pdV. | (8) |
Величина теплоёмкости существенно зависит от того, при каких условиях нагревался газ.
1. Изохорический процесс, протекающий при постоянном объёме системы, V = const. В этом случае работа по расширению газа отсутствует (ΔV =0, поэтому A = pΔV = 0) и dQ = dU, следовательно, молярная теплоёмкость газа при постоянном объёме CV:
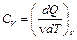 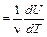 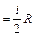 | (9) |
2. Изобарический процесс, протекающий при постоянном давлении системы, p = const. В этом случае работа не равна нулю.
Тогда 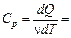 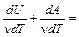 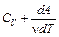 . . | (10) |
где Cp – молярная теплоёмкость газа при постоянном давлении.
Итак, при нагревании при постоянном давлении часть теплоты идёт на производство работы расширения тела, а часть – на увеличение его внутренней энергии, тогда как при нагревании при постоянном объёме вся теплота расходуется на увеличение внутренней энергии, и Cp всегда больше, чем CV.
Используя уравнение состояния идеального газа (уравнение Менделеева–Клапейрона):
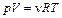 , , | (11) |
можно показать, что для одного моля газа:
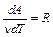 . . | (12) |
Поэтому уравнение (10) можно переписать в виде формулы Мáйера:
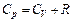 , , | (13) |
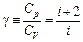 . . | (14) |
Величина γ имеет самостоятельный смысл в термодинамике, она входит в уравнение описывающие адиабатический процесс — уравнение Пуассóна, называется показателем адиабаты или коэффициентом Пуассóна.
Адиабатический процесс —это процесс, протекающий без теплообмена системы с окружающей средой, dQ = 0. На практике адиабатическими процессами являются те процессы, которые протекают очень быстро, и теплообмен с окружающей средой не успевает произойти, или же процессы, протекающие в системах, находящихся в термостате (например в термосе). Уравнение адиабаты:
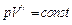 | (15) |
Это — уравнение Пуассона. С учетом уравнения Клапейрона — Менделеева уравнение можно переписать, используя другие параметры состояния идеального газа (всюду ν =const):
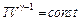 | (16) |
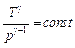 | (17) |
как видно из (14), γ для любого идеального газа зависит только от числа степеней свободы его молекул.
Табл. 1. Число степеней свободы для некоторых молекул
| Молекула | Связь между атомами | Число степеней свободы | i | Cp/CV |
| Пост. | Вр. | Кол. | ||
| Одноатомная | — | 1,67 | ||
| Двухатомная | Жёсткая | 1,40 | ||
| Упругая | 1,29[1] | |||
| Трёхатомная | Жёсткая | 1,33 |
Впервые измерение отношения теплоёмкостей для газов было осуществлено французскими химиками Н. Клемáном и Ш. Дезóрмом в 1819 г, метод основывается на изучении параметров некоторой массы газа, переходящей из одного состояния в другое двумя последовательными процессами – адиабатическим и изохорическим.
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ГАЗОВ МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ (МЕТОДОМ КЛЕМАНА И ДЕЗОРМА)
Цели и задачи работы
1. Изучение термодинамических процессов в воздухе.
2. Определение показателя адиабаты γ для воздуха адиабатическим методом Клемана и Дезорма.
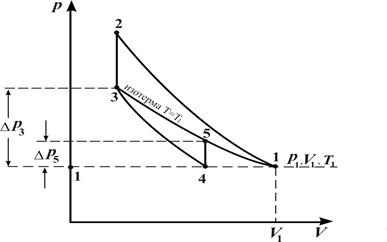
| Рис. 9.1. pV-диаграмма процессов в газе: 3-4 – адиабатический процесс; 2-3 и 4-5 – изохорические процессы |
Выделим мысленно в сосуде некоторую порцию газа (ν молей), и в дальнейшем будем рассматривать изменения происходящие только с этой порцией.
Исходное состояние 1 характеризуется параметрами p1, V1 и T1, где p1 — атмосферное давление, T1 – комнатная температура.
Накачаем в сосуд воздух (процесс 1-2). При этом газ в сосуде сожмётся и нагреется (состояние 2).
После отключения сосуда от насоса (перекрывания крана) газ будет остывать до комнатной температуры при постоянном объеме (изохорический процесс 2-3). Соответственно примет объем V3 (V3= V2), и температуру Т3 (Т3 =Т1). в состоянии 3 давление p3 установится больше атмосферного на Δp3. Последняя величина определяется по разности уровней подкрашенной жидкости h1 в коленах манометра М.
Если теперь на короткое время соединить баллон с атмосферой, то произойдёт быстрое, а, следовательно, адиабатическое расширение воздуха (процесс 3-4). При этом давление понизится до атмосферного p4 = p1. Рассматриваемая масса воздуха, займет объём V4. При этом температура воздуха понизится до Т4
Дата добавления: 2016-04-19 ; просмотров: 1968 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
💡 Видео
Количество теплоты, удельная теплоемкость вещества. Практическая часть - решение задачи. 8 класс.Скачать

Урок 151. Средняя кинетическая энергия молекул многоатомного газаСкачать

Теплоемкость газовСкачать

Рассмотрение темы: "Теплоёмкость газов"Скачать

29. Адиабатический процесс. Уравнение ПуассонаСкачать

Лекция по физике №8. Распределение Больцмана. Теплоёмкость, Уравнение адиабатического процесса.Скачать

Степени свободы в статистике для дурачковСкачать

Урок 172. Применение 1 закона термодинамики для различных процессовСкачать

Урок 112 (осн). Уравнение теплового балансаСкачать

Рассмотрение темы: "Средняя кинетическая энергия многоатомного газа. Число степеней свободы"Скачать

Галилео. Эксперимент. ТеплоёмкостьСкачать

Удельная теплоемкость. Решение задачи с подробными пояснениямиСкачать