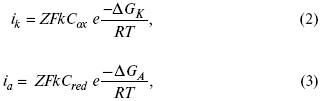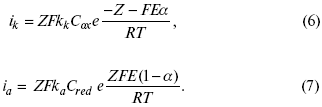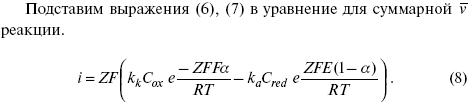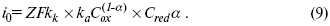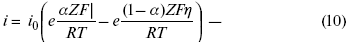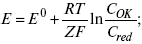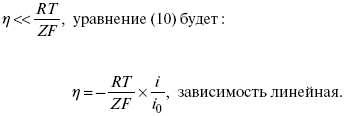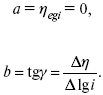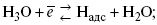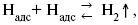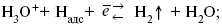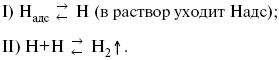При катодной поляризации на электроде через систему протекает ik преимущественно, если поляризация не слишком велика, то суммарная скорость процесса равна:
для реакции (1) катодные и анодные токи будут равны:
где Z – количество электронов, участвующих в реакции;
F – число Фарадея;
к – const скорости;
Сox, Cred – концентрация окислительной и восстановленной форм реагентов;
ΔGK – энергия активации катодного процесса;
ΔGA – энергия активации анодного процесса.
Энергия активации зависит от величины накладываемого потенциала, в то же самое время эта энергия распределяется между прямой и обратной реакцией в соответствии с коэффициентом переноса – а, т. е.
Коэффициент переноса α– доля энергии электрического поля в ДЭС, которая приходится на прямую и обратную реакции.
α– коэффициент переноса для катодной реакции;
(1 – α) – для анодного процесса (коэффициент переноса).
С учетом уравнений (4), (5) уравнения (2), (3) примут следующий вид:
Различие знаков у электрона объясняется тем, что катодная поляризация («–») ускоряет прямую реакцию и замедляет обратную реакцию.
Введем в уравнение (8) плотность тока обмена – i0.
Вместо потенциала введем перенапряжение:
полное уравнение поляризационной кривой.
Вывод из уравнения (10):
1) при равновесном потенциале, когда ток равен нулю, уравнение (10) преобразуется в уравнение Нернста:
2) при малых величинах η:
При сдвижении потенциала от равновесного (59 mВ);
η = a + b ln i– уравнение Тафеля в простом виде при замедлении стадии переноса заряда.
Величина i0 (тока обмена) и α(коэффициента переноса) – основные кинетические параметры стадии переноса заряда (q). Они могут быть определены из экспериментальных измерений, для этого на исследуемом электроде снимают зависимость η– i или Ei – i.
Поляризационная кривая судит о коррозионной стойкости металлов.
Перестраиваем поляризационную кривую в координаты:
Определяем const а и bв уравнении Тафеля, определяем b:
Из коэффициента bнайдем а, после подставим в а и найдем i0.
Перенапряжение Н2 (водорода).
Источник выделения Н2 – Н2SO4 →Н + + НSO4 –
Источник выделения Н2 – Н2О →Н + + ОН — .
2) разряд Н3О + с образованием Надс
3) удаление выделяющегося Надс с поверхности электрода может происходить тремя путями:
а) каталитическая рекомбинация
б) электрохимическая десорбция – удаление Н2 происходит на уже адсорбированных атомах
в) эмиссия включает две стадии:
Для Pt замедлена стадия а), для других металлов (Hg, Pb) – стадия разряда, Н + – самый подвижный.
Дата добавления: 2015-08-08 ; просмотров: 1537 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
- 10 Перенапряжение выделения водорода. Уравнение Тафеля. Теории водородного перенапряжения
- Рекомендуемые файлы
- Кинетика электродных процессов алюминия
- КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ АЛЮМИНИЯ
- Перенапряжение диффузии
- Перенапряжение реакции
- Механизм катодного процесса алюминия
- Похожие страницы:
- Leave a Comment
- 🎦 Видео
Видео:Окислительно восстановительные реакции. Электролиз | Химия 11 класс #19 | ИнфоурокСкачать

10 Перенапряжение выделения водорода. Уравнение Тафеля. Теории водородного перенапряжения
Перенапряжение выделения водорода. Уравнение Тафеля. Теории водородного перенапряжения.
Электролиз может начаться после того, как приложенная извне разность потенциалов достигает величины, равной (вернее, очень незначительно превышающей) разности обратимых потенциалов электродов электрохимической ячейки (потенциалы разряда ионов). Однако во многих случаях для того, чтобы электролиз начался, необходимо приложить к электролитической ванне разность потенциалов, на конечную величину большую, чем разность равновесных потенциалов электродов, образующихся при электролизе. Эта минимальная величина приложенной извне разности потенциалов называется напряжением разложения. То избыточное напряжение, которое необходимо приложить к ванне сверх ее равновесной ЭДС, чтобы начался электролиз, включает в себя, во-первых, перенапряжение на электродах (на катоде и на аноде), а во-вторых, омическое падение напряжения в растворе, соответствующее электросопротивлению этого раствора.
Величина перенапряжения на электроде зависит от природы электрода, плотности тока, состава раствора и др. факторов. Величина перенапряжения различна для разных электрохимических процессов.
В связи с большим практическим значением реакции выделения водорода для ряда технических процессов (электролиз воды, хлорный электролиз, эксплуатация аккумуляторов и гальванических элементов, коррозия) эта электрохимическая реакция изучена наиболее детально.
ЗАКОНОМЕРНОСТИ ПЕРЕНАПРЯЖЕНИЯ ВЫДЕЛЕНИЯ ВОДОРОДА.
1. Влияние плотности тока
Уже в 1905 г. Тафель эмпирически вывел уравнение, которое связывает перенапряжение с плотностью тока, проходящего через раствор, т.е. со скоростью электрохимического процесса :
Видео:Лекция 173 Рекомбинационная теория ТафеляСкачать

Рекомендуемые файлы
h – перенапряжение, В; a и b – константы; i – плотность тока, А/см 2 .
Смысл величины а : а дает значение перенапряжения при i = 1 А/см 2 . Величина а существенно зависит от материала электрода.
Величина b мало зависит от материала электрода и является характеристикой самого электрохимического процесса; в большинстве случаев она приблизительно равна 2×2,303RT/zF , т.е. 0,116 В при z = 1 и комнатной температуре. Это значит, что при увеличении плотности тока в 10 раз h увеличивается на 0,116 В. Однако величина b в ряде случаев может составлять и 0,030 В.
Формула Тафеля соответствует опыту в очень широком интервале величин i; при очень малых i она, естественно, неприменима. В области малых отклонений от равновесного потенциала наблюдается линейная связь между h и i :
2. Влияние природы металла
В зависимости от величины перенапряжения водорода (величины а) металлы можно разбить на 3 группы :
1. Металлы с высоким значением перенапряжения выделения водорода (в кислотах а = 1,2 – 1,55 В) : Pb, Tl, Hg, Cd, Zn, Sn.
2. Металлы со средним значением перенапряжения водорода ( а = 0,5 – 0,8 В) : Cu, Ag, Fe, Co, Ni.
3. Металлы с низким перенапряжением водорода ( а = 0,1 – 0,3 В) : Pt, Pd.
Помимо материала электрода, на величину а влияет состояние его поверхности. Константа а уменьшается при развитии поверхности и при освобождении ее от поверхностных окислов.
Величина b меняется в более узких пределах – от 0,03 до 0,12 В, и только в редких случаях (для технических и окисленных металлов) она больше 0,12. Низкие значения b наблюдаются для металлов с низким перенапряжением (Pt, Pd); для многих металлов, в том числе для всех металлов с высоким перенапряжением b составляет около 0,12 В.
Измерения, проведенные с монокристаллами различных металлов, показали, что h в значительной степени зависит от символа грани монокристалла, на которой катодно выделяется водород. Поэтому величины h, найденные для твердых катодов с поликристаллической структурой, представляют собой некоторые усредненные значения.
Было предпринято много попыток установить связь между перенапряжением водорода на данном металле и каким-либо другим его физическим свойством : каталитической активностью по отношению к реакции рекомбинации атомов водорода, теплотой плавления металла или теплотой его испарения, работой выхода электрона, минимальным межатомным расстоянием в решетке кристалла, коэффициентом сжимаемости и т.п. Было отмечено, например, что чем выше Т плавления, тем ниже h, однако это наблюдение нельзя рассматривать даже как приближенное правило. Найдено, что чем выше каталитическая активность металла по отношению к реакции рекомбинации атомарного водорода, тем ниже на нем перенапряжение водорода. Была также установлена зависимость, существующая между работой выхода электрона и h, между минимальным расстоянием между атомами в металлах и h.
3. Влияние природы и состава раствора
а) Влияние растворителя. Наибольшее число исследований по перенапряжению водорода выполнено с водными растворами. Для ртути и для некоторых др. металлов были получены данные также и в неводных растворах кислот. Характер изменения h с изменением растворителя точно не установлен. Перенапряжение выделения водорода на ртути из раствора HCl в этиловом и метиловом спиртах ниже, чем из водных растворов; для Cu и Ni в спиртовых растворах оно выше, чем в водных. Для металлов с низким h природа растворителя играет меньшую роль.
б) Влияние рН раствора на перенапряжение водорода с наибольшей полнотой изучено на ртути. Установлено, что в растворах чистых кислот в области концентраций до 0,1н h не является функцией рН; при более высоких концентрациях h зависит от рН, уменьшаясь с увеличением концентрации кислоты, причем Dh/DрН составляет примерно 60 мВ. Если растворы кроме кислоты содержат также избыток постороннего электролита, то подобное изменение h с рН наблюдается и для концентраций кислоты, меньших 0,1н. При избытке постороннего электролита такой ход h с рН наблюдается и для разбавленных растворов щелочей. Т.о., максимальное перенапряжение водорода соответствует нейтральным растворам и линейно уменьшается с отклонением рН в ту или иную сторону от точки нейтральности. В концентрированных растворах кислот и оснований соотношение между h и составом раствора становится более сложным. Для других металлов : на Ni h изменяется с рН незначительно и не подчиняется простой линейной зависимости; на Pb и Pt оно почти не зависит от рН раствора.
в) h водорода очень чувствительно к присутствию в электролите посторонних веществ. Добавки солей к разбавленным растворам кислот увеличивают h на ртути, причем увеличение концентрации 1-1 зарядного электролита в 10 раз (при постоянном рН) повышает h примерно на 55–58 мВ. Первоначальная добавка электролита с поливалентным катионом оказывает большее действие, чем такая же добавка 1-1 зарядного электролита. Поверхностно-активные вещества (анионы, катионы и молекулярные вещества) или повышают, или понижают h на ртути, в зависимости от их природы. ПАВ сильнее всего влияют на величину h в области малых плотностей тока; действие этих добавок ослабляется с ростом плотности тока и при высоких ее значениях полностью исчезает. На Pt, Fe и Ni h также возрастает при введении ПАВ; характер влияния ПАВ на h и на этих металлах является функцией потенциала электрода.
4. Влияние температуры и некоторых других факторов
h водорода уменьшается с ростом Т, причем температурный коэффициент зависит от природы металла и плотности тока. Т.к. константа b увеличивается, а константа а уменьшается с ростом Т, то температурный эффект больше выражен в области низких плотностей тока. В среднем (dh/dT)i составляет 1 – 4 мВ/К. Если считать, что полулогарифмическая зависимость сохраняется неизменной до высоких плотностей тока, то, начиная с некоторого значения плотности тока, можно ожидать пересечения полулогарифмических прямых и изменения знака температурного коэффициента перенапряжения.
Зависимость h от давления водорода почти не изучена. Есть данные, что h на ртути и гладкой платине несколько уменьшается при повышении давления.
На h водорода на металлах железной и платиновой групп влияют ультразвуковые колебания. h изменяется под действием светового облучения и потока радиоактивных частиц.
ТЕОРИИ ВОДОРОДНОГО ПЕРЕНАПРЯЖЕНИЯ.
Электрохимические реакции являются сложными процессами с последовательными стадиями, и малая скорость любой из них приводит к нарушению равновесия и появлению перенапряжения. Разряд ионов гидроксония, приводящий к выделению молекулярного водорода, несмотря на простоту суммарного выражения процесса, является сложной электродной реакцией. Рассмотрим стадии этого процесса.
1. Диффузионная стадия. Электрохимический процесс протекает на электроде, поэтому необходима доставка ионов Н3О + к поверхности, что осуществляется за счет переноса ионов и их диффузии. Отметим, что в данном случае эта стадия протекает без существенного торможения.
2. Стадия разряда протона с образованием адсорбированных атомов водорода (собственно электрохимический процесс):
3. Для стационарного протекания электролиза необходимо поддерживать постоянной поверхностную концентрацию атомов водорода, т.е. обеспечивать их непрерывный отвод с поверхности катода. Атомы водорода могут удаляться тремя путями : каталитической рекомбинацией, электрохимической десорбцией и эмиссией. При каталитическом механизме отвод атомов водорода происходит за счет их рекомбинации в молекулы с одновременной десорбцией :
При электрохимической десорбции удаление атомов водорода с поверхности электрода происходит в результате разряда ионов гидроксония на уже адсорбированных атомах :
При эмиссионном механизме адсорбированные атомы водорода испаряются с поверхности электрода в виде свободных атомов
с их последующей объемной рекомбинацией в атомы водорода.
4. Молекулярный водород, образующийся из адсорбированного атомарного водорода, должен удаляться от границы раздела электрод–электролит в газовую фазу (в виде пузырьков газа).
Теории водородного перенапряжения различаются между собой по тому, какая из указанных стадий считается наиболее медленной и, следовательно, лимитирующей скорость общего электрохимического процесса. Некоторые из этих теорий представляют лишь исторический интерес; остановимся на тех, которые сохранили свое значение до настоящего времени.
Критерием правильности той или другой теории являются опытные факты, поэтому справедливость той или иной теории перенапряжения определяется возможностью с помощью этой теории объяснить формулу Тафеля. Однако все основные теории приводят при известных предположениях к формуле Тафеля.
Теория замедленной рекомбинации
Теория выдвинута Тафелем еще в 1905 г. Согласно этой теории наиболее медленной является стадия молизации адсорбированного водорода, поэтому в процессе электролиза концентрация атомарного водорода на поверхности увеличивается по сравнению с равновесной, что и приводит к сдвигу потенциала электрода в отрицательную сторону.
Скорость рекомбинации атомов водорода в молекулы пропорциональна квадрату поверхностной концентрации адсорбированного водорода :

С другой стороны, скорость электрохимического выделения водорода равна :

(Т.к. сила тока I, т.е. количество протекшего в единицу времени электричества, равна произведению числа молей водорода, выделившихся в единицу времени, на zF = 2F:

Если стадия рекомбинации является лимитирующей, то



h = j – jR = 


где [HR] – поверхностная концентрация атомарного водорода на электроде при равновесии этого водорода с молекулярным водородом в газовой фазе.
Подставим в последнее уравнение вместо [H] его значение :
h = 
Т.к. k и HR – постоянные величины, уравнение легко привести к виду
h = а + 
Как видно, уравнение правильно отражает найденную на опыте полулогарифмическую зависимость перенапряжения от силы тока (формула Тафеля). Однако величина b оказывается на основании изложенного вывода равной 0,029 В, а не 0,116, т.е. в 4 раза меньше опытной величины, что являлось серьезным недостатком теории Тафеля.
В дальнейшем эта теория была развита рядом ученых. Кобозев связал замедление молизации водорода с энергией адсорбции водорода металлом. При выводе своего уравнения Тафель не учитывал неоднородности поверхности и наличия отталкивательных сил между адсорбированными атомами. Если это сделать, то значение коэффициента b увеличивается и при некоторых предположениях может достигать 0,116 В. Т.о., основной недостаток теории – малое значение b – может быть устранен.
В рекомбинационной теории впервые было объяснено влияние материала электрода на величину перенапряжения водорода.
Теория замедленного разряда
Согласно этой теории наиболее медленной стадией сложного электрохимического процесса является процесс разряда ионов. Эта теория привлекла должное внимание лишь после работ Эрдей-Груза и Фольмера (1930), предположивших, что разряд ионов требует значительной энергии активации и поэтому может происходить с малой скоростью. Фольмеру удалось вывести уравнение Тафеля. Рассмотрим этот вывод.
Применим к электрическому процессу обычное уравнение для скорости химического процесса :
где Е – энергия активации процесса.
Т.к. скорость электрохимического процесса определяется силой тока
It = zFn ; IDt = zFDn ; v = 
то для силы тока можно написать :
Для раствора постоянного состава получим :
Роль перенапряжения сводится к снижению энергии активации, и величина этого снижения пропорциональна перенапряжению. Положим его равным aFh (a – коэффициент пропорциональности), тогда
где Ео – энергия активации неполяризованного электрода.
Т.о., при наличии перенапряжения
I = k 

ln I = ln k1 +
Решив уравнение относительно h, получим :
h = 

От силы тока I переходим к плотности тока, подставив I = is. Полагая s постоянной, переходя к десятичным логарифмам и обозначая сумму постоянных при данной температуре слагаемых через а, получим формулу Тафеля :
h = а + 

Если a = 0,5, то b = 0,058/а = 0,116. Достоинством теории медленного разряда является то, что она приводит к правильной величине коэффициента b.
Теория медленного разряда в том виде, в каком она была изложена Фольмером, не учитывала строения границы раздела электрод–раствор, потому не могла объяснить влияния состава электролита на величину h. Влияние строения ДЭС на кинетику электрохимических реакций впервые было принято во внимание А.Н.Фрумкиным. Это позволило объяснить большое количество экспериментальных данных о влиянии состава раствора на величину h, а также на кинетику др. электродных процессов, в частности на кинетику реакций электровосстановления анионов.
Ни рекомбинационная теория водородного перенапряжения, ни теория замедленного разряда не являются всеобщей. К металлам с большим перенапряжением (малой энергией адсорбции водорода) – Hg, Pb – применима теория замедленного разряда, которая объясняет большинство явлений, связанных с изменением h. К металлам с малым перенапряжением (большой энергией адсорбции водорода) – Pt – наиболее применима теория рекомбинации.
Возникновение перенапряжения – общее явление для электрохимических процессов. Значительные перенапряжения возникают при электролитическом выделении не только водорода, но и других газов, а также некоторых металлов.
Перенапряжение является проблемой, имеющей не только теоретическое, но и важнейшее практическое значение. Наличие h приводит к тому, что при промышленном электролизе непроизводительно затрачиваются значительные количества электрической энергии. Следовательно, снижение h на электроде – одна из важнейших задач прикладной электрохимии. Решить эту задачу невозможно без установления истинного механизма электрохимического процесса, без установления его лимитирующей стадии. Поэтому задача электрохимической кинетики заключается в нахождении способов увеличения скорости наиболее медленной стадии.
Видео:Электролиз. 10 класс.Скачать

Кинетика электродных процессов алюминия
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ АЛЮМИНИЯ

Электрохимический процесс складывается из нескольких последовательных стадий: транспорта вещества к поверхности электрода, электрохимической реакции восстановления или окисления на электроде и отвода продуктов реакции. В некоторых случаях существенную роль играют химические реакции: гомогенная, протекающая в электролите вблизи поверхности электрода, и гетерогенная — на поверхности электрода. В первом случае в электрохимическую реакцию вступает не то вещество, которое транспортируется к электроду, а продукты его распада или взаимодействия с другими веществами, содержащимися в электролите. Такая реакция предшествует электрохимической стадии. Во втором случае в результате электрохимического разряда получается не конечное вещество, а некоторое промежуточное, адсорбированное электродом. Затем происходит гетерогенная реакция перехода этого вещества в конечный продукт. Иногда приходится учитывать скорости образования новой фазы, появляющейся в результате электрохимической реакции — кристаллов твердого вещества, капель металла и пузырьков газа.
В зависимости от того, какая из этих стадий является лимитирующей, т. е. самой медленной, различают следующие виды поляризации, или перенапряжения (по Феттеру).
Перенапряжение перехода вызвано замедленностью стадии разряда — ионизации. Связь между перенапряжением и плотностью тока описывается уравнением Тафеля:
где С — плотность тока, А/см 2 ; а и b — постоянные. Для анодного процесса
где k1, —константа скорости электрохимического процесса, 1/с; α — коэффициент переноса (кинетический коэффициент), доли. ед.
При электрохимическом процессе потенциальная энергия иона в электролите и конечного продукта на электроде различна. В энергию активации электродной реакции входит не вся разность этих энергий, а только часть ее. Коэффициент переноса й представляет собой отношение этой части энергии к полной энергии.
Для катодного процесса, в котором играет роль концентрация (активность) потенциал-определяющих ионов, константы уравнения Тафеля будут иметь значения:
где С — концентрация ионов, моль/см 3 ; β — коэффициент переноса для катодного процесса, доли ед.
Сумма коэффициентов переноса а и В равна единице и обычно принимается, что α = β =0,5.
Любой электрохимический (и химический) процесс идет как в прямом, так и в обратном направлениях. Чем дальше процесс от равновесного, тем больше прямой процесс преобладает над обратным, и наоборот. При равновесии скорости прямого и обратного процессов равны. Ток обмена и представляет собой скорость электрохимического процесса в прямом и обратном направлениях при равновесном потенциале. Как следует из соотношения , с увеличением тока обмена перенапряжение перехода уменьшается. Если i0»i, то перенапряжение близко к нулю, и процесс можно рассматривать как равновесный (обратимый).
Обычно токи обмена в расплавленных солях велики—от единиц до сотен ампер на квадратный сантиметр, что связано с ускорением процессов при высоких температурах.
Перенапряжение диффузии
Возникает вследствие замедленности переноса реагирующих веществ. Этот перенос может осуществляться молекулярной диффузией, миграцией (переносом под действием электрического поля заряженных частиц — катионов и анионов) и конвекцией (переносом потоком жидкости). Обычно конвекция вызвана выделяющимися на аноде газами. Эффект миграционного переноса удается в значительной степени снизить за счет создания фона, при котором перенос электричества осуществляется другими, неразряжающимися ионами. Именно такой перенос имеет место в алюминиевых электролизерах.
Основным лимитирующим процессом обычно является молекулярная диффузия как самый медленный процесс. Если диффузия происходит к плоскому электроду, то диффузионный, ток (для катодного процесса) можно подсчитать из выражения первого закона Фика:
, где С0 — концентрация ионов в глубине электролита; C8—концентрация ионов на поверхности электрода;-δ — толщина диффузионного слоя; D — коэффициент диффузии.
Толщина диффузионного слоя зависит от условий перемешивания электролита — чем выше скорость потоков, обтекающих электрод, тем меньше б. При электролизе расплавленных солей толщина, диффузионного слоя обычно составляет от 0,1 до 1 мм.
Для жидких электродов в расплавленных солях было отмечено (Поляков с сотр.), что толщина диффузионного слоя уменьшается за счет эффекта Марангони: межфазное натяжение на границе металл — электролит имеет разное значение на различных участках поверхности электрода, что вызывает течение жидкости от участков с меньшим межфазным натяжением к участкам с большим межфазным натяжением. Это дополнительное перемешивание может уменьшить δ на порядок.
При падении концентрации С, до нуля получается максимальный ток диффузии — так называемый предельный диффузионный ток: id=nFDC0/δ.
Связь между перенапряжением и диффузионным током дается выражением:
из которого следует, что в области предельного тока происходит резкий сдвиг потенциала в отрицательную сторону и на поляризационной кривой отмечается площадка предельного тока. Потенциал электрода при этом сдвигается настолько, что начинается разряд другого, более электроотрицательного катиона (например, катиона фона). Если строить поляризационную кривую до предельного тока, то в координатах ηd-1n (1 -i/id) получается прямая, наклон которой позволяет определить п — число электронов, участвующих в электрохимической реакции.
Если перенапряжение определяется замедленностью диффузии анионов в процессе анодного разряда, то соответствующее уравнение связи между током диффузии и перенапряжением будет
где id — предельный ток диффузии анионов, А/см 2 .
Перенапряжение реакции
Вызвано замедлением химических реакций на стадиях до или после разряда — ионизации. Рассмотрим гетерогенную реакцию, следующую после разряда, как наиболее важную для дальнейшего изложения.
Предположим, что электрохимический процесс состоит из двух последовательных стадий: окисления вещества R: R — ne ⇄ Oс образованием промежуточного окисленного вещества О, адсорбирующегося на поверхности электрода, и гетерогенной реакции O ⇄ A , при которой образуется конечный продукт А. Допустим, что стадия разряда протекает быстро, практически равновесно, в то время как последующая гетерогенная реакция — медленно. Скорость этой медленной стадии слагается из скорости прямого процесса, пропорциональной поверхностной концентрации вещества О в степени р (порядок реакции), и скорости обратного процесса υ = υ — υ = kC0 p —υ , где k — константа скорости реакции, см/с.
При равновесии скорости этих процессов равны: υ0=υ=υ =kC0 p при этом С0 — поверхностная концентрация вещества в равновесии, моль/см 2 . Если в процессе имеется большой избыток вещества А и его концентрация не зависит от потенциала, то независимой будет и C0 Перенапряжение реакции определяется выражением:
где С0—поверхностная концентрация вещества О при поляризации. Скорость процесса, или плотность тока
Ho nFυ0= i0 — плотность тока при равновесии (ток обмена), поэтому
Из выражений (34) и (35) вытекает связь между плотностью тока и перенапряжением:
Если i/io » 1, то получится уравнение Тафеля:
В координатах ηр — ln i эта зависимость выражается прямой линией, как и в случае перенапряжения перехода, но вместо коэффициента переноса здесь фигурирует порядок гетерогенной химической реакции р, и коэффициент b в уравнении Тафеля будет существенно меньшим.
Механизм катодного процесса алюминия
Катодный процесс включает в себя следующие последовательно идущие стадии: транспорт оксифторидных и фторидных комплексов, содержащих ионы алюминия, из глубины расплава к катоду; распад комплексов в двойном слое с образованием свободных ионов Аl 3+ . и разряд ионов Аl 3+ . Не исключено, что разряд происходит непосредственно из комплексных ионов, минуя стадию их распада. При восстановлении алюминия из криолито-глиноземных расплавов на индифферентном катоде (например, вольфрамовом) обнаруживаются на поляризационных кривых две площадки (Антипин), отвечающие двум процессам: Аl 3 +2е = Аl+, Аl + +е = Аl. Если катод — жидкий алюминий, процесса перезаряда нет, поскольку в присутствии алюминия быстро устанавливается равновесие между ионами Al 3+ , Аl + и металлом.
Импедансные измерения, т. е. исследование комплексного сопротивления электродной системы алюминий — криолито-глиноземный расплав в цепи переменного тока
в зависимости от частоты, позволили оценить величину тока обмена для этой системы. Оказалось, что ток обмена при температуре электролиза составляет около 20 А/ /см 2 , т. е. алюминиевый электрод является практически обратимым и перенапряжение перехода составляет всего несколько милливольт. Эти измерения указали на диффузионный характер перенапряжения.
Исследования поляризации алюминиевого электрода в лабораторной ячейке (Борисоглебский и др.) в условиях, когда анодный процесс сводился к растворению алюминия (т. е. анодных газов не выделялось) и перемешивание анолита и католита было минимальным, показало, что на поляризационных кривых имеются площадки предельного тока (рис. 17, кривая /).
С повышением температуры и при перемешивании расплава предельная плотность тока повышается. Катодный выход по току при достижении предельной плотности тока проходит через максимум (кривая 2) и содержание натрия в алюминии (кривая 3) скачкообразно повышается до предельной растворимости при данной температуре. Все эти факты несомненно указывают на диффузионный характер перенапряжения на алюминиевом катоде.
Рис. 17. Совместное выделение алюминия и натрия в условиях лабораторного эксперимента при 970 °С, К.О. = 3,0, концентрация Аl2O3 —5% (по массе) (Борисоглебский): 1—катодная поляризационная кривая; 2 — выход по току для алюминия; 3 — содержание натрия в алюминии
С ростом плотности тока в прикатодном слое уменьшается концентрация комплексных оксифторидных и фторидных ионов, содержащих катионы Аl 3+ , и увеличивается концентрация ионов Na + . Поскольку электрод обратимый (перенапряжение перехода отсутствует), рост концентрации ионов Na+ приводит к повышению содержания натрия в алюминии и сдвигу потенциала в отрицательную сторону. Следовательно, происходит совместный разряд ионов алюминия и натрия, только натрий не выделяется в виде отдельной фазы (пузырька при атмосферном давлении), а растворяется в алюминии и в солевом расплаве.
При предельной плотности тока потенциал достигает величины, при которой происходит выделение натрия в виде самостоятельной фазы, содержание натрия становится предельным при данной температуре. Дальнейшее повышение плотности тока приводит к уменьшению выхода по току для алюминия, поскольку все большие количества натрия разряжаются при неизменном количестве образующегося алюминия. Содержание натрия в алюминии не изменяется, так как достигнут предел его растворимости.
Таким образом, при -всех условиях электролиза имеет место совместный разряд алюминия и натрия, причем последний обычно выделяется в виде раствора в алюминии. Поскольку оба металла выделяются на одном электроде, их потенциалы должны быть одинаковы:
При поляризации католит обогащается фторидом натрия и обедняется фторидом алюминия по сравнению с равновесным составом. Поэтому величина поляризации катода равна э. д. с. концентрационной цепи:
Здесь в первом полуэлементе представлены состав электролита и сплава алюминий — натрий для равновесного электрода, во втором — для поляризованного,
Э. д. с. цепи равна
Диффузионный потенциал на границе раздела полуэлементов:
поскольку ток переносится только ионами натрия. Поэтому
Используя выражение для константы равновесия реакции
Катодное перенапряжение может быть определено, если известно содержание натрия в алюминии для равновесного электрода и для поляризованного. Поскольку концентрация натрия в растворе с алюминием мала, отношение активностей можно заменить отношением концентрации:
Многочисленные измерения концентрации натрия в алюминии на промышленных электролизерах показывают, что содержание натрия обычно меньше или равно его равновесному значению.
Электролит и металл в промышленных ваннах находятся в непрерывном движении, при этом на поверхности металла образуются волны. Движение электролита и металла способствует снятию перенапряжения диффузии, и алюминиевый электрод является практически равновесным.
Выделение натрия на алюминии определяется в основном криолитовым отношением и температурой: чем они выше, тем больше выделяется натрия. Натрий уходит из алюминия двумя путями: 1) растворяется в электролите, переносится к аноду и окисляется; 2) проходит через толщу алюминия и поглощается угольной футеровкой. Первый путь приводит к значительным потерям тока и к снижению выхода по току, второй — к преждевременному разрушению угольной футеровки электролизеров.
Статья на тему Кинетика электродных процессов алюминия
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
🎦 Видео
Решение задач на термохимические уравнения. 8 класс.Скачать

Электролиз: как понять и научиться писать реакции электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

10 класс § 7 "Классификация химических реакций. Окислительно-восстановительные реакции"Скачать

Использование уравнения Аррениуса для решения задач (1/2). Химия для поступающих.Скачать

Энтальпия реакции. Решение задачи.Скачать

Все реакции с металлами за 1 урок | ЕГЭ по химии 2024 | Екатерина СтрогановаСкачать

Ядерные реакции. Простой и понятный советский научный фильм.Скачать

Лекция 4 на тему Основные типы химических реакцийСкачать

Техническая механика/Определение реакций в жесткой заделке.Скачать

Моделирование коррозии в COMSOL MultiphysicsСкачать

Электролиз расплава гидроксида хлорида КАЛИЯ_Скачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

4 3 Электрохимический потенциалСкачать

Лекция 12 Модель Батлера ФольмераСкачать