Расчеты горения ведут по химическим уравнениям реакций, используя законы газового состояния: Бойля – Мариотта 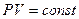
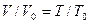
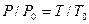
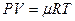
Рассмотрим реакцию горения водорода в кислороде: 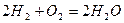
Рассмотрим реакцию горения метана в кислороде: 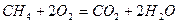
В практических условиях сжигание газа осуществляется в воздухе. Примем состав сухого воздуха: О2 – 21 %, N2 – 79%. Следовательно, 1 м 3 кислорода содержится в 100/21 = 4,76 м 3 воздуха. Или на 1 м 3 кислорода приходится 3,76 м 3 азота. Отсюда условная формула воздуха: (О2 + 3,76N2).
Запишем реакцию горения водорода в воздухе:
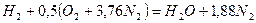
Из уравнения следует, что при нормальных условиях для полного сгорания 1 м 3 водорода требуется 0,5 × 4,76 = 2,38 м 3 воздуха. Таким образом, для сгорания 1 м 3 водорода требуется 2,38 м 3 воздуха. В результате образуются продукты сгорания: 1 м 3 воды в виде пара и 1,88 м 3 азота.
Запишем реакцию горения метана в воздухе:
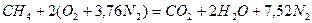
Из уравнения следует, что для полного сгорания 1 м 3 метана необходимо 2 × 4,76 = 9,52 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 метана требуется 9,52 м 3 сухого воздуха. Продукты сгорания содержат 1 м 3 диоксида углерода, 2 м 3 паров воды и 7,52 м 3 азота.
Запишем реакцию горения пропана в воздухе:
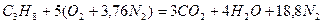
Из уравнения видно, что для полного сгорания 1 м 3 пропана необходимо 5 × 4,76 = 23,8 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 пропана требуется 23,8 м 3 сухого воздуха.
Приведенные расчеты выполнены для стехиометрических уравнений и полученные соотношения воздуха и газа называются стехиометрическими. Например, для горения метана в воздухе стехиометрическое соотношение – 9,52. В реальных условиях воздуха может не хватать для полного сгорания газа или, напротив, воздух подается в избыточном количестве. Для характеристики реальных соотношений воздуха и газа в процессе горения введена безразмерная величина: коэффициент избытка воздуха (окислителя) – коэффициент α. Для стехиометрического соотношения α = 1. Если имеет место недостаток воздуха, то α 1. Например, в процессе горения израсходовано 23 м 3 воздуха и 2 м 3 метана. Подсчитываем коэффициент α. Реальное соотношение воздуха и газа 23/2 = 11,5. Отсюда α = 11,5/9,52 = 1,2.
Выше показано, как можно подсчитывать необходимое количество воздуха для сгорания и определять объем продуктов сгорания для индивидуальных газов. Но обычно используемый газ – смесь различных газов. В этом случае расчет теоретически необходимого объема воздуха (воздуха сухого) ведется по формуле:
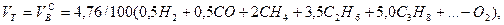
где 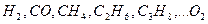
Используемый для сжигания атмосферный воздух содержит влагу, поэтому расчет объема влажного воздуха производят по формуле:
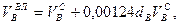
где 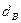
0,00124 – объем 1 г водяного пара.
И, наконец, определяется объем воздуха действительный с учетом величины коэффициента α по формуле:
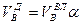
Пример. Имеется газ состава СН4 – 95%, С3Н8 – 5%. Определить объем воздуха действительного для сжигания данного газа при α = 1,1 и 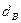

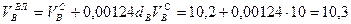
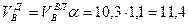
Объем продуктов сгорания газовой смеси определяется по следующим формулам.
Объем диоксида углерода
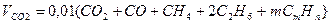
Объем водяных паров
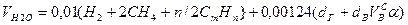
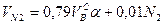
где N2 – процентное содержание азота в газовой смеси.
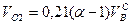
Суммарный объем продуктов сгорания

Дата добавления: 2015-06-22 ; просмотров: 8141 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
- Горение метана
- Метан: способы получения и свойства
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- 📹 Видео
Видео:Уравнивание реакций горения углеводородовСкачать

Горение метана
Метан представляет собой газообразное химическое соединение с химической формулой CH4. Это самый простой представитель алканов. Другие названия этой группы органических соединений: предельные, насыщенные или парафиновые углеводороды. Они характеризуются наличием простой связи между атомами углерода в молекуле, а все остальные валентности каждого углеродного атома насыщены атомами водорода. Для алканов наиболее важной реакцией является горение. Они горят с образованием газообразной двуокиси углерода и паров воды. В результате выделяется огромное количество химической энергии, которая превращается в тепловую или электрическую. Метан является горючим веществом и основным компонентом природного газа, что и делает его привлекательным топливом. В основе широкого использования природного ископаемого лежит реакция горения метана. Поскольку он в нормальных условиях является газом, то его трудно транспортировать на далекие расстояния от источника, поэтому часто его предварительно сжижают.
Процесс горения заключается в реакции между метаном и кислородом, то есть в окислении простейшего алкана. В результате образуется двуокись углерода, вода и много энергии. Горение метана может быть описано уравнением: CH4 [газ] + 2O2 [газ] → CO2 [газ] + 2H2O [пар] + 891 кДж. То есть одна молекула метана при взаимодействии с двумя молекулами кислорода образует молекулу двуокиси углерода и две молекулы воды. При этом выделяется тепловая энергия, равная 891 кДж. Природный газ является самым чистым для сжигания ископаемым, так как уголь, нефть и другие виды топлива более сложные по составу. Поэтому при сгорании они выделяют в воздух различные вредные химические вещества. Поскольку природный газ в основном состоит из метана (примерно на 95%), то при его сжигании практически не образуются побочные продукты или их получается намного меньше, чем в случае с другими видами ископаемого топлива.
Теплотворная способность метана (55,7 кДж/г) выше, чем его гомологов, например, этана (51,9 кДж/г), пропана (50,35 кДж/г), бутана (49,50 кДж/г) или других видов топлива (древесина, уголь, керосин). Горение метана дает больше энергии. Для обеспечения в течение года работы лампочки накаливания мощностью 100 Вт необходимо сжечь 260 кг древесины, или 120 кг угля, или 73,3 кг керосина, или всего 58 кг метана, что соответствует 78,8 м³ природного газа.
Простейший алкан является важным ресурсом для получения электроэнергии. Происходит это за счет сжигания его в качестве топлива котла, вырабатывающего пар, который приводит в движение паровую турбину. Также горение метана используется для получения горячих дымовых газов, энергия которых обеспечивает работу газовой турбины (сжигание осуществляется до турбины или в самой турбине). Во многих городах метан подается по трубам в дома для внутреннего отопления и приготовления пищи. По сравнению с другими видами углеводородного топлива сжигание природного газа характеризуется меньшим выделением углекислого газа и большим количеством полученного тепла.
Горение метана используется для достижения высоких температур в печах различных химических производств, например, крупнотоннажных этиленовых установок. Природный газ в смеси с воздухом подается в горелки печей пиролиза. В процессе сгорания образуются дымовые газы с высокой температурой (700—900 °С). Они нагревают трубы (находятся внутри печи), в которые подается смесь сырья с водяным паром (для снижения образования кокса в трубах печей). Под действием высоких температур происходит множество химических реакций, в результате которых получают целевые компоненты (этилен и пропилен) и побочные продукты (смола пиролизная тяжелая, водородная и метановая фракции, этан, пропан, углеводороды С4, С5, пироконденсат; каждый из них имеет свое применение, например, пироконденсат используют для получения бензола или компонентов автомобильного бензина).
Горение метана является сложным физико-химическим явлением на основе экзотермической окислительно-восстановительной реакции, характеризующейся высокой скоростью течения и выделением огромного количества тепла, а также теплообменными и массообмеными процессами. Поэтому расчетное определение температуры горения смеси представляет собой сложную задачу, так как кроме состава горючей смеси сильно влияют ее давление и начальная температура. С их увеличением наблюдается рост температуры горения, а теплообменные и массообменые процессы способствуют ее снижению. Температура горения метана при проектировании процессов и аппаратов химических производств определяется расчетным методом, а на действующих установках (например, в печах пиролиза) ее измеряют с помощью термопар.
Видео:Горение метанаСкачать

Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Горение. 7 класс.Скачать

Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:Взрыв смеси метана с кислородомСкачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Получение метана и его горениеСкачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:Горение метанаСкачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Видео:горение железа в кислородеСкачать  Получение метанаВидео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. Видео:Горение метана в кислородеСкачать  3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. 📹 ВидеоХимия. 11 класс. Алканы. Горение метана, этилена, ацетилена /16.09.2020/Скачать  Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать  Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Физика: горение и взрывСкачать  Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  |















