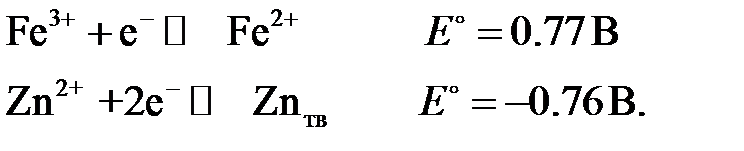Для регистрации классических полярограмм ячейку с капающим ртутным рабочим электродом и насыщенным каломельным электродом сравнения (или донной ртутью) через калиброванное линейное сопротивление присоединяют к источнику постоянного напряжения и изменяют потенциал со скоростью 2—5 мВ/с. Для обеспечения достаточно высокой электропроводности в ячейку помещают 0,05—1 М раствор индифферентного электролита (фона).
Вклад других, недиффузионных механизмов поступления ионов в прикатодный слой в условиях большого избытка индифферентного фонового электролита пренебрежимо мал. Основное значение среди недиффузионных процессов имеет миграция ионов к катоду под действием электрического поля. Если не устранить вызываемый этим процессом миграционный ток, общий ток окажется неконтролируемым. Подавление миграционного тока достигается введением в раствор в достаточной концентрации так называемого индифферентного, т.е. не принимающего участия в электродной реакции, или фонового электролита со значительно более отрицательным потенциалом выделения, чем у анализируемого иона. Катионы фонового электролита экранируют электрод, уменьшая тем самым движущую силу миграции под действием электрического поля практически до нуля.
При некотором потенциале катода концентрация ионов у поверхности ртутной капли См уменьшится до ничтожно малой по сравнению с концентрацией в массе раствора, и скорость разряда ионов на катоде станет равной скорости диффузии.
Концентрация восстанавливающегося иона в глубине раствора постоянна, так как электролиз идет при очень небольшой силе тока (порядка 10 -5 А), а концентрация в прикатодном слое близка к нулю. Поэтому разность концентраций, определяющая скорость диффузии при данной температуре, будет постоянна, что и приводит к постоянной скорости поступления ионов к катоду. Наступившее состояние равновесия будет характеризоваться постоянной силой тока, не изменяющейся при дальнейшем увеличении напряжения. Этот постоянный ток, контролируемый диффузией, называют диффузионным и обозначают Iд.
Зависимость силы тока от приложенного напряжения при обратимом электродном процессе выглядит следующим образом:

Это уравнение полярографической волны, а величину Е½ называют потенциалом полуволны.

Рис. 2. Зависимость силы тока от приложенного напряжения (полярографическая волна) (Классическая полярограмма в идеализированном виде)
Типичная зависимость силы тока от приложенного напряжения дана на рис. 2. Это полярографическая волна (полярограмма). Из рисунка видно, что в начале процесса при небольшом потенциале катода сила тока медленно увеличивается с возрастанием потенциала — это так называемый остаточный ток, его величина имеет порядок 10 -7 А. По достижении потенциала восстановления на катоде начинается разряд ионов и сила тока резко возрастает, стремясь к предельной величине диффузионного тока. При I = ½Id уравнение (1) переходит в
Это соотношение показывает независимость потенциала полуволны от силы тока и, следовательно, от концентрации восстанавливающегося иона. Потенциал полуволны является, таким образом, качественной характеристикой иона в растворе данного фонового электролита и определение потенциала полуволны составляет основу качественного полярографического анализа.
Однако потенциал полуволны существенно зависит от среды, природы и концентрации фонового электролита. Особое значение имеет наличие в растворе веществ, способных к комплексообразованию с определяемым ионом. Присутствие в исследуемом растворе лиганда смещает потенциал полуволны в отрицательную область, что используется для определения состава и констант устойчивости координационных соединений. Сдвиг потенциала полуволны при введении в раствор лиганда значительно расширяет возможности полярографического анализа, позволяя создавать условия для определения нескольких компонентов в одном растворе без их предварительного разделения.
Если в растворе находится несколько веществ, потенциалы полуволны которых различаются на 20 мВ и больше, то на полярограмме будет не одна волна, а несколько — по числу восстанавливающихся ионов (рис. 3), а возможно и больше, так как при ступенчатом восстановлении один ион может давать две волны. Можно получить таким образом полярографический спектр ионов, а затем по этим данным и измеренному потенциалу понятно, что положение элемента в таком спектре будет зависеть от фонового электролита: его природы и концентрации.
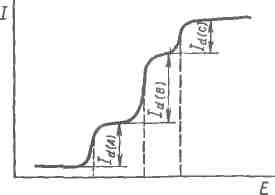
Рис. 3. Классическая полярограмма в идеализированном виде для нескольких (трех) электродоактивных компонентов в смеси
Полярограмма, изображенная на рис. 2, несколько идеализирована, так как на ней не видны осцилляции тока, вызванные периодическим отрывом капель ртути. Иногда эти осцилляции очень затрудняют работу особенно в области малых концентраций определяемого элемента.
Кроме того, на полярограммах нередко возникают максимумы различной формы, мешающие определению истинного потенциала полуволны и. силы тока. Различают максимумы I и II рода. Теория связывает их появление с гидродинамическими явлениями в растворе, вызываемыми каплями ртути, и адсорбционными процессами. Для подавления максимумов в полярографируемый раствор обычно вводят поверхностно-активные вещества: желатин, агар-агар и др. Подавление максимумов поверхностно-активными веществами лежит в основе нескольких чувствительных (до 10 -9 моль/л) аналитических методик определения этих веществ в растворе.
Связь диффузионного тока Iд с концентрацией иона См и другими величинами передается уравнением Ильковича.
Формула, получена Ильковичем, для капающего ртутного электрода.
при следующих допущениях:
1) скорость диффузии является определяющим фактором (для обратимого электродного процесса это справедливо для любой точки волны, для необратимого — только для потенциалов предельного тока);
2) ртутная капля является свободным шаром;
3) на расстояниях х ½ m ⅔ t 1/6 c (3)
где n — число электронов, участвующих в электрохимической реакции; D— коэффициент диффузии, см 2 с -1 ; т — — масса ртути, вытекающий из капилляра в 1 с, мг·с -1 ; t— время жизни капли (период капания), с; с — концентрация, ммоль/л; Iд — ток, мкА.
Среди величин, входящих в это уравнение, труднее всего поддается экспериментальному определению коэффициент диффузии D, а использование соответствующих справочных данных не всегда возможно. Поэтому коэффициент пропорциональности между концентрацией вещества и силой диффузионного тока обычно устанавливают с помощью стандартных растворов. Действительно, при постоянных условиях полярографирования D, т и t постоянны и уравнение переходит в
В связи с этим в работах по полярографии всегда указывается так называемая характеристика капилляра, вычисляемая как т 2/3 t 1/6 . Линейная зависимость (4) является основой количественного полярографического анализа.
Видео:Основное уравнение динамики вращательного движения. 10 класс.Скачать

Модуль 3. Лекция 8
Модуль 3. Лекция 8.
1. Полярографический анализ (полярография). Общие понятия, принцип метода.
Полярографический анализ (полярография) основан на использовании следующих зависимостей между электрическими параметрами электрохимической (в данном случае — полярографической) ячейки, к которой прилагается внешний потенциал, и свойствами содержащегося в ней анализируемого раствора.
а) В качественном полярографическом анализе используют связь между величиной приложенного на микроэлектроде внешнего электрического потенциала, при котором наблюдается восстановление (или окисление) анализируемого вещества на микроэлектроде в данных условиях, и природой восстанавливающегося (или окисляющегося) вещества.
б) В количественном полярографическом анализе используют связь между величиной диффузионного электрического тока, устанавливающегося в полярографической ячейке после достижения определенного значения приложенного на микроэлектроде электрического потенциала, и концентрацией определяемого (восстанавливающегося или окисляющегося) вещества в анализируемом растворе.
Электрические параметры — величину приложенного электрического потенциала и величину диффузионного тока — определяют при анализе получаемых поляризационных, или вольт-амперных, кривых, отражающих графически зависимость электрического тока в полярографической ячейке от величины приложенного потенциала микроэлектрода. Поэтому полярографию иногда называют прямой вольтамперометрией.
Рис. 1. Схема полярографической ячейки с ртутным капающим электродом и с ртутным анодом (а) или с насыщенным каломельным электродом (б):
1 — ртутный капающий электрод, 2 — ртутный анод, 3 — анализируемый раствор, 4 — резервуар с жидкой ртутью, 5 — проводники к внешнему источнику постоянного тока, 6 — насыщенный каломельный электрод, 7— пробка из пористого стекла
Классический полярографический метод анализа с применением ртутного капающего (капельного) электрода был разработан и предложен в 1922 г. чешским ученым Ярославом Гейровским (1890—1967), хотя сам ртутный капающий электрод применялся чешским физиком Б. Кучерой еще в 1903 г. В 1925 г. Я. Гейровский и М. Шиката сконструировали первый полярограф, позволивший автоматически регистрировать поляризационные кривые. В дальнейшем были разработаны различные модификации полярографического метода.
Рассмотрим кратко сущность классической полярографии, основанной на использовании ртутного капающего микроэлектрода.
На рис. 1, а показана схема полярографической ячейки с ртутным капающим микроэлектродом — катодом. В сосуде, в который вносится анализируемый раствор с определяемым веществом, имеются два электрода — микрокатод и макроанод, подключенные к внешнему источнику постоянного электрического тока. На микрокатод прилагается постепенно возрастающий по абсолютной величине отрицательный электрический потенциал.
Рис. 2. Полярограмма водного щелочного 0,0005 моль/л раствора нитрата свинца при 25 °С ( i — ток, Е — потенциал):
1 — остаточный ток, 2 — предельный ток. Значения потенциала даны относительно насыщенного каломельного электрода, iD — диффузионный ток, Е1/2 — потенциал полуволны
Поверхность ртутного капающего микроэлектрода, т. е. ртутной капли, очень мала, тогда как поверхность анода — большая.
В качестве макроэлектрода — анода на практике наиболее часто применяют не ртутный, а насыщенный каломельный электрод (рис.1, б), по отношению к которому обычно и измеряют потенциал капающего ртутного микрокатода.
Анализируемый раствор содержит кроме определяемого вещества также индифферентный — фоновый — электролит (фон), ионы которого не разряжаются на электродах в условиях проведения полярографического анализа, а служат в качестве токопроводящих частиц для поддержания определенной величины электрического тока в ячейке, когда определяемое вещество еще не восстанавливается на микрокатоде.
Пусть определяемое вещество — это катионы Мn+, присутствующие в анализируемом растворе.
2.2. Полярографические кривые, потенциал полуволны, связь величины диффузионного тока с концентрацией.
На рис. 2. показано изменение электрического тока i, проходящего через полярографическую ячейку, как функции возрастающего потенциала Е, приложенного на ртутном капающем микрокатоде, — так называемая поляризационная, или вольт-амперная, кривая. При постепенном повышении приложенного потенциала вначале электрический ток, обусловленный присутствием ионов фонового электролита, растворенного кислорода и восстанавливающихся возможных примесей, возрастает очень медленно — остается почти постоянным. Это — так называемый остаточный ток. При некотором значении потенциала, называемого потенциалом выделения, ток в ячейке резко возрастает (фарадеевский ток) и при сравнительно небольшом дальнейшем повышении потенциала достигает максимального, возможного в данных условиях значения, после чего снова изменяется мало. Это — так называемый предельный ток. Разность между предельным и остаточным током составляет диффузионный ток iD.
Ртутная капля по мере ее формирования на конце капилляра (вытекания из капилляра) остается заряженной отрицательно до тех пор, пока она не оторвется от капилляра и окруженной раствором. В поверхностном приэлектродном слое раствора около ртутной капли находятся катионы Мn+ определяемого вещества, которые разряжаются на ртутной капле по схеме
амальгама металла М
при достижении величины потенциала выделения, характерного и специфичного только для данных катионов. После достижения потенциала выделения эти катионы очень быстро разряжаются на ртутной капле, поэтому электрический ток в полярографической ячейке резко возрастает. Концентрация катионов Мn+ в поверхностном приэлектродном слое раствора около ртутной капли столь же резко понижается (поскольку катионы восстанавливаются до металла) и становится меньше их концентрации в объеме анализируемого раствора.
Транспорт катионов Мn+ в поверхностный приэлектродный слой раствора, окружающий ртутную каплю, поддерживается за счет диффузии катионов Мn+ из объема раствора и зависит от скорости их диффузии. При дальнейшем повышении приложенного потенциала ртутных капель достигается максимально возможная скорость диффузии, которая остается практически постоянной, так что при данной концентрации катионов в растворе ток в полярографической ячейке также достигает максимального, практически постоянного значения. Устанавливается стационарный предельный ток.
Если концентрацию катионов Мn+ в растворе увеличить, то увеличится и число стационарно восстанавливающихся катионов, т. е. возрастает предельный и диффузионный ток. Таким образом, величина предельного и диффузионного тока в полярографической ячейке зависит от концентрации определяемого вещества (восстанавливающегося на ртутном капающем электроде) в анализируемом растворе, тогда как значение потенциала выделения зависит от природы разряжающихся частиц и не зависит от их концентрации.
Количество катионов, восстанавливающихся на ртутном капающем электроде, незначительно и практически не сказывается на изменении концентрации этих катионов в объеме раствора.
Вещество, разряжающееся на микрокатоде, называют деполяризатором, полярографически активным, электроактивным. Эти названия условны, поскольку вещество может быть полярографически неактивно при одном потенциале и полярографически активно при более высоком потенциале.
Вместо потенциала выделения на практике определяют потенциал полуволны Е1/2, соответствующий половине величины диффузионного тока (рис. 2.).
Полученную полярографическую кривую называют, как отмечалось выше, полярограммой, или полярографической волной. При использовании капающего ртутного электрода на полярограмме наблюдаются осцилляции тока (его периодическое небольшое увеличение и уменьшение). Каждая такая осцилляция соответствует возникновению, росту и отрыву ртутной капли от капилляра микрокатода.
В некоторых современных полярографах электрический ток измеряется только в конце каплеобразования, что позволяет устранить осцилляции на полярограмме.
На ртутном капающем микрокатоде происходит постоянное возобновление ртутных капель, на поверхности которых осуществляется разряд катионов. Поверхность такого электрода все время обновляется за счет новых ртутных капель, что исключает изменение его свойств вследствие проткающих на нем электрохимических процессов и составляет одно из главных достоинств использования ртутного капающего электрода.
Таким образом, при проведении качественного и количественного полярографического анализа используют два параметра, получаемые при рассмотрении полярограмм: потенциал полуволны Е1/2 и величину диффузионного тока iD (высоту h полярографической волны).
Как указывалось выше, потенциал полуволны Е1/2 характеризует природу восстанавливающегося катиона и не зависит от его концентрации. Для разных катионов, полярографируемых в одних и тех же условиях, он неодинаков, что и позволяет открывать различные катионы в растворе. Потенциал полуволны Е1/2 зависит, кроме природы самого восстанавливающегося вещества, от природы растворителя, фонового электролита, состава и pH анализируемого раствора, присутствия веществ-комплексообразователей, температуры. Величина потенциала полуволны открываемого или определяемого катиона должна быть меньше величины потенциала разряда ионов фонового электролита.
Рис. 3. Полярограмма раствора, содержащего катионы кадмия и свинца; i — ток, Е — приложенный потенциал относительно насыщенного каломельного электрода
В табл. 1. приведены в качестве примера значения потенциала полуволны для некоторых катионов с указанием состава фона. Из данных табл. 1. следует, что состав фона и pH раствора существенно влияют на величину потенциала полуволны.
Если в анализируемом растворе присутствуют несколько восстанавливающихся веществ, причем разность между значениями их потенциалов полуволны составляет не менее 0,2 В, то на полярограмме наблюдаются несколько волн (рис. 3.), каждая из которых отвечает тому или иному восстанавливающемуся веществу.
Таблица 1. Значения потенциала полуволны Е1/2 некоторых катионов металлов (относительно потенциала насыщенного каломельного электрода).
Видео:Уравнение Мещерского и формула Циолковского LIVE | 11 класс, студенты МФТИ | Вузовская физика с FСкачать

Классическая полярография
Полярографический метод качественного и количественного анализа электрохимически активных веществ основан на процессах их окисления или восстановления, протекающих при поляризации рабочего микроэлектрода под действием приложенного напряжения. При этом конкретную аналитическую информацию получают при интерпретации поляризационных кривых (полярограмм), выражающих зависимость силы тока от приложенного постоянного (по форме) напряжения – I=f(E).
Учитывая, что интенсивность поляризации электрода возрастает при увеличении плотности тока (отношения силы тока к площади поверхности электрода), поверхность рабочего микроэлектрода делают очень маленькой, а поверхность электрода сравнения – наоборот, достаточно большой, чтобы исключить (или свести к минимуму) его поляризацию. В отличие от гальванического элемента, где электрохимическая реакция протекает самопроизвольно, в полярографической (электролитической) ячейке идет обратный процесс – электролиз, когда в электролитической ячейке под действием приложенного напряжения на рабочем электроде протекает направленная электрохимическая реакция. При этом на поляризуемом катоде восстанавливаются вещества-окислители (в том числе и катионы металлов), а на поляризуемом аноде – окисляются вещества, обладающие восстановительными свойствами.
Электроды, применяемые в полярографии
В полярографии обычно используют электролитическую ячейку с двумя электродами: рабочим микроэлектродом и электродом сравнения с постоянным значением электродного потенциала. Иногда для стабилизации потенциала электрода сравнения применяют третий вспомогательный электрод для отвода по нему тока от рабочего электрода. Выбор материала рабочего электрода зависит от типа электрохимической реакции и от природы определяемого вещества. Например, при восстановлении ионов электроотрицательных металлов (Zn 2+ , Cd 2+ , Pb 2+ и др.) и многих органических веществ используют ртутный капающий катод, у которого потенциал разложения воды с выделением водорода и кислорода составляет –1.1 В. На платиновом вращающемся электроде можно проводить восстановление ионов электроположительных металлов (Cu 2+ , Ag + ) и таких сильных окислителей, как KMnO4, K2Cr2O7. На платиновом аноде можно окислять Fe(II) и различные органические соединения, обладающие восстановительными свойствами. Для определения Fe(III) и Cu(II) используют также графитовые и стеклоуглеродные электроды.
Для ориентировочной оценки целесообразности применения того или иного рабочего электрода можно пользоваться стандартными потенциалами электродных полуреакций. Например,
| +E, B |
| –E, B |
| Ia |
| Iк |
| 1.0 |
| 1.0 |
| H2 |
| H2 |
| H2 |
| O2 |
| O2 |
 |
| O2 |
Рисунок 4.6 – Вольтамперные кривые процессов выделения водорода (катодная область) и кислорода (анодная область) на платиновом (1), графитовом (2) и ртутном (3) электродах (фоновый раствор – 0.2 М H2SO4)
Более строго, необходимо учитывать влияние фонового раствора в электролитической ячейке. Из представленных на рис. 4.6 вольтамперных кривых видно, что ртутный электрод пригоден для электрохимических реакций, протекающих при отрицательных значениях потенциала, а платиновый и графитовый электроды – для реакций, протекающих в положительной области потенциала.
Основным критерием выбора электрода сравнения является его малая поляризуемость, т.е. постоянство потенциала при наложении напряжения на полярографическую ячейку, что обеспечивается большой поверхностью электрода. Выбор электрода сравнения зависит от состава раствора в ячейке. Чаще других используют насыщенный каломельный и хлоридсеребряный электроды. В качестве вспомогательных электродов используют электроды из благородных металлов, анодную (донную) ртуть и др.
Поляризационная кривая, выражающая зависимость силы тока от приложенного к ячейке напряжения I=f(E), отражает электрохимический процесс, происходящий только на рабочем микроэлектроде, так как всё накладываемое на ячейку напряжение расходуется на изменение потенциала только рабочего электрода (потенциал неполяризуемого электрода сравнения остается неизменным). При увеличении накладываемого напряжения потенциал поляризуемого микроэлектрода будет все более возрастать, принимая все более положительные значения для анода (Е=Еа) и все более отрицательные – для катода (Е=–Ек). При поляризации микроэлектрода в отсутствии электроактивных веществ величина тока не зависит от изменения накладываемого напряжения (идеально поляризуемый электрод). Взаимодействие электроактивных веществ (называемых деполяризаторами) с рабочим микроэлектродом подавляет его поляризацию и зависимость I=f(E) становится волнообразной (рис. 4.7).
При использовании стационарных (неподвижных) электродов для устранения конвективного и миграционного переноса электроактивного вещества электролиз (полярографирование) проводят в неперемешиваемом растворе в присутствии большого избытка (0.1 – 1.0 моль×л –1 ) индифферентного фонового электролита (полярографического фона), потенциал восстановления или окисления которого находится вне области используемых потенциалов анализируемого электроактивного вещества. При этих условиях единственным способом переноса электроактивного вещества из объема ячейки в приэлектродный слой является диффузия, а возникающий ток называют диффузионным.
| A |
| В |
| С |
| D |
| h |
| h1/2 |
| E1/2 |
| E |
| I |
Рисунок 4.7 – Поляризационная кривая (полярограмма)
| E, В |
| I, мкА |
Рисунок 4.8 – Полярограмма обратимо (1) и необратимо (2) восстанавливающегося вещества-деполяризатора
На классической полярограмме, полученной с использованием ртутного капающего электрода (катод) (рис. 4.7) с увеличением накладываемого напряжения наблюдается три характерных участка.
АВ – нижняя ветвь кривой, где наблюдается небольшой рост тока, обусловленный, в основном, током заряжения двойного электрического слоя, реакция на электроде отсутствует. При достижении потенциала восстановления (или окисления) электроактивного вещества в точке В начинается процесс электролиза, т.е. рабочий микроэлектрод деполяризуется вследствие протекания на нем электрохимической реакции с электроактивным веществом и на участке ВС наблюдается линейный рост так называемого фарадеевского тока пропорционально градиенту концентрации:
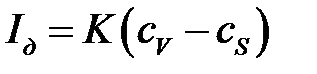
где сV и сS – концентрации электроактивного вещества в объеме раствора и в приэлектродном слое, соответственно; К – коэффициент пропорциональности.
Иногда на полярограмме появляются максимумы, обусловленные движением упавшей в раствор капли ртути. Их устраняют добавлением в ячейку поверхностно-активных веществ (столярный клей и др.). Помехи от растворенного в воде кислорода устраняют предварительной реакцией с восстановителем, обычно используют добавление Na2SO3.
На участке CD рост тока практически прекращается, так как скорость диффузии ионов в приэлектродный слой значительно меньше скорости разряжения их на рабочем электроде, поэтому концентрация ионов электроактивного вещества в приэлектродном слое стновится близкой к нулю (сS≈0) и наступает состояние так называемой концентрационной поляризации. При этом диффузионный ток достигает своего максимального (предельного) значения и так как сS≈0, то уравнение (4.5) принимает простой вид:
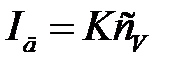
Константа К в уравнениях (4.5) и (4.6) зависит от природы и характеристик рабочего микроэлектрода, на котором протекает электрохимическая реакция. Так, для ртутного капающего электрода согласно уравнению Ильковича
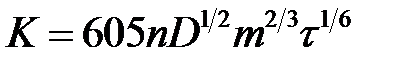
где n – число электронов, участвующих в электродной реакции; D – коэффициент диффузии ионов, см 2 ×с –1 ; m – масса капли ртути, вытекающей из капилляра за 1 с; τ – время образования капли ртути, с.
Для стационарного твердого электрода
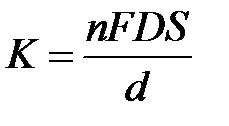
где n – число электронов, F – число Фарадея, 96487 Кл×(моль×экв) –1 ; D – коэффициент диффузии, см 2 ×с –1 ; S – площадь поверхности электрода, см 2 ; d – толщина приэлектродного слоя, см.
Уравнение (4.7) используется при количественных определениях в вольтамперометрии с применением стационарных твердых электродов.
В тех случаях, когда самой медленной стадией процесса является диффузия, электродный процесс называют обратимым и получаемая при этом полярограмма имеет более крутой линейный участок (рис. 4.8).
Особенностью полярограмм, получаемых с помощью твердых стационарных электродов, является наличие максимумов так называемого броскового тока на вольтамперных кривых (рис. 4.9), что обычно связывают с замедленным формированием диффузионного слоя у поверхности стационарного твердого электрода.
| Iброск. |
| E |
| I |
| Iстаб. |
Рисунок 4.9 – Полярограмма, полученная на твердом электроде: Iброск. – «бросковый» ток; Iстаб. – стабильный ток
На высоту максимума влияет скорость поляризации рабочего электрода. Уменьшение скорости наложения напряжения на электроды приводит к снижению максимума и при некоторых значениях скорости даже к полному исчезновению, но стабильный диффузионный ток остается неизменным.
📹 Видео
Билет №04 "Потенциал электростатического поля"Скачать

Предельные вероятности состоянийСкачать

Связь между напряженностью электростатического поля и напряжением | Физика 10 класс #51 | ИнфоурокСкачать

СИГМА- ПИ- ДЕЛЬТА- СВЯЗЬСкачать

№18. Система уравнений с параметром (профильный ЕГЭ)Скачать

По графику, приведённому на рисунке 6.15, найдите амплитуду ЭДС индукции, период и частоту обращенияСкачать

Электроотрицательность и полярность связи. 10 класс.Скачать

2.5. Рассеяние Релея. Закройте, дует!Скачать

Лекция №3 "Электростатика. Поляризация диэлектриков"Скачать

Поляризация света и закон МалюсаСкачать

Согласование логических уровней 5 и 3.3 вольтовой периферииСкачать

Лекция №11 "Поляризация. Оптика анизотропных сред"Скачать

Урок 218. Напряженность электрического поляСкачать

Задачи по четырехполюсникам. П - образная схемаСкачать

Электрическое поле. Напряженность электрического поля. Силовые линии электрического поля. 10 класс.Скачать

НАПРЯЖЕННОСТЬ ЭЛЕКТРИЧЕСКОГО ПОЛЯ суперпозиция полейСкачать

Диэлектрики в электростатическом поле. Поляризация диэлектриков | Физика 10 класс #48 | ИнфоурокСкачать

Лекция №4 "Оптика" (Попов П.В.). Дисперсия. Интерференция.Скачать